升麻素通过NF-κB通路对支气管上皮细胞过敏性炎症反应的抑制作用
2024-04-09陈俊杰杨道文北京中医药大学北京0009中日友好医院中医肺病一部北京0009
陈俊杰 杨道文 (.北京中医药大学,北京 0009;.中日友好医院中医肺病一部,北京 0009)
哮喘是一种常见的以气道炎症、嗜酸性粒细胞增多、黏液过度分泌、气道重塑、气道高反应性为主要特征的慢性炎症性疾病,其患病率在全球范围内迅速上升[1-2]。哮喘作为一种复杂的疾病,其发病机制与遗传因素和环境因素的相互作用有关[3]。过敏性哮喘是最常见的哮喘表型,常见过敏原包括尘螨、花粉、香料等[4-5]。皮质类固醇和β2受体激动剂的治疗常伴有一系列不良反应并加重病情[6]。因此,开发新的治疗药物对于延缓哮喘进展、避免哮喘发作有重要意义。我国传统中药材防风具有解热、镇痛、抗炎等药理活性。YAO等[7]研究提示,黄芪防风可抑制过敏性哮喘气道重塑。同样,防风的主要成分升麻素(图1)在过敏性炎症中发挥抑制作用[8-9]。然而,升麻素在过敏性哮喘中的作用机制还未可知。
图1 升麻素的分子结构Fig.1 Molecular structure of cimifugin
核因子-kappaB (nuclear factor-kappaB,NF-κB)是应对损伤或感染免疫和炎症过程的主要调节因子[10]。有研究表明,NF-κB通路在哮喘发病机制中发挥重要作用[11-12]。然而,关于升麻素与NF-κB信号通路在哮喘发病机制中的关系探究却鲜有报道。鉴于此,本研究重点探讨升麻素对过敏性哮喘体外模型的具体影响并对其机制进行探讨。
1 材料与方法
1.1 材料
1.1.1 主要仪器与试剂 人支气管上皮细胞系BEAS-2B由美国菌种保藏中心提供;DMEM培养基(11965092)、胎牛血清(FBS;10099141C)购自美国Gibco公司;屋尘螨(house dust mite,HDM;XPB82D3A2.5)购自北京博蕾德生物科技有限公司;升麻素(B21156)和地塞米松(dexamethasone,Dex;B25793)购自上海源叶生物科技有限公司;MTT试剂(C0009S)购自碧云天生物技术有限公司;TUNEL试剂(KGA-701)购自南京凯基生物科技发展有限公司;BCA试剂盒(PC0020)、RIPA裂解液(R0010)购自北京索莱宝科技有限公司;兔源Bcl-2(B cell lymphoma-2;ab32124)、Bax(Bcl-2-associated X;ab32503)、cleaved caspase-3(ab32042)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS;ab178945)、环氧化酶-2(cyclooxygenase-2,COX-2;ab179800)、闭锁小带蛋白(zonula occludens-1,ZO-1;ab276131)、闭合蛋白(Occludin;ab216327)、紧密连接蛋白-4(Claudin-4;ab210796)、核因子κB抑制蛋白α(IκBα;ab32518)、NF-κB p65(ab207297)、磷酸化NF-κB p65(p-NF-κB p65;ab239882)、GAPDH抗体(ab9485)、山羊抗兔IgG-FITC(ab6717)、Alexa Fluor®594偶联的二抗(ab150080)、IL-6(ab178013)、IL-1β(ab214025)和TNF-α试剂盒(ab181421)均购自美国Abcam;化学发光超敏显色试剂盒(36208ES 60)购自翌圣生物科技(上海)股份有限公司;Transwell小室购自美国BD公司、FITC标记葡聚糖4 kDa(MS0901-0050MG;上海懋康生物科技有限公司);分光光度计(上海美谷分子仪器有限公司);伏特欧姆计(美国默克公司);Varioskan荧光酶标仪(赛默飞世尔科技有限公司)。
1.1.2 实验细胞株 人支气管上皮细胞系BEAS-2B常规培养于含10%FBS的DMEM培养基中,并置于37 ℃、5%CO2环境下进行孵育。
1.2 方法
1.2.1 实验分组 分别用浓度为0.01、0.1、1、10 μmol/L的升麻素处理长满单层的BEAS-2B细胞24 h,并设不加升麻素的空白对照组(Control)以及升麻素0.01、0.1、1和10 μmol/L组检测升麻素对BEAS-2B细胞的最大无毒浓度。依据文献对细胞分别进行不同浓度升麻素(0.01、0.1、1 μmol/L)或1 μmol/L Dex处理[13-14]。利用HDM建立过敏性哮喘体外模型[15]。将细胞暴露于300 ng/ml HDM中培养24 h。细胞分为空白对照组(Control)、HDM组、HDM+0.01 μmol/L组、HDM+0.1 μmol/L组、HDM+1 μmol/L组、HDM+Dex组,检测药物对暴露在HDM环境中BEAS-2B细胞活力的影响。实验独立重复3次。
1.2.2 MTT法检测细胞活性 将BEAS-2B细胞接种于96孔板中进行培养(2×103个/孔)。经升麻素或Dex处理后,将细胞暴露于HDM下,每孔加入10 μl 5%MTT试剂,37 ℃下孵育4 h。分光光度计检测570 nm处吸光度值,每组设6个复孔。
1.2.3 TUNEL染色检测细胞凋亡 经升麻素或1 μmol/L Dex处理后,将暴露于HDM的BEAS-2B细胞接种于6孔板,利用4%多聚甲醛和0.5% Triton X-100分别对细胞进行固定和透化处理,添加TUNEL检测液,严格按试剂盒说明书实验步骤37 ℃避光反应45 min,采用DAPI对细胞核进行染色。荧光显微镜下随机选取5个视野观察细胞凋亡情况。凋亡率(%)=凋亡细胞数/细胞总数×100%。
1.2.4 Western blot 采用BCA试剂盒检测RIPA裂解液提取的蛋白浓度。10%SDS-PAGE电泳分离等量蛋白质,随后转移至PVDF膜,并在5%脱脂牛奶中室温封闭,加入一抗4 ℃孵育过夜后,洗膜后再用HPR标记的羊抗兔二抗于室温下孵育。加入化学发光超敏显色试剂盒对蛋白条带进行显影,利用Image J软件(美国国立卫生研究院)记录灰度值,分析Bcl-2、Bax、Cleaved caspase-3/pro-caspase 3、ZO-1、Occludin、Claudin-4及iNOS、COX-2蛋白浓度。
1.2.5 ELISA检测炎症因子水平 向BEAS-2B细胞中加入细胞裂解液,充分裂解细胞,3 500 r/min离心5 min,取上清液,按照ELISA剂盒说明书检测上清液中BEAS-2B细胞IL-6、IL-1β和TNF-α水平。
1.2.6 TEER检测上皮完整性 依据文献[14]以3×105个/孔将细胞接种于Transwell室,并在DMEM培养基中培养。细胞在聚碳酯膜上生长、分化,形成连续的单细胞层。培养细胞4~6 d至完全融合后,使用伏特欧姆计测量TEER值,确定细胞单层的紧密与完整性。当测定的TEER值达到稳定后3 d或4 d,按照1.2.1实验分组处理细胞,24 h后,测量TEER值。
1.2.7 FD-4评估细胞单层膜的渗透性 依据文献[14]将细胞以3×105个/孔接种于Transwell室内,形成单层膜细胞后,将10 μl FD-4(10 mg/ml)添加到上室,避光孵育2 h后,使用Varioskan荧光酶标仪检测Transwell底层小室荧光强度(激发波长为490 nm,发射波长为520 nm)。
1.2.8 免疫荧光检测NF-κB核易位 利用4%多聚甲醛和0.5% Triton X-100分别对处理后的BEAS-2B细胞进行固定和透化处理。经5%牛血清白蛋白封闭后,25 ℃下与兔源NF-κB抗体孵育过夜,并与Alexa Fluor®594偶联的二抗室温孵育1 h。PBST洗涤后,DAPI于25 ℃下对细胞进行复染,并通过荧光显微镜观察。
1.3 统计学分析 本研究采用GraphPad Prism 5.0软件进行统计分析处理,实验结果表示为±s,组间比较采用独立样本t检验,多组间比较采用单因素方差分析。P<0.05表示差异具有统计学意义。
2 结果
2.1 升麻素增强HDM诱导的BEAS-2B细胞活力与对照组相比,0.01、0.1、1 μmol/L升麻素对细胞活性无显著影响;升麻素处理浓度为10 μmol/L时,细胞活性显著下降(P<0.05,图2A)。由此,选择0.01、0.1、1 μmol/L无毒浓度升麻素进行后续实验。为验证升麻素对过敏性哮喘的影响,BEAS-2B细胞经HDM诱导后,成功建立过敏性哮喘体外模型。与对照组相比,HDM暴露显著降低细胞活力(P<0.001);与HDM组比较,HDM+0.01 μmol/L组、HDM+0.1 μmol/L组、HDM+1 μmol/L组、HDM+Dex组细胞活力显著提高,且呈浓度依赖性(P<0.05,P<0.01或P<0.001,图2B)。
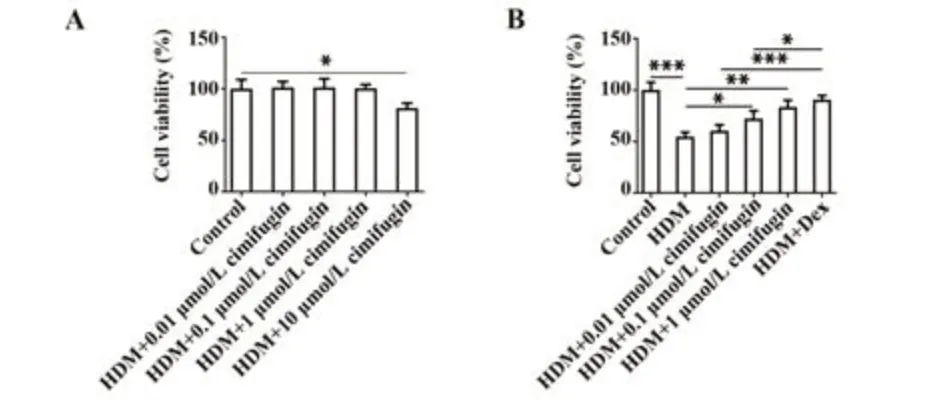
图2 不同浓度升麻素对BEAS-2B细胞活力的影响Fig.2 Effects of different concentrations of cimifugin on viability of BEAS-2B cells
2.2 升麻素抑制HDM诱导的BEAS-2B细胞凋亡与对照组相比,HDM暴露导致细胞凋亡率显著升高;与HDM组比较,HDM+0.01 μmol/L组、HDM+0.1 μmol/L组、HDM+1 μmol/L组、HDM+Dex组凋亡细胞数目显著减少,且呈浓度依赖性(P<0.001,图3A)。此外,与对照组相比,HDM组抗凋亡Bcl-2表达下调,促凋亡Bax、Cleaved-caspase 3/pro-caspase 3表达上调(P<0.001);HDM+0.01 μmol/L组、HDM+0.1 μmol/L组、HDM+1 μmol/L组、HDM+Dex组较HDM组Bcl-2表达呈浓度依赖性增加,Bax、Cleaved-caspase 3/pro-caspase 3表达呈浓度依赖性下降(P<0.05,P<0.01或P<0.001,图3B)。
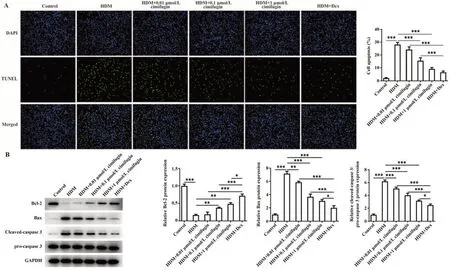
图3 升麻素降低HDM诱导的BEAS-2B细胞凋亡Fig.3 Cimifugin reduced HDM-induced apoptosis of BEAS-2B cells
2.3 升麻素抑制HDM诱导的BEAS-2B细胞分泌炎症因子 与对照组相比,暴露于HDM的BEAS-2B细胞炎症因子IL-6、IL-1β、TNF-α水平均显著提高(P<0.001);与HDM组比较,HDM+0.01 μmol/L组、HDM+0.1 μmol/L组、HDM+1 μmol/L组、HDM+Dex组IL-6、IL-1β、TNF-α水平均呈浓度依赖性下降(P<0.05,P<0.01或P<0.001,图4A)。与对照组相比,HDM组iNOS、COX-2蛋白水平明显升高(P<0.001);HDM+0.01 μmol/L组、HDM+0.1 μmol/L组、HDM+1 μmol/L组、HDM+Dex组较HDM组iNOS、COX-2蛋白水平显著降低,且显示出量效关系(P<0.01或P<0.001,图4B)。
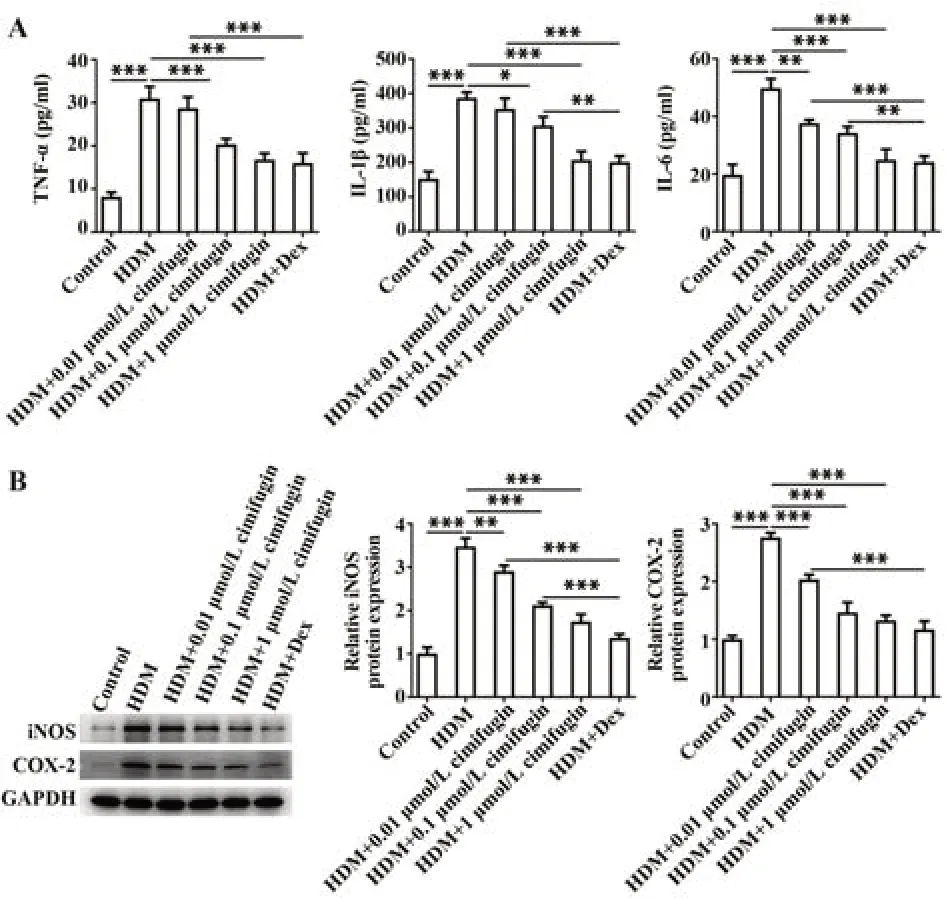
图4 升麻素抑制HDM诱导的BEAS-2B细胞炎症反应Fig.4 Cimifugin suppressed HDM-induced inflammatory response in BEAS-2B cells
2.4 升麻素对HDM诱导的BEAS-2B细胞屏障保护作用 与对照组比较,HDM刺激导致BEAS-2B细胞TEER值显著降低,FD-40通量升高(P<0.001),提示HDM诱导单层BEAS-2B细胞通透性增加,细胞屏障功能受损;与HDM组比较,HDM+0.01 μmol/L组、HDM+0.1 μmol/L组、HDM+1 μmol/L组、HDM+Dex组TEER值浓度依赖性升高,FD-40通量浓度依赖性减少(P<0.001,图5A、B)。与对照组比较,HDM组中紧密连接蛋白ZO-1、Occludin、Claudin-4表达显著降低(P<0.001);经不同浓度(0.01、0.1、1 μmol/L)升麻素或1 μmol/L Dex处理后,ZO-1、Occludin、Claudin-4蛋白表达呈浓度依赖性升高(P<0.05,P<0.01或P<0.001,图5C、D)。

图5 升麻素对HDM诱导的BEAS-2B细胞的屏障保护作用Fig.5 Protective role of cimifugin in epithelial barrier of HDM-induced BEAS-2B cells
2.5 升麻素抑制HDM诱导的BEAS-2B细胞中NFκB及相关蛋白活化 免疫荧光结果显示,与对照组相比,HDM暴露下NF-κB在细胞核内含量明显增加;与HDM组相比,HDM+0.01 μmol/L组、HDM+0.1 μmol/L组、HDM+1 μmol/L组、HDM+Dex组NF-κB进入细胞核内的含量显著减少,并显示出明显的量效作用(图6A)。同样,升麻素或Dex处理能增加IκBα蛋白表达,下调p-NF-κB p65蛋白表达(P<0.05,P<0.01或P<0.001,图6B)。
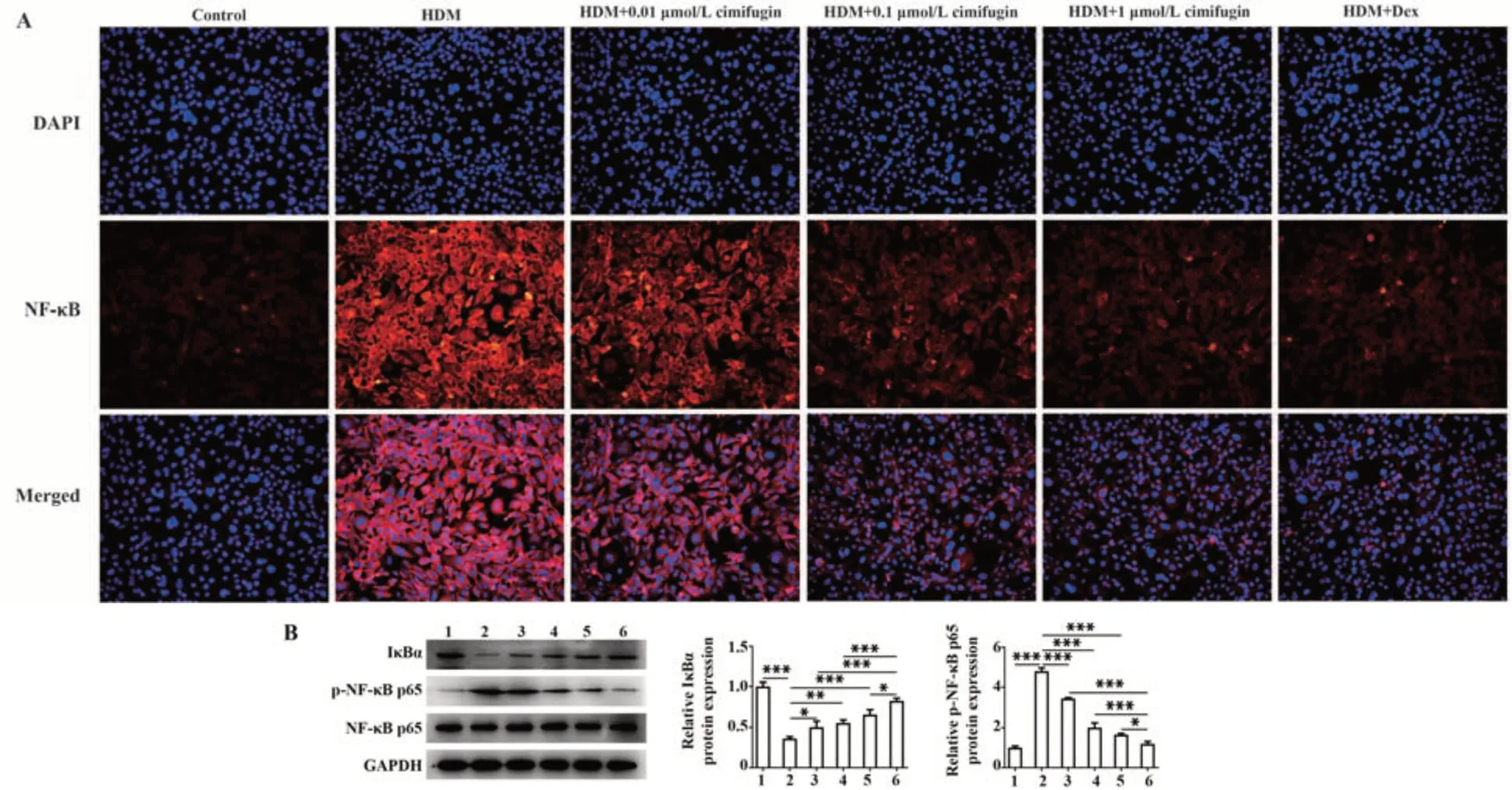
图6 升麻素抑制HDM诱导的BEAS-2B细胞中NF-κB及相关蛋白活化Fig.6 Cimifugin inhibits HDM-induced activation of NF-κB and related proteins in BEAS-2B cells
3 讨论
哮喘是一种常见的呼吸系统疾病,严重威胁患者健康[16-17]。大量研究表明,哮喘发作期间会引发炎症反应,释放促炎细胞因子,如IL-1β、IL-6、IL-8、TNF-α等[18]。此外,细胞凋亡也参与哮喘的发生与发展,抑制细胞凋亡可有效改善哮喘[19]。气道上皮是抵御外来物质,如吸入性过敏原、空气传播颗粒的一线宿主屏障,与哮喘发病机制密切相关[20]。气道上皮屏障的破坏可能导致过敏原致敏风险增加,从而引发过敏性哮喘的慢性炎症[21]。HDM是一种普遍存在的气源性过敏原,是哮喘患者过敏原的主要来源[22]。HDM暴露和气道上皮细胞的相互作用可直接导致气道上皮功能障碍[23]。因此,本研究利用HDM对人支气管上皮细胞BEAS-2B进行诱导,构建过敏性哮喘体外模型。
升麻素是中药防风中色原酮的主要活性成分,现代药理学研究证明其具有抗肿瘤、抗炎等作用[24]。研究报道,升麻素可通过恢复上皮屏障紧密连接从而改善过敏性炎症进展[8-9]。本研究利用不同浓度升麻素处理BEAS-2B细胞,发现中低浓度(0.01、0.1、1 μmol/L)升麻素对BEAS-2B细胞活性无显著影响,而高浓度(10 μmol/L)升麻素可显著降低细胞活性。进一步研究发现,暴露于HDM的BEAS-2B细胞活性显著下降,凋亡细胞数目增加,抑癌基因Bcl-2蛋白表达下调,促进原癌基因Bax、Cleaved caspase-3/pro-caspase 3蛋白表达上调;不同浓度升麻素可提高HDM诱导的BEAS-2B细胞活性,减少细胞凋亡,促进Bcl-2蛋白表达,抑制Bax、cleaved caspase-3/pro-caspase 3蛋白表达。HDM刺激可导致实验细胞炎症因子IL-1β、IL-6、TNF-α水平增加,并促进炎症因子iNOS、COX-2蛋白表达,这与CAI等[25]的研究结果一致;升麻素处理可降低IL-1β、IL-6、TNF-α水平并减少iNOS、COX-2蛋白表达。研究报道HDM可直接破坏气道上皮细胞之间的紧密连接以及屏障结构[26]。本研究同样检测上皮完整性、细胞单层膜渗透性及紧密连接蛋白表达,结果发现HDM暴露可导致细胞TEER值显著下降,FD-40通量升高,同时紧密连接蛋白ZO-1、Occludin、Claudin-4表达下调,提示HDM能诱导单层BEAS-2B细胞通透性增加,屏障功能紊乱,并破坏上皮细胞间的紧密连接;经升麻素处理后,TEER值上升,FD-40通量减少,ZO-1、Occludin、Claudin-4蛋白表达增加,且呈浓度依赖性,与文献报道结果一致[8-9]。
NF-κB信号传导通过协调炎症反应参与哮喘的发生发展[27-28]。此外,升麻素可通过抑制NF-κB信号传导,从而抑制疾病中的炎症反应[13,29-30]。本研究结果同样发现,HDM暴露能诱导BEAS-2B细胞NFκB发生核易位,IκBα蛋白表达减少,p-NF-κB p65蛋白表达增加;升麻素处理后能明显抑制细胞NFκB核易位,并浓度依赖性地降低p-NF-κB p65蛋白表达,促进IκBα蛋白表达。
综上所述,升麻素可减轻HDM诱导的人支气管上皮细胞过敏性炎症损伤并保护细胞屏障,其机制可能与抑制NF-κB信号通路有关。
