FOXM1通过调节KIF20A介导巨噬细胞M2极化对食管鳞状细胞癌细胞的作用
2024-04-08王玉萍刘约瑟张玉珂李登科王玲玲
王玉萍 刘约瑟 张玉珂 李登科 王玲玲
(河南省中医院(河南中医药大学第二附属医院)肿瘤内科一区,河南 郑州 450000)
食管癌是全球第六大常见的癌症相关死亡原因。由于缺乏针对性的早期诊断和治疗方法,食管癌患者5年存活率仍然很低(9.0%~27.1%)〔1〕。全球约50%的食管癌病例发生在中国,绝大多数病例(>90%)的组织病理学形式为食管鳞状细胞癌(ESCC)〔2〕。巨噬细胞是参与宿主免疫系统最丰富的肿瘤基质细胞。巨噬细胞极化受到来自肿瘤细胞各种微环境信号的调节。肿瘤细胞也会分泌大量细胞因子来诱导肿瘤相关巨噬细胞(TAM)的极化〔3〕。研究显示,高水平M2巨噬细胞浸润与ESCC患者预后不良有关,靶向抑制巨噬细胞M2极化在治疗ESCC方面具有重要意义〔4〕。FOXM1是Forkhead box(Fox)转录因子家族成员之一,在ESCC患者癌组织标本中表达升高,是ESCC治疗的一个很有前途的治疗靶点〔5〕。另有证据显示,Kinesin家族成员20A(KIF20A)在ESCC患者癌组织标本中表达升高,且其高表达与患者总生存率和免疫浸润密切相关〔6〕。此外,FOXM1可通过靶向调控KIF20A的表达促进卵巢癌细胞增殖和侵袭能力〔7〕。然而,关于FOXM1和KIF20A 在ESCC中的具体作用机制及其对ESCC相关TAM的影响尚不明确。本研究旨在探究FOXM1是否通过KIF20A调控 TAM向M2表型转化,从而在ESCC细胞中发挥作用,以期明确ESCC发生发展分子机制。
1 材料与方法
1.1主要材料 正常食管上皮细胞(Het-1A)和人食管鳞状细胞癌细胞(KYSE70)购自美国ATCC;人急性单核细胞白血病细胞(THP-1)购自武汉普诺赛生命科技有限公司;siRNA对照(si-NC)、FOXM1特异性siRNA(si-FOXM1)、KIF20A过表达载体(oe-KIF20A)、过表达载体对照(oe-NC)、KIF20A的3′-UTR端的野生型(KIF20A-WT)和突变型(KIF20A-MUT)的合成与构建均由云舟生物科技(广州)有限公司完成;转染试剂LipofectamineTM2000购自美国赛默飞公司;荧光素酶报告基因检测试剂盒和EdU检测试剂盒购自上海碧云天生物技术有限公司;ChIP 试剂盒购自美国CST;2xSYBR Green qPCR MasterMix购自美国Bimake;FOXM1、KIF20A、Arg-1和白细胞介素(IL)-10抗体均购自英国Abcam公司;E-钙黏蛋白(cadherin)、N-cadherin和GAPDH抗体购自美国GeneTex;佛波醇12-十四酸酯13-乙酸酯(PMA)购自美国Sigma;CCK-8试剂盒购自武汉博士德生物工程有限公司。
1.2细胞培养及转染分组 在37 ℃、5% CO2环境下,Het-1A细胞、KYSE70细胞和THP-1细胞用含10% 胎牛血清的RPMI1640培养基培养。将KYSE70细胞接种于6孔板,控制细胞密度为每孔1×106个,分为空白对照组(不进行转染)、si-NC组(转染si-NC)、si-FOXM1组(转染si-FOXM1)、si-NC+oe-NC组(转染si-NC和oe-NC)、si-FOXM1+oe-NC组(转染si-FOXM1和oe-NC)、si-NC+oe-KIF20A组(转染si-NC和oe-KIF20A)、si-FOXM1+oe-KIF20A组(转染si-FOXM1和oe-KIF20A),转染操作依据LipofectamineTM2000说明书步骤。
1.3FOXM1对KIF20A的靶向调控检测 采用生物信息学网站JASPAR和Consite预测FOXM1和KIF20A结合位点。构建荧光素酶报告质粒:KIF20A野生型(KIF20A-WT)和突变型(KIF20A-MUT)。分别将KIF20A-WT+si-NC、KIF20A-MUT+si-NC、KIF20A-WT+si-FOXM1和KIF20A-MUT+si-FOXM1转染至KYSE70细胞中。依据荧光素酶报告基因检测试剂盒说明书步骤,进行检测荧光素酶活性检测。
1.4染色质免疫沉淀(ChIP)-PCR实验检测FOXM1对KIF20A 转录的调控作用 甲醛固定KYSE70细胞,依次进行裂解、超声破碎,得到300~800 bp 的DNA片段。依据ChIP 试剂盒说明书进行后续实验操作,分为FOXM1组、Input组和阴性对照IgG组,分别与ProteinA磁珠孵育后,加入FOXM1、Histone H3和IgG一抗。沉淀经洗涤后,依次进行解交联、蛋白酶消化。收集DNA片段作为实时荧光定量(qRT)-PCR实验中的模板,以检测KIF20A的转录富集。KIF20A上游引物:5′-TTCCTTACGCGGATTGGTAG-3′,下游:5′-AGCCGCAGAGCACAA CTC-3′,内参上游引物:5′-CCGCCTCCCTCTTAGC ATAA-3′,下游:5′-CAGGAAATTGCATCTCGGGG-3′。
1.5qRT-PCR检测FOXM1和KIF20A mRNA表达 采用Trizol法、反转录法获得各组细胞cDNA。使用2×SYBR Green qPCR MasterMix试剂盒进行mRNA表达水平检测:95 ℃、5 min预变性后,95 ℃、15 s,60 ℃、30 s,72 ℃、10 s,共40个循环。采用2-ΔΔCt法计算FOXM1和KIF20A mRNA表达。FOXM1正向引物:5′-TCCTCCACCCCGAGCAA-3′,反向:5′-CGTGAGCCTCCAGGATTCAG-3′;KIF20A正向引物:5′-TGCTGTCCGATGACGATGTC-3′;反向:5′-AGGTTCTTGCGTACCACAGAC-3′;GAPDH正向引物:5′-CTCCTCCACCTTTGACGCTG-3′,反向:5′-TCCTCTTGTGCTCTTGCTGG-3′。
1.6Western印迹检测FOXM1、KIF20A、Arg-1、IL-10、E-cadherin和N-cadherin 蛋白表达 收集Het-1A和KYSE70细胞,裂解并收集细胞上清。在十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)中加入25 μg蛋白样品,随后电转至膜上。封闭非特异性位点后,加入一抗4 ℃孵育过夜:FOXM1抗体(1∶1 000)、KIF20A抗体(1∶2 000)、Arg-1抗体(1∶1 000)、IL-10抗体(1∶1 000)、E-cadherin抗体(1∶2 000)、N-cadherin抗体(1∶2 000)和GAPDH抗体(1∶2 000)。隔天加入特异性二抗(1∶5 000),随后加入发光液,在凝胶曝光仪下检测蛋白条带。通过ImageJ软件分析条带灰度值。
1.7巨噬细胞与KYSE70细胞共培养 将THP-1细胞铺至6孔板中,待细胞贴壁后,加入100 nmol/L〔8〕PMA继续培养48 h,诱导产生M0巨噬细胞。将M0巨噬细胞置于Transwell小室下室,上室接种KYSE70细胞,细胞继续培养24 h后,收集TAM细胞来源培养液(分别命名为TAM、 si-NC+oe-NC+TAM、 si-FOXM1+oe-NC+TAM、 si-NC+oe-KIF20A+TAM和 si-FOXM1+oe-KIF20A+TAM)和TAM细胞,进行后续实验操作。
1.8流式细胞术检测TAM细胞中CD68+/CD206+细胞率 收集TAM细胞,磷酸盐缓冲液(PBS)清洗并重悬细胞。在100 μl(1×107个)细胞悬液中加入CD68抗体、CD206抗体,室温条件下避光孵育40 min。通过流式细胞仪进行检测。
1.9TAM细胞来源上清液处理KYSE70细胞 收集KYSE70细胞铺至6孔板中(1×106个/孔),将细胞分为空白对照组、TAM组、si-NC+oe-NC+TAM组、si-FOXM1+oe-NC+TAM组、si-NC+oe-KIF20A+TAM组、si-FOXM1+oe-KIF20A+TAM组,按照分组,向KYSE70细胞中分别加入TAM细胞来源上清液,共孵育48 h。
1.10CCK-8检测细胞活力 收集KYSE70细胞铺至96孔板(1×104个/孔),组别同1.9。细胞培养48 h后加入1/10体积CCK-8溶液,继续培养2 h。通过酶标仪检测各孔450 nmol/L处的光密度(OD)值。细胞活力(%)=(实验组OD值-空白组OD值)/(空白对照组OD值-空白组OD值)×100%。
1.115-乙炔基-2′脱氧尿嘧啶核苷(EdU)检测细胞增殖能力 收集KYSE70细胞铺至96孔板(4×103个/孔)。细胞继续培养24 h。向每孔细胞中加入5 μmol EdU溶液,培养2 h后,弃去培养基上清,加入4%多聚甲醛固定细胞。使用 TritonX-100裂解细胞10 min,随后加入Alexa Fluor 647标记的Azide探针工作液,避光共孵育30 min;甲醇和PBS清洗细胞后,加入DAPI染液共孵育15 min,最后在荧光倒置显微镜下拍照记录。
1.12Transwell实验检测KYSE70细胞迁移和侵袭 无血清培养基重悬KYSE70细胞,取细胞悬液铺至Transwell上室(5×104个/室);吸取600 μl完全培养基加至Transwell下室。细胞培养24 h后,使用4%多聚甲醛固定小室中细胞,随后加入结晶紫染色液染色15 min,迁移结果在显微镜下观察。侵袭实验中所用Transwell小室提前用浓度为20%基质胶包被,其余实验步骤与迁移实验相同。
1.13统计学分析 采用SPSS21.0软件进行单因素方差分析、LSD-t检验。
2 结 果
2.1Het-1A和KYSE70细胞中FOXM1和KIF20A表达 与Het-1A组相比,KYSE70组细胞中FOXM1和KIF20A mRNA表达、FOXM1和KIF20A 蛋白表达均明显升高(P<0.001),见图1、表1。

图1 Western印迹检测Het-1A和KYSE70细胞中FOXM1和KIF20A蛋白表达

表1 Het-1A和KYSE70细胞中FOXM1和KIF20A mRNA和蛋白表达
2.2FOXM1介导KIF20A表达 与空白对照组相比,si-NC组KYSE70细胞中FOXM1和KIF20A表达无显著差异(P>0.05);与si-NC组比较,si-FOXM1组FOXM1和KIF20A表达均明显降低,KIF20A-WT荧光素酶活性明显降低,KIF20A启动子区域mRNA扩增明显降低(P<0.05,P<0.001),见图2、表2、表3。

图2 Western印迹检测KYSE70细胞中FOXM1和KIF20A 蛋白表达

表2 空白对照组、si-NC组、si-FOXM1组细胞中FOXM1和KIF20A mRNA和蛋白表达

表3 FOXM1介导KIF20A的表达
2.3KYSE70细胞FOXM1/KIF20A轴对M2型巨噬细胞产生的影响 与空白对照组相比,si-NC+oe-NC组KYSE70细胞中FOXM1和KIF20A 蛋白表达无显著差异(P>0.05);与si-NC+oe-NC组比较,si-FOXM1+oe-NC组明显降低(P<0.05),si-NC+oe-KIF20A组细胞中KIF20A 蛋白表达明显升高(P<0.05),而FOXM1蛋白表达无显著差异(P>0.05);与si-FOXM1+oe-NC组比较,si-FOXM1+oe-KIF20A组KYSE70细胞中KIF20A 蛋白表达明显升高(P<0.05),而FOXM1蛋白表达差异无统计学意义(P>0.05),见图3、表4。
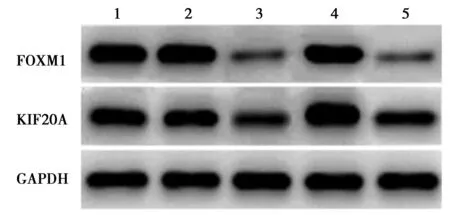
1~5:空白对照组、si-NC+oe-NC组、si-FOXM1+oe-NC组、si-NC+oe-KIF20A组、si-FOXM1+oe-KIF20A组;同5图

表4 各组细胞中FOXM1和KIF20A 蛋白表达
与空白对照组比较,si-NC+oe-NC组TAM细胞中CD68+/CD206+细胞率、Arg-1和IL-10蛋白表达差异无统计学意义(P>0.05);与si-NC+oe-NC组比较,si-FOXM1+oe-NC组均明显降低(P<0.05),si-NC+oe-KIF20A组均明显升高(P<0.05);与si-FOXM1+oe-NC组相比,si-FOXM1+oe-KIF20A组均明显升高(P<0.05),见表4、图4、图5。

A:KYSE70细胞与M0巨噬细胞共培养;B:流式细胞术检测TAM细胞中CD68+/CD206+细胞

图5 Western印迹检测TAM细胞中Arg-1和IL-10蛋白表达
2.4FOXM1/KIF20A轴通过M2巨噬细胞对KYSE70细胞增殖的影响 与空白对照组相比,TAM组KYSE70细胞活力和EdU阳性细胞数明显升高(P<0.05);TAM组和si-NC+oe-NC+TAM组差异无统计学意义(P>0.05);与si-NC+oe-NC+TAM组相比,si-FOXM1+oe-NC+TAM组均明显降低(P<0.05),而si-NC+oe-KIF20A+TAM组均明显升高(P<0.05);与si-FOXM1+oe-NC+TAM组相比,si-FOXM1+oe-KIF20A+TAM组均明显升高(P<0.05),见图6、表5。

图6 EdU实验检测KYSE70细胞增殖(×200)
表5 FOXM1/KIF20A轴通过M2巨噬细胞对KYSE70细胞增殖的影响
2.5FOXM1/KIF20A轴通过M2巨噬细胞对KYSE70细胞迁移和侵袭的影响 与空白对照组相比,TAM组KYSE70细胞迁移和侵袭数明显升高(P<0.05);TAM组和si-NC+oe-NC+TAM组比较差异无统计学意义(P>0.05);与si-NC+oe-NC+TAM组相比,si-FOXM1+oe-NC+TAM组KYSE70均明显降低(P<0.05),而si-NC+oe-KIF20A+TAM组明显升高(P<0.05);与si-FOXM1+oe-NC+TAM组相比,si-FOXM1+oe-KIF20A+TAM组明显升高(P<0.05),见表6、图7。

图7 FOXM1/KIF20A轴通过M2巨噬细胞对KYSE70细胞迁移和侵袭的影响(结晶紫染色,×200)

表6 FOXM1/KIF20A轴通过M2巨噬细胞对KYSE70细胞增殖的影响
2.6FOXM1/KIF20A轴通过M2巨噬细胞对KYSE70细胞EMT的影响 与空白对照组比较,TAM组KYSE70细胞N-cadherin蛋白表达显著升高,而E-cadherin蛋白表达显著降低(P<0.05);TAM组和si-NC+oe-NC+TAM组比较无显著差异(P>0.05);与si-NC+oe-NC+TAM组比较,si-FOXM1+oe-NC+TAM组N-cadherin蛋白表达显著降低,E-cadherin蛋白表达明显升高(P<0.05),而si-NC+oe-KIF20A+TAM组KYSE70细胞N-cadherin蛋白表达显著升高,E-cadherin蛋白显著表达降低(P<0.05);与si-FOXM1+oe-NC+TAM组相比,si-FOXM1+oe-KIF20A+TAM组KYSE70细胞N-cadherin蛋白表达显著升高,E-cadherin蛋白表达显著降低(P<0.05),见图8、表7。

1~6:空白对照组、TAM组、si-NC+oe-NC+TAM组、si-FOXM1+oe-NC+TAM组、si-NC+oe-KIF20A+TAM组、si-FOXM1+oe-KIF20A+TAM组

表7 FOXM1/KIF20A轴通过M2巨噬细胞对KYSE70细胞EMT的影响
3 讨 论
肿瘤微环境是一个高度异质的生态系统,由多种细胞成分组成,包括浸润的淋巴细胞、成纤维细胞和内皮细胞。在这些不同的细胞类型中,浸润性TAM引起了人们的极大关注,因为其是许多癌症类型中的一个不良预后因素〔9〕。TAM可诱导肿瘤微环境中的血管生成,抑制抗肿瘤免疫,直接刺激肿瘤细胞增殖。TAM还参与癌症干细胞生态位和转移前生态位的形成,以促进肿瘤进展〔10〕。然而,关于TAM与ESCC的关系还需要进一步探究。
巨噬细胞有两种不同的表型:促炎的M1和抗炎的M2。M1巨噬细胞是由干扰素-γ诱导,而M2巨噬细胞是由IL-4和IL-13诱导〔11〕。据报道,TAM具有与M2巨噬细胞相似的功能和表型特征。如TAM和M2巨噬细胞在IL-10或Arg1激活后均可发挥免疫抑制作用和促进血管生成〔12〕。已有证据显示,靶向抑制巨噬细胞M0-M2极化和M2巨噬细胞在肿瘤微环境的募集,对开发新的预后和治疗靶点以优化目前的ESCC治疗具有重要意义〔13〕。FOXM1是癌症中的一个重要致癌因子。FOXM1通过直接促进其靶基因的表达或与其他因子相互作用,参与多种癌细胞过程,如细胞周期、衰老、凋亡、迁移、侵袭、氧化应激和耐药性〔14〕。FOXM1在ESCC中发挥促肿瘤作用,FOXM1的高表达水平与ECSS患者低生存率和预后不良呈正相关,FOXM1 过表达可促进ESCC细胞的侵袭和迁移,而敲低FOXM1 则产生相反作用〔15〕。Chen等〔16〕研究也证明,FOXM1参与了ESCC细胞关键生物过程的调控。激活FOXM1信号通路可促进ESCC细胞成瘤、迁移、侵袭和转移。此外,Li等〔17〕研究表明,FOXM1还与肿瘤免疫抑制有关。FOXM1过度表达与浸润深度和预后相关。FOXM1可能通过募集FoxP3+Tregs诱导免疫抑制,从而导致肿瘤的发生、侵袭和转移〔15〕。FOXM1在TAM募集中具有重要作用。巨噬细胞中FOXM1的表达是肺部炎症、巨噬细胞进入肿瘤部位和肺部肿瘤生长所必需的〔18〕。本研究结果显示,KYSE70细胞中FOXM1表达上调。敲低KYSE70细胞中FOXM1后,可抑制M0巨噬细胞向M2巨噬细胞分化,抑制巨噬细胞中IL-10和Arg1蛋白表达。KYSE70细胞和M0巨噬细胞共培养上清液si-FOXM1+oe-NC+TAM处理KYSE70细胞,可导致KYSE70细胞活力、增殖、迁移、侵袭和EMT受到抑制,本研究结果表明KYSE70细胞中FOXM1通过诱导M0巨噬细胞向M2巨噬细胞分化发挥促肿瘤作用。
KIF20A位于染色体5q31.2上,主要聚集在有丝分裂细胞纺锤体的中心区,参与细胞有丝分裂过程〔19〕。研究发现,KIF20A参与多种肿瘤的发生发展过程,如KIF20A在大肠癌组织中表达上调。KIF20A在促进大肠癌细胞增殖和提高化疗耐药性方面起至关重要的作用〔20〕;KIF20A的高表达与前列腺癌不良预后有关,靶向KIF20A可以抑制前列腺癌细胞的增殖、迁移和侵袭,表明KIF20A可能是前列腺癌患者潜在的预后和治疗靶点〔21〕;KIF20A还与肿瘤免疫浸润密切相关。KIF20A与巨噬细胞浸润呈强正相关〔22〕。研究显示,KIF20A在食管癌组织中表达上调,KIF20A的高表达是食管癌患者的不良预后因素〔23〕。KIF20A还与ESCC免疫浸润密切相关〔6〕。本研究结果显示,KYSE70细胞中FOXM1可介导KIF20A的转录调控。KYSE70细胞中KIF20A表达上调,过表达KYSE70细胞中KIF20A后,可促进M0巨噬细胞向M2巨噬细胞分化,促进巨噬细胞中IL-10和Arg1蛋白表达。KYSE70细胞和M0巨噬细胞共培养上清液si-NC+oe-KIF20A+TAM处理KYSE70细胞,可促进KYSE70细胞活力、增殖、迁移、侵袭和EMT。此外,过表达KIF20A可部分逆转si-FOXM1+oe-NC+TAM对KYSE70细胞的作用。本研究结果表明,KYSE70细胞中FOXM1/ KIF20A轴通过诱导M0巨噬细胞向M2巨噬细胞分化发挥促肿瘤作用。
综上,ESCC细胞中FOXM1通过上调KIF20A的表达诱导M0巨噬细胞向M2巨噬细胞分化,从而促进ESCC细胞增殖、迁移、侵袭和EMT。本研究结果为明确ESCC相关分子机制及开发新的ESCC治疗靶点提供新的科学资料。
