氮处理对高粱氮代谢相关基因NR、GS、GOGAT表达的影响
2024-04-08徐洪超王增雪逄洪波王兰兰李雪梅马莲菊张飞李玥莹
徐洪超 王增雪 逄洪波 王兰兰 李雪梅 马莲菊 张飞 李玥莹

摘要:为了探究不同氮处理对高粱氮代谢相关酶基因表达的影响,提高高粱氮素利用率,选择最佳施氮模式,选用2个高粱品种辽粘3号、晋杂34,设置4个氮处理水平(N0:0 kg/hm2,N1:60 kg/hm2,N2:120 kg/hm2,N3:180 kg/hm2),用荧光定量PCR方法分别测定苗期、拔节期、抽穗期、成熟期高粱叶片、籽粒的NR、GS、GOGAT基因相对表达量,分析不同氮处理水平对氮代谢相关酶基因表达的影响。结果表明:除成熟期叶片外,各生育期辽粘3号、晋杂34叶片、籽粒在施氮条件下的NR、GS、GOGAT基因相对表达量均高于未施氮处理。随施氮量增加,高粱叶片和籽粒NR、GS、GOGAT基因相对表达量呈上调或先上调后下调的变化趋势。辽粘3号和晋杂34在N2、N3处理的NR、GS、GOGAT基因相对表达量处于较高水平。综合多方面因素考虑,可以将N2处理确定为最适施氮量。
关键词:氮处理;基因表达;高粱;氮代谢;基因相对表达量
中图分类号:S514.06 文献标志码:A
文章编号:1002-1302(2024)03-0079-05
高粱作为世界上第五大类粮食作物,具有生长力强、二氧化碳利用率高、需水量少等优势,在恶劣的生长环境中还具有耐盐碱、耐瘠薄、耐涝等抗逆特性[1-2]。高粱的应用十分广泛,在酿酒业、能源业、饲料业、造纸业、板材业和色素业等领域具有巨大的发展空间和优势。随着高粱的需求不断增多,产量成为其研究领域的一个重要课题。
氮素是植物生长的必需元素,主要以硝态氮和铵态氮的形式参与植物体内的氮代谢调节过程。硝酸还原酶(NR)是硝态氮转化为铵态氮的第1个关键酶,谷氨酰胺合成酶(GS)、谷氨酸合酶(GOGAT)是无机氮转化为有机氮的关键酶[3],它们对氮代谢同化过程具有不可替代的作用。同时,氮素同化过程受到一系列氮代谢相关酶基因的调控。氮代谢相关酶基因会影响酶活性的表达,从而影响高粱产量和品质。房晓琨研究发现,栽培大豆的NR、GS、GOGAT活性与其对应的基因相对表达量呈显著或极显著正相关关系[4]。植物体内含N化合物的含量与氮代谢相关酶基因表达量的关系也十分密切,鲁黎明等对烤烟研究发现,烟叶可溶性蛋白含量与NR基因相对表达量呈极显著正相关关系[5]。林照辉研究发现,在一定范围内,白菜NR基因的表达随氮素浓度升高而升高[6]。宁改星等以葡萄为试材,研究发现,施氮可以影响氮代谢相关酶基因的表达,改善氮代谢水平[7]。施氮处理下的叶片NR、GS、GDH基因表达水平均高于对照。然而过量施用氮肥,会产生成本增加、资源浪费、环境污染等众多的问题[8]。所以,在保持作物产量稳定的同时,提高氮肥利用效率,减少氮肥使用量是解决问题的关键。
目前有关高粱氮代谢相关酶基因表达的报道比较少。本试验选用辽粘3号、晋杂34高粱品种,分析比较不同氮处理对不同高粱品种各生育期叶片和籽粒的NR、GS、GOGAT基因相对表达量,旨在从分子水平探究氮肥对高粱氮代谢的调控机制,为提高高粱氮素利用率、选择最佳施氮模式提供理论依据。
1 材料与方法
1.1 材料
本试验于2021年在辽宁省农业科学院试验基地进行。试验材料是2个高粱品种辽粘3号、晋杂34,分别设置4个氮处理(N0 :0 kg/hm2,N1:60 kg/hm2,N2:120 kg/hm2,N3:180 kg/hm2),选取苗期、拔节期、抽穗期、成熟期高粱叶片和籽粒进行试验。
1.2 方法
1.2.1 RNA的提取与浓度检测 使用promega RNA提取试剂盒对高粱叶片和籽粒RNA进行提取。用核酸定量仪ScanDrop 200进行浓度检测[9]。
1.2.2 Sor-NR、Sor-GS、Sor-GOGAT基因引物的设计 通过查找相关文献资料[10],确定本试验引物序列(表1)。
1.2.3 反转录 (1)去除基因组DNA。反应体系:5×gDNA Clean Reaction Mix 2 μL,Total RNA*1 8 μL;反应条件:42 ℃ 2 min。(2)反转录反应。反应体系:即去除基因组DNA反应液10 μL,主要包括5× Evo M-MLV RT ReactionMix*1 4 μL,RNase freewater*1 6 μL;反应条件:37 ℃ 15 min;85 ℃ 5 s。
1.2.4 RT-qPCR反应 本试验使用TB Green Premix Ex TaqTMⅡ试剂盒进行RT-qPCR反应。反应体系包括TB Green Premix Ex TaqⅡ 10 μL,PCR Forward Primer(10 μmol/L)0.8 μL,PCR Reverse Primer(10 μmol/L)0.8 μL,DNA模板(<100 ng)*2 2.0 μL,灭菌水6.4 μL。RT-qPCR反應条件:95℃预变性30s;95℃ 5 s,60℃ 30 s,40个循环;熔解,95 ℃ 5 s,60 ℃ 1 min;50 ℃降温30 s。
1.3 统计分析
试验数据用2-ΔΔCT 算法进行计算,并采用SPSS 20.0软件进行差异显著性分析(α=0.05),使用Origin 2021软件进行作图。
2 结果与分析
2.1 氮处理对不同高粱品种不同生育期NR基因相对表达量的影响
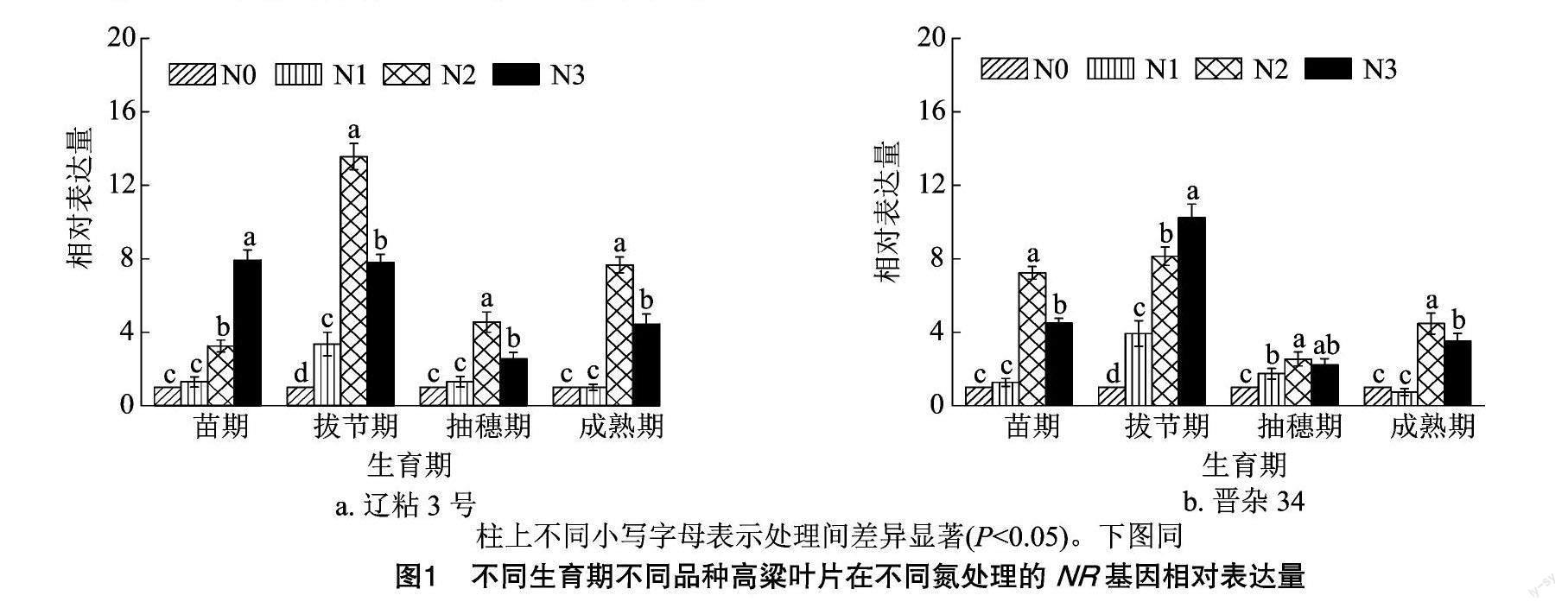
2.1.1 对叶片NR基因相对表达量的影响 以N0处理作为对照,分别对辽粘3号和晋杂34在不同生育期不同氮处理的叶片NR基因相对表达量进行分析。结果表明,在拔节期、抽穗期、成熟期,辽粘3号叶片NR基因相对表达量均表现为N2>N3>N1>N0,N2处理下的叶片NR基因相对表达量显著高于其他处理;在苗期,N3处理的叶片NR基因相对表达量最高,N2处理次之。在苗期、抽穗期、成熟期,晋杂34在N2处理的叶片NR基因相对表达量最高,N3处理次之,其中苗期、成熟期N2处理显著高于其他处理。在拔节期,晋杂34叶片NR基因相对表达量随施氮量增加逐渐上调,N3处理下的叶片NR基因相对表达量分别是N0、N1、N2处理的10.24、2.60、1.26倍(图1)。
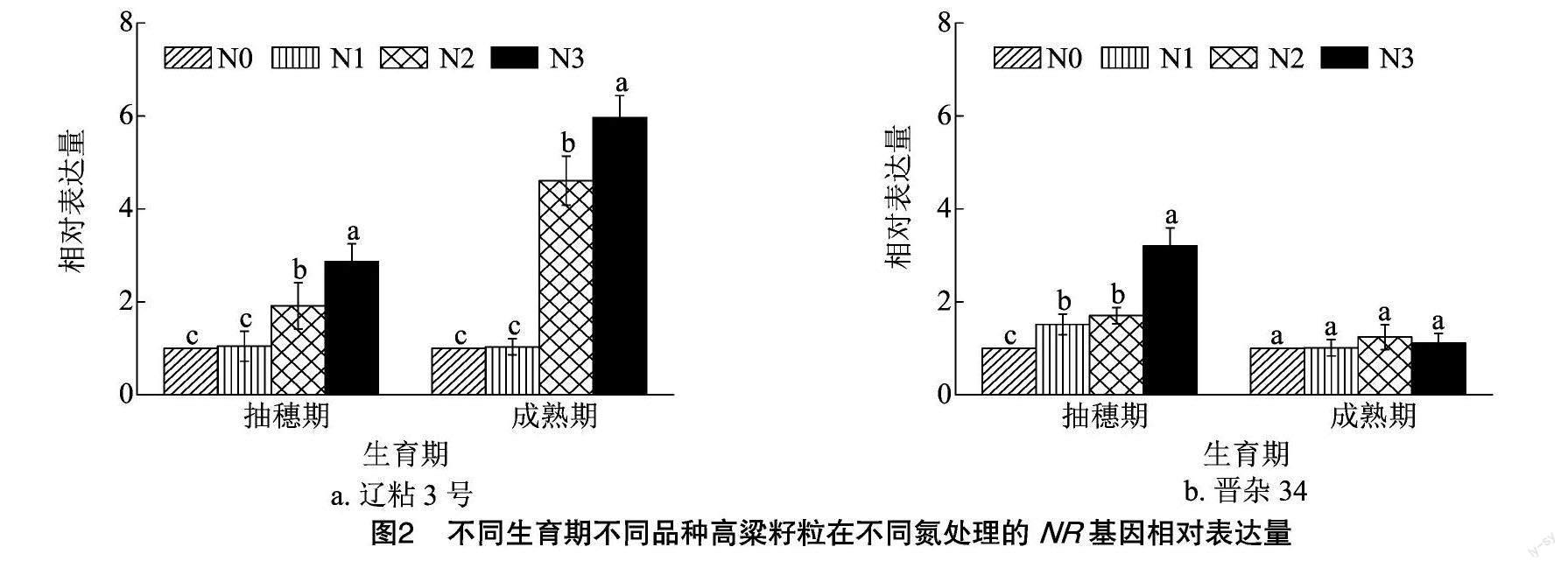
2.1.2 对籽粒NR基因相对表达量的影响 以N0处理作为对照,分别对辽粘3号和晋杂34在不同生育期不同氮处理的籽粒NR基因相对表达量进行分析。结果表明,在抽穗期,辽粘3号和晋杂34籽粒NR基因相对表达量随施氮量增加呈上调趋势,N3处理显著高于其他处理。在成熟期,辽粘3号在N3处理的籽粒NR基因相对表达量显著高于其他处理,晋杂34在不同氮处理的籽粒NR基因相对表达量表现为N2>N3>N1>N0,且各处理之间没有显著差异(图2)。
2.2 氮处理对不同高粱品种不同生育期GS基因相对表达量的影响
2.2.1 对叶片GS基因相对表达量的影响 以N0处理作为对照,分别对辽粘3号和晋杂34在不同生育期不同氮处理的叶片GS基因相对表达量进行分析。结果表明,在苗期、拔节期、抽穗期、成熟期,辽粘3号叶片GS基因相对表达量均表现为N2>N3>N1>N0,N2处理显著高于其他处理。在苗期、拔节期、抽穗期、成熟期,辽粘3号在N2处理的GS基因相对表达量分别是N0处理的3.73、4.55、2.91、1.73倍。在苗期、拔节期、抽穗期、成熟期,晋杂34叶片GS基因相对表达量随施氮量增加逐渐上调,且苗期、拔节期、抽穗期N3处理显著高于其他处理;成熟期N1、N2、N3处理间差异不显著(图3)。
2.2.2 对籽粒GS基因相对表达量的影响 以N0处理作为对照,分别对辽粘3号和晋杂34在不同生育期不同氮处理的籽粒GS基因相对表达量进行分析。结果表明,在抽穗期,辽粘3号和晋杂34高粱籽粒GS基因相对表达量表现为N2>N3>N1>N0,N2处理显著高于其他处理。在成熟期,辽粘3号和晋杂34在N2处理的籽粒GS基因相对表达量最高,N0、N1、N3处理间差异不显著(图4)。
2.3 氮处理对不同高粱品种不同生育期GOGAT基因相对表达量的影响
2.3.1 对叶片GOGAT基因相对表达量的影响 以N0处理作为对照,分别对辽粘3号和晋杂34在不同生育期不同氮处理的叶片GOGAT基因相对表达量进行分析。结果表明,辽粘3号在苗期、拔节期、抽穗期、成熟期N2处理的叶片GOGAT基因相对表达量显著高于其他处理,在苗期、拔节期、抽穗期、成熟期N3处理的叶片GOGAT基因相对表达量分别是N0处理的3.11、7.69、2.02、2.08倍。在苗期、抽穗期,晋杂34在N3处理的叶片GOGAT基因相对表达量最高,分别是N0处理的10.66、1.99倍;在拔节期、成熟期,晋杂34在N2处理的叶片GOGAT基因相对表达量最高,分别是N0处理的6.59、4.58倍(图5)。
2.3.2 对籽粒GOGAT基因相对表达量的影响 以N0处理作为对照,分别对辽粘3号和晋杂34高粱在不同生育期不同氮处理的籽粒GOGAT基因相对表达量进行分析。结果表明,在抽穗期,辽粘3号和晋杂34高粱籽粒GOGAT基因相对表达量表现为N2>N3>N1>N0,N2处理的叶片GOGAT基因相对表达量分别是N0的2.97、3.98倍。在成熟期,辽粘3号和晋杂34高粱籽粒GOGAT基因相对表达量随施氮量增加逐渐上调,且N2、N3处理间差异不显著,N2处理的叶片GOGAT基因相对表达量是N0的12.89、4.38倍(图6)。
3 讨论
氮素同化过程受到基因的调控,氮素含量影响氮代谢相关基因的表达,不同基因在不同品种的氮代谢通路上发挥的作用也会有所差别[11-12]。硝态氮在NR等相关酶的催化下可以转化成铵态氮,GS/GOGAT可以催化铵态氮生成谷氨酸,在无机氮转化成有机氮过程中发挥重要作用。目前,NR基因已在菠菜[13]、桑樹[14]等多个植物中被克隆,GS基因也相继在甜菜[15]、小麦[16]中被克隆。影响氮代谢相关酶基因表达的因素很多,其中温度、光照、Fe3+均可以影响氮代谢相关酶基因的表达[17]。王添民研究发现,不同硝铵比可以影响葡萄NR、GS、GOGAT基因的表达量[18]。植物的不同部位氮代谢相关酶基因表达也有所差别,周月琴研究发现,NR基因在茶树根部的表达量要高于茎和叶[19]。
本研究通过测定高粱NR、GS、GOGAT基因相对表达量发现,除成熟期叶片外,其他各生育期辽粘3号和晋杂34叶片、籽粒在施氮条件下的NR、GS、GOGAT基因相对表达量均高于未施氮处理(N0)。同时,辽粘3号和晋杂34在N2、N3处理的NR、GS、GOGAT基因相对表达量高于N0、N1处理。在抽穗期、成熟期,辽粘3号和晋杂34在N2处理下的叶片NR基因相对表达量最高。随施氮量增加,各生育期辽粘3号叶片GS、GOGAT基因相对表达量呈先上调后下调的变化趋势,且N2处理显著高于其他处理;晋杂34叶片GS基因相对表达量逐渐上调。在抽穗期,辽粘3号和晋杂34籽粒GS、GOGAT基因相对表达量随施氮量增加呈先上调后下调的变化趋势,N2处理表达量最高。以上说明合理施氮可以提高高粱NR、GS、GOGAT基因相对表达量,氮素过多则会抑制氮代谢相关酶基因的表达。本研究结果与宁改星等的研究结果[7,20]保持一致。之前研究的施氮量对高粱氮代谢关键酶活性的影响发现,适当施氮可以提高辽粘3号高粱氮代谢相关酶活性,有利于氮代谢过程,从而提高产量[21]。本研究从分子角度进一步验证上述结果。
4 结论
综上所述,适当施氮可以提高高粱NR、GS、GOGAT基因相对表达量,促进植物氮代谢过程,同时N2、N3处理下的高粱氮代谢相关酶基因相对表达量较高,与氮代谢相关酶活性研究结果一致。综合氮素利用效率等多方面因素,可以将N2(120 kg/hm2)处理确定为辽粘3号、晋杂34高粱的最佳施氮量。
参考文献:
[1]袁保京,王若瑾,姜洁凌,等. 高粱的营养价值及其在猪、鸡饲料与养殖生产中的应用研究进展[J]. 中国畜牧杂志,2014,50(18):70-75.
[2]崔静肖. 夏高粱“晋杂30号”高产配套栽培技术研究[D]. 太谷:山西农业大学,2016.
[3]潘 冬,张玉磊,同拉嘎,等. “库”对可溶性糖及碳氮代谢相关酶基因表达影响[J]. 西南农业学报,2018,31(1):51-56.
[4]房晓琨. 不同进化类型大豆氮代谢关键酶活性及基因表达差异的研究[D]. 长春:吉林农业大学,2022.
[5]鲁黎明,曾孝敏,顾会战,等. 施氮量对烤烟氮代谢关键酶基因表达及代谢产物的影响[J]. 浙江农业学报,2018,30(3):454-460.
[6]林照辉. 氮胁迫下结球白菜苗期硝酸还原酶基因的表达及其生理生化的研究[D]. 长春:吉林大学,2022.
[7]宁改星,马宗桓,毛 娟,等. 施氮量对荒漠区‘蛇龙珠葡萄叶片质量的影响[J]. 果树学报,2019,36(9):1150-1160.
[8]李彤瑶,周青平,陈有军,等. 氮肥用量对披碱草属牧草种子产量和氮肥利用效率的影响[J]. 草业学报,2023,32(3):80-90.
[9]高华晨. 不同高粱品种抗氧化指标及内源激素分析[D]. 沈阳:沈阳师范大学,2019.
[10]赵雅姣. 紫花苜蓿/禾本科牧草间作优势及其氮高效机理和土壤微生态效应研究[D]. 兰州:甘肃农业大学,2020.
[11]矫娇娇. 马铃薯氮高效材料筛选及氮代谢关键酶基因表达量差异[D]. 哈尔滨:东北农业大学,2018.
[12]张小祥,肖 宁,张新钵,等. 新型小麦种衣剂JML对迟播冬小麦苗期生长和碳、氮代谢相关基因表达的影响[J]. 江苏农业学报,2022,38(3):625-634.
[13]程祖锌,何海华,黄志伟,等. 菠菜硝酸还原酶基因的克隆与原核表达[J]. 江苏农业科学,2012,40(12):19-22.
[14]王茜龄,余亚圣,杨 艳,等. 桑树硝酸还原酶基因MaNR的克隆及其表达分析[J]. 中国农業科学,2014,47(12):2465-2475.
[15]王淑春. 甜菜谷氨酰胺合成酶基因的克隆[D]. 哈尔滨:黑龙江大学,2007.
[16]王小纯,张同勋,李高飞,等. 小麦谷氨酰胺合成酶基因克隆与其表达特性分析[J]. 河南农业大学学报,2012,46(5):487-492.
[17]杜 宇,孙 雪,徐年军. 不同盐度和Fe3+浓度对小球藻生长、硝酸还原酶活性及基因表达的影响[J]. 生态科学,2012,31(4):441-445.
[18]王添民. 不同硝铵比对赤霞珠葡萄幼苗碳氮同化及氮代谢相关酶基因表达的影响[D]. 杨凌:西北农林科技大学,2014.
[19]周月琴. 不同茶树品种氮效率的差异与硝酸还原酶基因的克隆与表达分析[D]. 合肥:安徽农业大学,2014.
[20]张文杰,赵 林,张 婷,等. 氮胁迫对草莓氮代谢与相关基因表达的影响[J]. 江苏农业科学,2022,50(24):112-117.
[21]徐洪超,逄洪波,王兰兰,等. 高粱净光合速率和氮代谢关键酶活性对施氮量的响应及相关性分析[J]. 江苏农业科学,2022,50(17):82-89.
