“三新”背景下高中化学反应原理类选择题答题策略
2024-04-08周丽红


摘 要:在“三新(新高考、新教材、新课标)”背景下,自2021年开始,作为四门学业水平选择性考试科目之一的化学,由福建省自主命题。笔者通过对2021年福建省高考化学卷以及2021、2022年省市质检试卷的研究,发现化学反应原理类的选择题一向得分不高。该题型涉及知识面广,考查点多,对学生的化学学科核心素养乃至理科综合素养都提出了较高的要求。文章结合数次大考真题,对该类题型的解题方法和答题策略进行了深入剖析。
关键词:高中化学;真题剖析;解题策略;化学反应原理
中图分类号:G427 文献标识码:A 文章编号:2097-1737(2024)03-0059-03
2021年,福建省普通高考实行“3+1+2”模式:
“3”为全国统考科目(语文、数学、英语),由国家统一命题;“1”为考生在学业水平选择性考试科目物理、历史2门首选科目中选择1门,由福建省自主命题;
“2”为考生在学业水平选择性考试科目思想政治、地理、化学、生物4门再选科目中选择2门,由福建省自主命题,开启新高考时代[1]。
一、题型结构和分值分布
福建省高考化学试卷由选择题与非选择题两大部分组成。选择题共40分,有10小题。非选择题共60分,有5小题,分别是工业流程图题、实验题、化学反应原理题、有机化学基础题和物质结构与性质题。其中,有机和物构各占10分,其余三题分值在10~14分左右。选择题第1题一般紧扣时政热点,其他9题考查的知识点有电化学、离子共存问题、与有机化学知识相关的选择题、小实验题、信息题及经常压轴的化学反应原理类型题。
二、选题意图
选择性必修教材《化学反应原理》中的知识较抽象,对应的学习方法和思维方式与必修1、必修2差异较大[2]。从历次大小考试中不难看出,对于化学反应原理类题型,学生普遍得分不高。学生在平时的练习中对这一题型就有一定的畏难情绪,在高考的压力之下,对该部分知识点掌握不够透彻的学生很容易失分。可以说,该题是集多种能力要求于一体的考题,是以选拔人才为目的的考题。
学生要解该类题型,首先需要有一定的审题能力,能够清晰把握题干意思,领会出题者意图。其次,这种题目一定配有图形,需要数形结合,必要时要将文字转化为图形,辅助答题[3]。再次,必须将化学反应原理的相关知识融会贯通,学会举一反三,明确什么考点用什么原理来破题。最后,该题涉及对数、负对数的知识,这也体现了学科的互通性[4]。
三、真题练兵及解题策略剖析
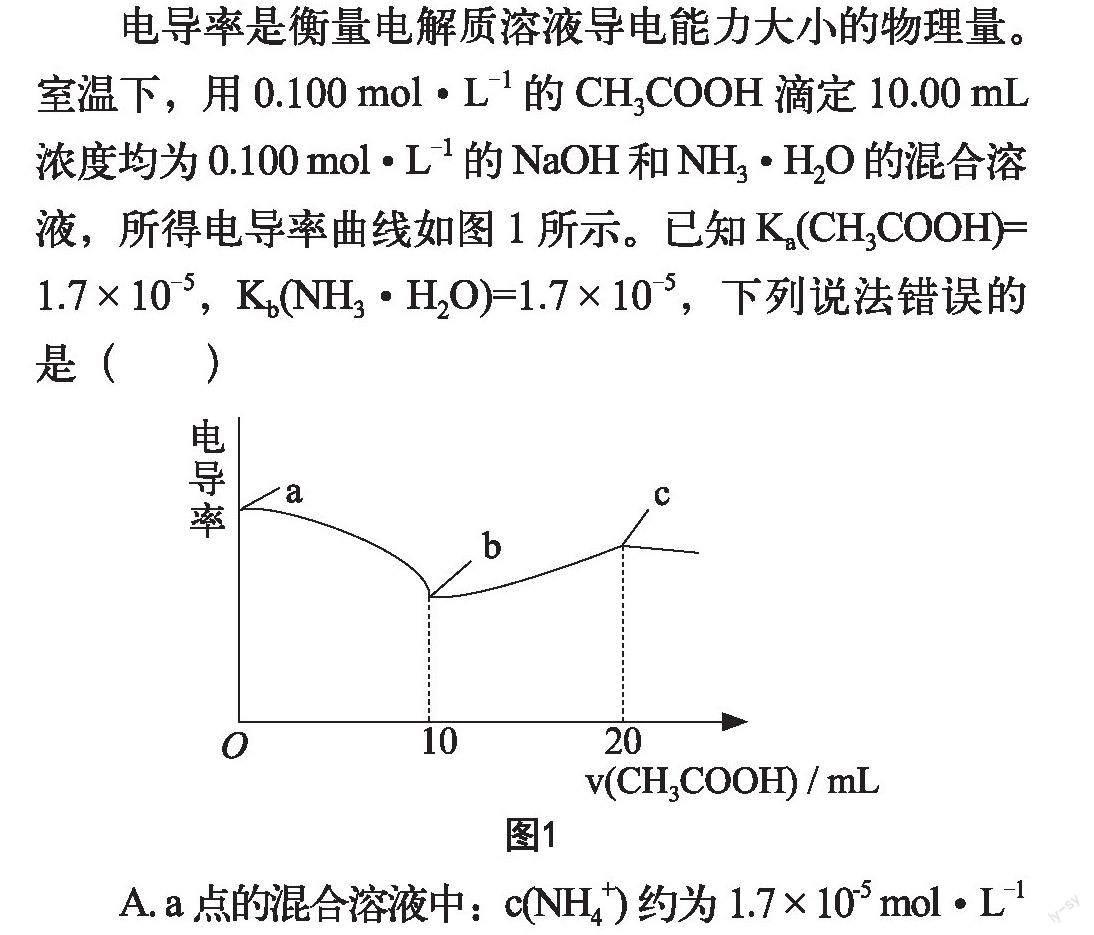
2022年3月福州市高中毕业班质量检测卷选择题第10题:电导率是衡量电解质溶液导电能力大小的物理量。室温下,用0.100 mol·L-1的CH3COOH滴定10.00 mL
浓度均为0.100 mol·L-1的NaOH和NH3·H2O的混合溶液,所得电导率曲线如图1所示。已知Ka(CH3COOH)=1.7×10-5,Kb(NH3·H2O)=1.7×10-5,下列说法错误的是()
A. a点的混合溶液中:c(NH4+)约为1.7×10-5 mol·L-1
B. b点的混合溶液中:c(NH3·H2O)>c(CH3COO-)
C. c点的混合溶液中:c(CH3COO-)+c(CH3COOH)=c(Na+)+c(NH4+)+c(NH3·H2O)
D. a點→c点过程中,溶液中水的电离程度一直增大
本题满分4分,此次福州市平均分仅1.16分,选择正确选项B的仅占29%,是得分率最低的选择题。本题考查宏微结合,要求学生能从分子、离子的水平上分析物质的成分;考查变化和平衡的观点,能够多角度、动态地分析化学反应,并将曲线和反应历程紧密关联;考查严谨求实的科学精神及灵活变通的能力[5]。
(一)大局出发,统揽全局
学生要想解决此类题目,首先要精准掌握题干意思,化繁为简,可用图形精确表示出溶液间的滴定关系:用一弱酸滴定两混碱(NaOH强碱,NH3·H2O弱碱)。其次,注意横纵坐标所表示的物理意义(特别注意单位、pH值、pOH、lg、-lg等),学会提取有用信息。本图像纵坐标表示电导率,电导率大小实际上代表的就是溶液中的离子浓度大小。再次,注意各个点如起点、终点、拐点、突跃点分别代表什么?本题曲线上有两个拐点,表示两个恰好完全反应的点。两混碱都能与醋酸反应,而氢氧化钠碱性更强,所以第一个拐点为氢氧化钠和醋酸恰好完全反应的点,第二个拐点为氨水和醋酸恰好完全反应的点。
(二)落脚考点,细致分析,迁移应用
本题落脚以下4个考点:①考查电离平衡常数的表达式及相关计算;②考查Ka和Kh的关系转换;③考
查物料守恒;④考查水的电离平衡。
A选项考查a点的铵根离子浓度,此时醋酸未加入,
学生很容易想到用氨水的电离平衡常数Kb=
来破题。氨水本身电离出的铵根离子和氢氧根离子的浓度很小,现为氨水和氢氧化钠的混合溶液,氢氧化钠溶液对氨水的电离有抑制作用,使电离出的铵根离子浓度更小,一水合氨的浓度更接近初始浓度。此时,学生要想进行数据处理,突破口在于学会估算。两数相加减,数值相差100倍以上,可通过估算将小的那个数忽略不计,所以c(NH3·H2O)平近似为0.1 mol·L-1,c(OH-)平也约为0.1 mol·L-1,求出c(NH4+)平约为1.7×10-5 mol·L-1。估算在化学计算中的应用十分广泛,且通常考题都有“约为”二字。当然,在计算数值时可估算,若要求写出各微粒的表达式关系,再少的量也要表示出来,不可约去。详见C选项。
B选项比较混合溶液中离子浓度大小。难点在于能够想到用Ka、Kh来判断离子浓度大小。首先,b点的溶质是同浓度的NH3·H2O和CH3COONa,NH3·H2O是弱碱可电离,CH3COONa是强碱弱酸盐可水解,所以要考虑微粒的电离和水解程度对离子浓度带来的影响。利用题目的数据Ka=1.7×10-5,根据Kh=Kw/Ka代入计算,很快得出CH3COO-的水解平衡常数,即溶液中氨水的电离程度大于醋酸根离子的水解程度,从而判定溶液中醋酸根离子剩余更多,所以B选项内容错误,符合题意。该方法也适用多元弱酸酸式盐或多元弱碱碱式盐溶液酸碱性的判定。
C选项考查混合溶液的物料守恒问题,要求学生从大局出发,抓大放小。原子是化学变化的最小粒子,学生应先考虑未反应前各典型元素之间的等量关系,再考虑溶液中少量的电离或水解,导致微粒种类的变化。c点是20 ml 0.1 mol·L-1的醋酸加入10 ml浓度均为0.1 mol·L-1的氢氧化钠和氨水的混合溶液中,因此一开始是n(CH3COOH)=n(NaOH)+n(NH3·H2O)。考虑到反应后的溶液中肯定存在弱离子,这些弱离子会发生少量的电离或水解,导致溶液中存在少量的新的微粒形态。其实,任何溶液的物料守恒中都会出现特征元素的分子和所有离子的存在形式。不论如何反应,溶液中醋酸根离子和醋酸分子的物质的量之和始终等于一开始溶液中的醋酸分子的物质的量。同理,一开始氨水的物质的量等于反应后溶液中氨分子和铵根离子的物质的量之和,代入初始状态的等式关系,结合同一份溶液,体积相同,可知C选项内容正确。对比A选项可知,再少的量也要在表达式中表示出来。
D选项考查水的电离平衡。酸碱溶液抑制水的电离,盐类水解促进水的电离。在碱中滴酸生成盐,只要抓住三点:①起始点,本题一开始是碱性溶液,对水的电离有抑制作用。②恰好反应的点,恰好反应生成有弱离子存在的正盐,盐类水解促进水的电离。③酸
过量的点,此时溶液显酸性,抑制水的电离。学生可将这3点结合起来思考,画一条光滑的正态分布曲线。将这个结论和考题相结合,a→c的过程是碱中加酸至完全反应生成两种正盐,其中一种正盐存在弱离子可水解,故溶液中水的电离程度确实一直增大,D选项内容正确。
(三)举一反三,触类旁通
以上解题方法及变式在该类题型中应用十分广泛。例如,B选项求的是Kh,借助Kh=Kw/Ka求解。若遇到多元弱酸,如磷酸,则Kh1=Kw/Ka3,Kh2=Kw/Ka2,Kh3=Kw/Ka1,即Khn(n=1,2,3……)等于Kw除以该离子上一级的电离平衡常数。在2021年福建高考化学卷第10题B选项中,a点时,分析25℃时碳酸氢钠溶液中,Kw
又如,2022年5月福州市高中毕业班质量检测第10题的D选项,该题是二元弱碱乙二胺溶液中各含氮微粒分布分数随溶液pH值变化的题型,且图为典型的有交叉点的多元弱碱加酸的图形。D选项考查二元弱碱碱式盐溶液中的离子浓度大小的排序问题,要充分考虑弱离子的电离和水解。学生的一大失分点在于误将二元弱碱碱式盐H2NCH2CH2NH3Cl当成强酸弱碱盐来判定溶液的酸碱性。要注意H2NCH2CH2NH3+既能电离也能水解,类似HCO3-,所以最后溶液的酸碱性是要通过比较Kb2和Kh2的大小,才能确定。结合图形和公式Kh2=Kw/Kb1,经过计算可知Kh2
c(H2NCH2CH2NH3+)>c(OH-)>c(H+),D选项错误。在2021年5月福州市质检卷中第10题D选项,求HCO3-+OH-CO32-+H2O的平衡常数,运用数学思维,分子分母同乘以氢离子,建立所求方程与Ka、Kw的关系,即K=Ka2/Kw。同理,其他相关的方程式也可以利用数学思维进行转换。
再如,2022年3月福州市高中毕业班质量检测卷选择题第10题的C选项就借助了守恒思想。三大守恒中高频考查物料守恒和电荷守恒,当然,质子守恒可直接通过二者相减得到。首先要明确考查的是哪种守恒,三大守恒简单的判断方法是:电荷守恒中均出现带电微粒,物料守恒的等式两边出现的都是特征元素的所有相关微粒,质子守恒等式两边必然出现H+和OH-,且等式两边常是离子和分子相混合。考题常利用三大守恒来比较不等式关系,而本题考查的是混合溶液的物料守恒。2021年福建省高考化学卷的第10题考查的是电荷守恒。在C选项中,b点为45℃时0.1 mol·L-1的碳酸氢钠溶液,pH>8.50,可知溶液显碱性,则c(OH-)>c(H+),即c(Na+)≠c(HCO3-)+2c(CO32-),C错误。2021年3月福州市高中毕业班质量检测第10题用氢氧化钠滴定亚硫酸溶液,c点时若c(HSO3-)=c(SO32-),因溶液pH=7.19显碱性,则c(Na+)>3c(HSO3-),也是运用电荷守恒解题。还有2022年5月福州市高中毕业班质量检测第10题的B选项同样考查电荷守恒,难度更大,离子种类更具有隐蔽性。题为乙二胺溶液中各含氮微粒的分布分数随溶液pH值的变化,借助电荷守恒判断不等式关系,涉及溶液中出现的所有带电微粒,因题目自始至终都没提“加某酸”,只是通过乙二胺随pH值的变化的图形来表示加了酸,学生就很容易忽略酸根离子的存在,导致误判,其实B选项是正确的。
以上是新高考福建卷2021年至今的高考卷、省市质检试卷上有关反应原理类的题型,考点集中如下:
(1)与化学平衡常数相关的类型,如①利用平衡常数表达式求K,或已知K求离子浓度,或求K的数量级。②Kh与Kw、Ka或Kb的转化关系(等式或不等式关系)或已知方程式借助Kw、Ka等关系求新方程的K。③考查K的影响因素等。(2)三大守恒应用。常见通过物料守恒、电荷守恒,求等式、不等式关系或溶液中离子浓度大小关系等。
四、结束语
在今后的教学中,笔者将重点培养学生审题能力、提取有效信息能力、读图能力(包括坐标为对数、负对数甚至是多个坐标轴合并的图形)、计算能力(包括数量级判断)、信息迁移能力和思维转化能力,提高学生的化学学科核心素养。
参考文献
张海洋.高考“物质结构与性质”综合题的命题和解题[J].高中数理化,2022(382):50-53.
张安荣,王志庚.问题情境清新脱俗 关键能力创新考查:2022年高考全国乙卷理综第13题分析[J].高中数理化,2022(384):51-52.
李岩.“素养为本”的专题复习教学实践[J].中学化学教学参考,2022(577):61-65.
田家龙.例析化学反应原理综合图形选择题的考查趋向[J].中学化学教学参考,2017(16):68-69.
王娟.2019-2021年高考全国卷化学试题分析与教学策略研究[D].天水:天水师范学院,2022.
作者简介:周丽红(1986.11-),女,福建福清人,任教于福建省福清華侨中学,二级教师,本科学历。
