lncRNA-TUG1作为竞争性内源RNA在心血管疾病中的研究进展*
2024-04-07常晨,苏强
常 晨, 苏 强
(1广西壮族自治区江滨医院,广西 南宁 530021;2桂林医学院,广西 桂林 541000)
长链非编码RNA(long no-coding RNA,lncRNA)是指长度超过200 个核苷酸的RNA 分子,虽然本身并不具备直接编码蛋白质的作用,却可通过参与多种生物过程,包括细胞增殖、分化、凋亡等介导疾病的发生[1]。lncRNA-牛磺酸上调基因1(taurine upregulated gene 1, TUG1)被认为与人类疾病进展密切[2]。此外,过表达lncRNA-TUG1 是心血管疾病后心脏预后不良的生物标志物[3]。
竞争性内源RNA(completing endogenous RNA,ceRNA)主要由lncRNA、环状RNA、假基因转录本以及编码蛋白的mRNA 等组成[4]。其中,lncRNA 通过其分子内miRNA 反应元件竞争性地与miRNA 结合,从而构建ceRNA 调控网络[5]。近年来,lncRNATUG1 被报道在心血管疾病中扮演ceRNA,通过竞争miRNA 结合而发挥miRNA 海绵的作用[6]。因此,了解lncRNA-TUG1潜在的分子机制可能有助于预防和治疗心血管疾病。本文就lncRNA-TUG1作为ceRNA在心血管疾病的研究进展进行综述。
1 lncRNA-TUG1概述
TUG1基因位于染色体22q12 上,是一种长约7.1 kb 高度保守的lncRNA,首次是在体外培养的小鼠视网膜细胞中被观察到[7]。lncRNA-TUG1 不仅参与细胞周期的调节影响细胞的增殖与凋亡,还可作为一种有效的表观遗传调节因子,介导靶基因的组蛋白修饰和DNA 甲基化[8]。更为重要的是lncRNA-TUG1可作为ceRNA,通过海绵吸附miRNA 的方式干扰下游miRNA 靶基因的表达[9]。lncRNA-TUG1 在心脏病理状态下表达显著升高,参与氧化应激、炎症、免疫、细胞凋亡等过程[10-11]。总之,lncRNA-TUG1 可作为ceRNA介导多种生物过程并参与心血管疾病的发展。
2 lncRNA-TUG1与心血管疾病
2.1 lncRNA-TUG1 作为ceRNA 在冠状动脉粥样硬化性心脏病中的作用 血脂异常是动脉粥样硬化(atherosclerosis, AS)的主要危险因素,过表达ln‐cRNA-TUG1 与血脂异常关系密切[12]。AS 的不断加重导致冠状动脉管腔不同程度的阻塞,造成心肌缺血缺氧甚至坏死,即冠状动脉粥样硬化性心脏病的发生[13]。脆性X 智力低下综合征相关蛋白1 在多种肿瘤中表达上调且是患者预后不良的预测因子,其在心肌组织中同样高度富集[14-15]。研究表明ln‐cRNA-TUG1 可作为miR-92a 的分子海绵,且二者表达趋势相反[12]。过表达lncRNA-TUG1通过海绵吸附miR-92a并促进脆性X智力低下综合征相关蛋白1的表达,下调载脂蛋白M 的水平,降低了低密度脂蛋白胆固醇的清除效率,促进AS 的发生[12]。成纤维细胞生长因子1(fibroblast growth factor 1, FGF1)是一种主要参与胚胎发育、伤口愈合、细胞增殖和血管新生等生物过程的调节因子[16]。在小鼠AS 模型中显示敲除TUG1可靶向下调miR-133a 的水平,而促进miR-133a靶基因FGF1的表达,发挥抗炎作用[17]。此外,lncRNA-TUG1可以与miR-30b-3p竞争性结合,逆转miR-30b-3p 靶点溴结构域蛋白4 的降解,沉默TUG1或过表达miR-30b-3p 可缓解AS 小鼠中巨噬细胞的浸润[18]。同源性磷酸酶-张力蛋白(phosphatase and tensin homolog,PTEN)表达水平与AS 程度相反,且是调节平滑肌细胞表型的重要因子[19]。当PTEN表达水平上调则抑制斑块的形成并缓解血管紧张素II 诱导的血管病理性重构[19]。此外,研究[20]表明ln‐cRNA-TUG1 表达趋势与PTEN 水平相反。lncRNATUG1 可作为miR-21 的分子海绵,抑制PTEN 的表达,促进血管平滑肌细胞增殖并诱导细胞凋亡,加速AS[20]。组蛋白脱乙酰酶3(histone deacetylase 3,HDAC3)能促进巨噬细胞对脂多糖诱导的过度炎症反应,抑制HDAC3 表达有助于AS 病变组织胶原的沉积并稳定斑块[21]。此外,lncRNA-TUG1 可作为miR-132-3p 的分子海绵并上调HDAC3基因的表达,刺激心肌细胞活性氧的产生,加重心梗诱导的心肌损伤[22]。此外,lncRNA-TUG1 表达与miR-145-5p 水平相反,敲除TUG1靶向抑制miR-145-5p 靶点B 细胞淋巴瘤2互作蛋白3的表达,调节细胞凋亡并缓解缺氧诱导的心肌细胞损伤[10]。X 连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein, XIAP)属于细胞凋亡抑制蛋白家族,介导内源性和外源性的细胞凋亡[23]。下调miR-181a-5p 水平可促进 XIAP 的表达,对抗氧化应激及炎症反应缓解冠状动脉微栓塞诱导的心肌损伤[24]。lncRNA-TUG1是miR-186-5p的分子海绵,二者表达趋势相反[25]。Zhou 等[25]结果显示过表达lncRNA-TUG1 可促进miR-186-5p 靶基因XIAP的表达,抑制NOD 样受体蛋白3 炎症小体介导的心肌细胞焦亡,缓解冠状动脉微栓塞诱导的心肌损伤。然而,这与前述过表达lncRNA-TUG1 促进心肌损伤观点相反,可能与实验条件、动物模型以及TUG1基因的多态性和细胞特异性表达有关。Zeste同源物增强子 2(enhancer of Zeste homolog 2,EZH2)是miR-34a 和miR-144-3p 的直接靶基因,lncRNATUG1 可通过海绵吸附miR-34a 和miR-144-3p,促进EZH2 的表达,参与肿瘤的发生[26-27]。研究[28]显示ln‐cRNA-TUG1 可能靶向EZH2 调节缺氧诱导的心肌细胞损伤,部分归因于EZH2水平上调诱导的线粒体紊乱及炎症反应。这提示lncRNA-TUG1 可能作为miR-34a 和miR-144-3p 的ceRNA 并 介 导EZH2 的表达,参与AS 进程。低氧诱导因子(hypoxia inducible factor,HIF)-1α 可诱导lncRNA-TUG1过表达,上调肉瘤融合蛋白水平,促进心肌细胞焦亡和线粒体功能障碍加重心肌梗死[29]。然而,Sun 等[30]表明HIF-1α在间充质干细胞来源的外泌体中过表达后可增强血管新生参与心梗后的心脏保护。这可能与心肌梗死发生的阶段、组织样本、细胞来源及定位有关。此外,研究[31]表明心梗后血清中的循环外泌体可以通过富集lncRNA-TUG1,降低HIF-1α 和血管内皮生长因子α 的表达,抑制梗死后血管新生并促进心肌纤维化。远程缺血调节能有效逆转过表达lncRNATUG1 对血管新生的抑制效应[31]。这提示通过直接或间接影响外泌体递送的lncRNA-TUG1是治疗冠心病的潜在策略。lncRNA-TUG1可能通过调节炎症反应、细胞凋亡、心肌纤维化和血管生成等过程参与冠心病。总之,lncRNA-TUG1 可作为心肌缺血的有效诊断标志物以及治疗靶点。
2.2 lncRNA-TUG1 作为ceRNA 在心肌缺血再灌注损伤中的作用 在心肌缺血再灌注损伤(myocardial ischemia-reperfusion injury, MIRI)小鼠和缺氧/复氧(hypoxia/reoxygenation, H/R)诱导的心肌细胞模型中均检测出lncRNA-TUG1 表达显著升高,沉默TUG1可发挥心肌保护作用,提示lncRNA-TUG1 与MIRI 关系密切[32]。高迁移率族蛋白B1 与lncRNA-TUG1 具有相同的表达趋势,其主要参与人类心脏疾病的发展[33]。研究[34]显示沉默TUG1可海绵吸附并促进miR-142-3p 表达,抑制高迁移率族蛋白B1 介导的自噬来缓解MIRI。前述lncRNA-TUG1 与miR-30b-3p竞争性结合并促进溴结构域蛋白4 表达对抗AS[18]。此外,体内和体外研究中均证实溴结构域蛋白4 表达受抑后可激活磷脂酰肌醇-3-激酶/蛋白激酶 B 通路,抑制炎症反应和氧化应激减轻MIRI[35]。这可能是沉默TUG1治疗MIRI 的潜在机制,需动物实验支持。HDAC4表达升高与H/R诱导的心肌细胞线粒体功能障碍有关[36]。lncRNA-TUG1 表达趋势与HDAC4 相同,二者在MIRI 期间表达均上调[32]。研究[32]显示lncRNA-TUG1 可作为miR-340 的分子海绵,沉默TUG1可抑制miR-340 的表达,并抑制miR-340 靶基因HDAC4,调节细胞凋亡缓解MIRI。当HDAC4表达降低时能上调miR-206水平,miR-206表达升高后负向调控丝裂原活化蛋白激酶激酶1 并降低c-Jun 氨基端激酶1 的磷酸化水平,缓解H/R 诱导的心肌细胞凋亡和氧化应激发挥心脏保护作用[37]。lncRNA-TUG1 还是miR-532-5p 的分子海绵,抑制miR-532-5p 可逆转敲除TUG1对H/R 诱导的心肌细胞损伤的作用。研究[38]显示沉默TUG1可靶向上调miR-532-5p 水平,并抑制miR-532-5p 直接靶点SRY盒转录因子10 的表达,通过抗氧化应激,保护心脏。总之,lncRNA-TUG1 可作为多种miRNA 的分子海绵,介导多种信号通路参与MIRI。
2.3 lncRNA-TUG1 作为ceRNA 在心力衰竭中的作用 研究[39]显示lncRNA-TUG1表达水平与充血性心力衰竭患者纽约心功能分级呈现相同的趋势。此外,lncRNA-TUG1可靶向miR-145-5p影响心衰进程,过表达lncRNA-TUG1 或低表达miR-145-5p 提示心衰患者预后不良[39]。V-ets骨髓成红细胞增多症病毒E26 癌基因同源物(v-ets erythroblastosis virus E26 on‐cogene homolog,ETS)2 广泛表达于多种细胞,具有调节细胞增殖、分化、迁移、转化和凋亡等功能[40]。在H2O2诱导的心衰细胞模型中ETS2基因与TUG1启动子区域结合并促进lncRNA-TUG1 的表达[41]。此外,lncRNA-TUG1 通过海绵吸附并下调miR-129-5p,低表达miR-129-5p 靶向上调自噬相关蛋白7 的水平,促进心肌细胞的凋亡和自噬,加速心衰发生[41]。心肌纤维化是心脏衰竭的重要标志,也是心肌重塑的主要病理过程,主要通过促使心室重构和心功能障碍导致心衰。利用血管紧张素II 诱导的小鼠心肌纤维化模型中检测到lncRNA-TUG1 通过海绵吸附miR-495-3p 上调ETS1 的表达,促进细胞外基质沉积,加速心肌纤维化[42]。在心肌梗死后心肌纤维化大鼠模型中检测出miR-133b 表达趋势与lncRNATUG1 相反[43]。此外,结缔组织生长因子与心肌细胞凋亡和心肌纤维化关系密切[44]。研究[43]显示沉默TUG1可加强miR-133b对结缔组织生长因子的抑制,逆转心梗后心肌纤维化进程,部分归因于成纤维细胞的增殖和胶原蛋白的沉积受抑。lncRNA-TUG1还可作为miR-590 的分子海绵,敲低TUG1可上调miR-590 靶基因FGF1的表达,抑制转化生长因子-β1 诱导的心脏成纤维细胞增殖以及胶原蛋白合成,改善心梗后心肌纤维化[45]。尽管对lncRNA-TUG1在心衰中的认识是不充分的,但可确定的是靶向基因TUG1是有效防治心衰的靶点。心衰病因复杂,lncRNATUG1在不同病因导致的心衰中可能存在机制差异。因此,需要构建不同心血管疾病模型诱导心衰,检测lncRNA-TUG1可能的调控机制。
2.4 lncRNA-TUG1 作为ceRNA 在高血压中的作用 过表达lncRNA-TUG1还与高血压导致的心血管重构有关[46]。研究[47]显示lncRNA-TUG1通过竞争性抑制miR-145-5p从而上调miR-145-5p靶基因FGF10的表达,促进大鼠自发性高血压模型中血管平滑肌细胞增殖和迁移,部分归因于Wnt/β-连环蛋白信号通路的激活。值得注意的是Wnt/β-连环蛋白信号通路在自发性高血压、肾血管性高血压以及盐敏感性高血压中不同程度的失调[48]。lncRNA-TUG1在不同病因诱导的高血压中的调控作用可能存在一定差异,这需要动物实验验证。此外,敲除TUG1可促进miR-9-5p表达并下调趋化因子受体4水平,缓解血管紧张素II 诱导的内皮细胞损伤,抑制血管重塑及自发性高血压[49]。
2.5 lncRNA-TUG1 作为ceRNA 在心房颤动中的作用 在房颤患者血清中检测到lncRNA-TUG1表达显著升高,且与miR-29b-3p表达趋势相反[50]。此外,通过人成纤维细胞构建房颤细胞模型中显示lncRNATUG1 是miR-29b-3p 的分子海绵,敲除TUG1可下调miR-29b-3p 靶基因TGF-β1的表达,抑制心脏成纤维细胞增殖以对抗心房颤动[50]。
2.6 lncRNA-TUG1 作为ceRNA 在糖尿病心肌病中的作用 在糖尿病心肌病小鼠模型中观察到ln‐cRNA-TUG1 可作为miR-145a-5p 的分子海绵并促进丝切蛋白2 的表达,促进心肌纤维化,加重心肌病变[51]。沉默TUG1可上调miR-499-5p的表达,缓解糖尿病心肌病诱导的病理性心脏肥大和舒张功能障碍[52]。然而,其中涉及的具体分子机制有待阐明。
lncRNA-TUG1 在心血管疾病中作用机制的总结见表1和图1。
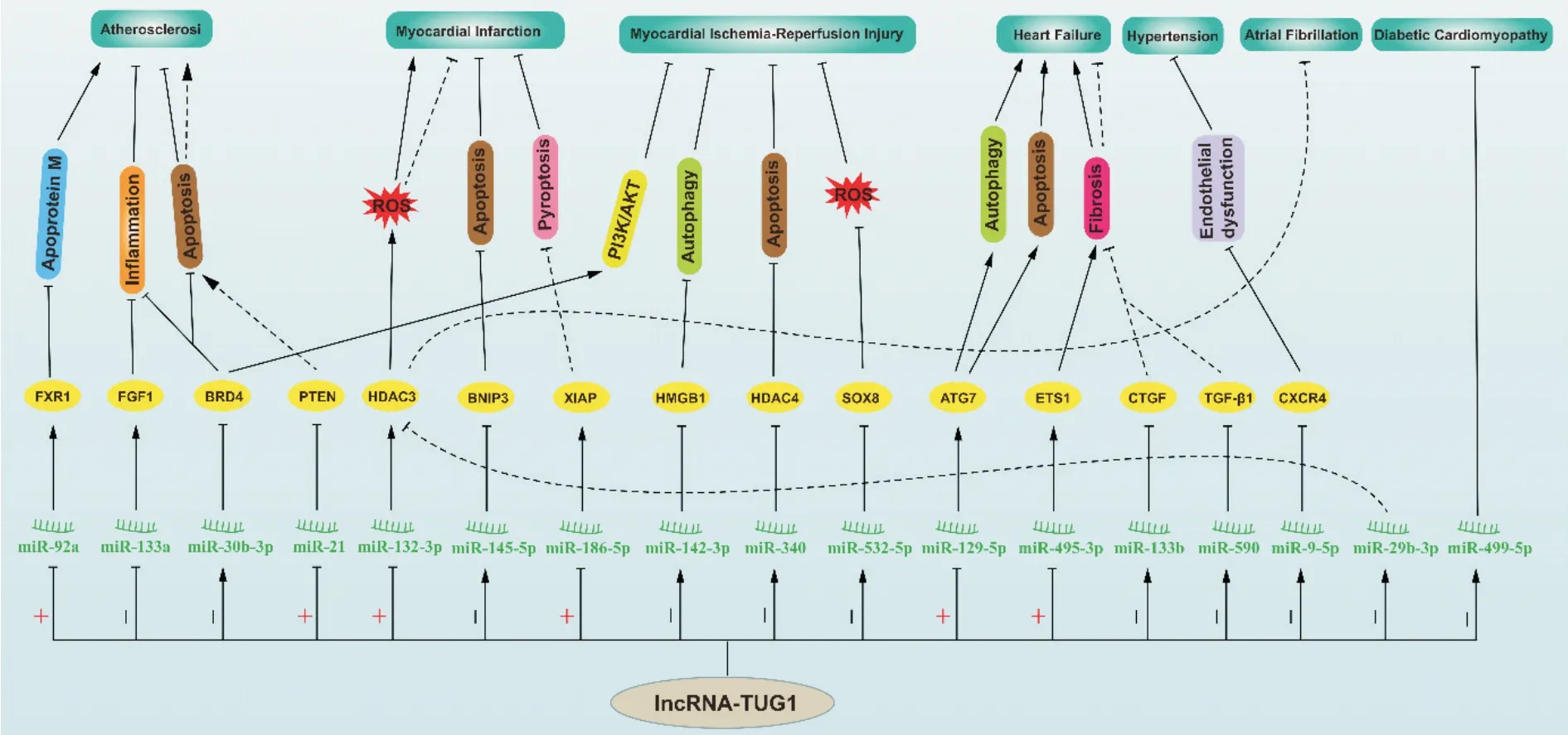
Figure 1. The mechanisms of lncRNA-TUG1 in cardiovascular diseases. ATG7: autophagy related protein 7; AKT: protein kinase B; BRD4: bromodomain-containing protein 4; BNIP3: B‐cell lymphoma 2 interacting protein 3; CTGF: connective tissue growth factor; CXCR4: C-X-C chemokine receptor 4; ETS1: v-ets erythroblastosis virus E26 oncogene homolog 1; FXR1:fragile x mental retardation syndrome related protein 1; FGF1: fibroblast growth factor 1; HDAC: histone deacetylase;HMGB1: high mobility group box protein 1; PTEN: phosphatase and tensin homolog; PI3K: phosphoinositide 3-kinase;SOX8: SRY-box transcription factor 8; TUG1: taurine up-regulated gene 1; TGF: transforming growth factor; XIAP: Xlinked inhibitor of apoptosis protein.图1 lncRNA-TUG1在心血管疾病中的作用机制图
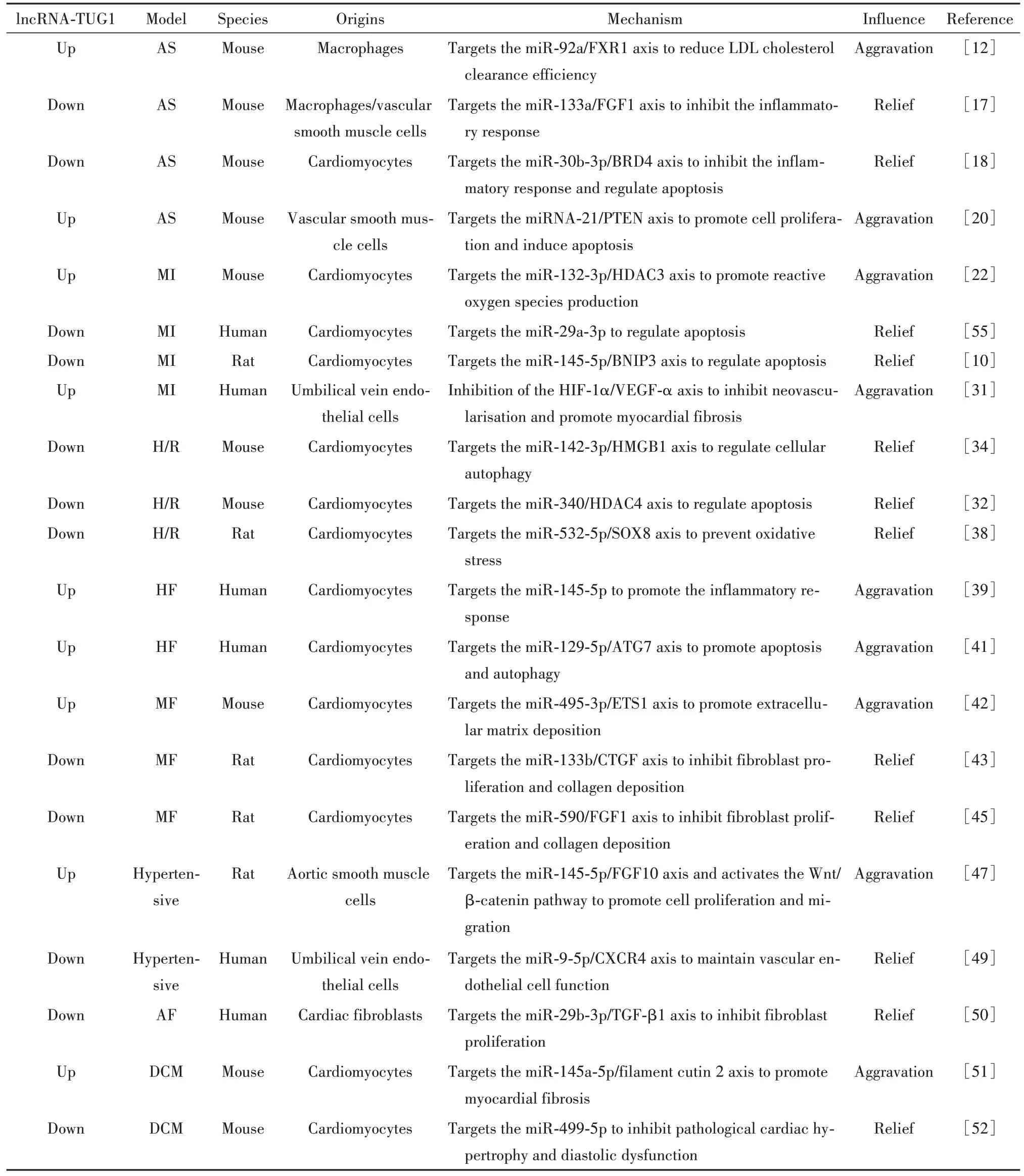
表1 lncRNA-TUG1在心血管疾病中的调控机制Table 1. Regulatory mechanisms of lncRNA-TUG1 in cardiovascular diseases
3 小结与展望
综上所述,lncRNA-TUG1 在心脏病理状态下被激活,参与多种心血管疾病,涉及的机制包括细胞增殖、转移、血管生成、炎症反应、氧化应激和心肌重塑等。这表明lncRNA-TUG1 在心血管疾病中的重要性,提示lncRNA-TUG1 可作为未来心血管疾病诊断和治疗的潜在分子靶点。目前,lncRNA-TUG1 的重点心血管疾病研究领域局限于冠心病、MIRI和心衰,在其他心血管疾病的研究仍在起步阶段。心血管疾病的发生机制是多因素的且lncRNA-TUG1调控机制复杂。现阶段对于lncRNA-TUG1的研究主要集中在ceRNA 网络的基础上。这些表明直接或间接影响lncRNA-TUG1、miRNA 及下游靶基因的表达是治疗心血管疾病的应用前景。近年来,lncRNA-TUG1 在治疗心血管疾病领域取得了重要的突破。lncRNATUG1在体液循环中具有较高的稳定性,突显了其在心血管疾病中作为诊断和预后生物标志物以及治疗靶点的优势[53]。Hu等[3]研究结果显示lncRNA-TUG1可作为心梗患者经皮冠状动脉介入治疗术后无复流的独立预测因子。此外,Zhang 等[53]表明lncRNATUG1 可作为诊断射血分数保留的心力衰竭的生物标志物。总之,lncRNA-TUG1 可作为有效生物标志物,具有预测心血管疾病严重程度及进展的潜在应用[54]。然而,我们还不清楚lncRNA-TUG1 在心血管疾病中的具体作用,以及它是否能够提供高效、安全、特异性的靶向治疗。因此,需要深入了解lncRNA-TUG1 在心血管疾病中的潜在调控机制,为靶向治疗提供确切参考,从而将现有研究结果进行临床转化。
