大鼠心肌成纤维细胞通过增加基质金属蛋白酶2活性抑制心肌细胞缝隙连接功能*
2024-04-07胡廷菊宋雨婷
柏 雪, 高 鸿,2,△, 黄 祥, 严 旭, 胡廷菊, 陈 锐, 安 丽, 宋雨婷
(1贵州医科大学麻醉学院,贵州 贵阳 550002;2中山大学附属第一医院贵州医院,贵州 贵阳 550025;3贵州医科大学附属医院麻醉科,贵州 贵阳 550002)
缝隙连接蛋白43(connexin 43, Cx43)是心脏细胞中表达丰富的一类缝隙连接蛋白,主要定位于心肌缝隙连接处[1-2]。心脏缺血-再灌注(ischemia-reper‐fusion, I/R)后Cx43 的下调和细胞外基质(extracellu‐lar matrix, ECM)蛋白的上调可能导致心律失常的发生[3]。心肌成纤维细胞(cardiac fibroblasts, CFs)是心脏中主要的细胞类型之一[4],既往研究表明,它们可通过旁分泌将功能元件(包括DNA、RNA、蛋白质和其他代谢物)传递给邻近的心肌细胞,通过协同或拮抗作用改变心脏微环境[5];或者通过与心肌细胞的电偶联直接影响心脏电生理[6]。此外,CFs 不仅能合成富含胶原的ECM,也是基质金属蛋白酶(matrix metalloproteinases, MMPs)的主要来源[7]。大鼠心肌I/R 时MMP2 显著激活,可水解SERCA2a 蛋白,引起心功能改变[8]。缺氧复氧(hypoxia/reoxygenation, H/R)后CFs 条件培养液可下调大鼠心肌细胞中Cx43的表达水平[9],但目前关于CFs条件培养液影响大鼠心肌细胞中Cx43 蛋白的机制研究尚不充分,MMPs是否参与该过程仍不清楚,本项工作拟评价MMPs在大鼠CFs条件培养液影响大鼠心肌细胞中Cx43蛋白及缝隙连接功能中的作用,并利用大鼠离体全心I/R模型进行验证,为明确其机制提供参考。
材料和方法
1 细胞和动物
SPF 级雄性SD 大鼠32 只,6~8 周龄,体重260~290 g,由贵州医科大学动物实验中心提供,实验动物许可证编号为SYXK(贵)2023-0002。大鼠心肌细胞(H9c2)购自上海赛百慷生物技术股份有限公司,大鼠心肌成纤维细胞购自上海弘顺生物科技有限公司,所有重复实验均使用3~10代内的细胞进行。
2 主要试剂
特级胎牛血清(货号:04-001-1ACS)购自Biologi‐cal Industries;高糖DMEM 培养液(货号:L110KJ)和0.25%胰酶EDTA 溶液(货号:S310JV)均购自上海源培生物有限公司;青霉素-链霉素(货号:C3421-0100)购自上海逍鹏生物科技有限公司;RIPA 裂解液(货号:P0013B)、蛋白酶抑制剂混合物(货号:P1005)、磷酸酶抑制剂混合物A(货号:P1081)和BCA 蛋白浓度测定试剂盒(货号:P0012)均购自上海碧云天生物技术有限公司;Cx43 抗体(货号:ab217676)购自Abcam;p-Cx43 抗体(货号:370317)购自成都正能生物技术有限责任公司;GAPDH 抗体(货号:PMK042S)和辣根过氧化物酶标记的山羊抗兔 IgG(货号:PMK-014-090M)购自武汉普美克生物技术有限公司;Lucifer Yellow CH(Potassium salt)荧光黄CH 钾盐(货号MX4476-25MG)购于上海懋康生物有限公司;胶原蛋白酶2,9 检测试剂盒(货号:P1700)购于北京普利莱基因技术有限公司;ARP-100(货号:A4432)购自APExBIO;封闭山羊血清(货号:SL038)购自北京索莱宝科技有限公司。
3 主要方法
3.1 大鼠CFs条件培养液制备 CFs随机分为4组:常氧条件下培养组(normal 组)、常氧条件下加ARP-100 组(ARP 组)、H/R 处理组(H/R 组)和H/R 处理加ARP-100 组(H/R+ARP 组)。待细胞融合至80%,吸去原培养液,PBS 清洗2 次后更换新的完全培养液,normal组细胞置于37 ℃、5% CO2+95%空气条件下的培养箱中培养5 h;ARP 组加入ARP-100(0.03 mol/L)于37 ℃、5% CO2+95%空气条件下培养5 h;H/R 组细胞置于缺氧装置中,以5 L/min 的速度持续吹入体积分数为95% N2和体积分数为5% CO2的混合气体15 min,关闭进出气口缺氧培养1 h 后,从缺氧装置中取出细胞培养瓶放入培养箱中继续培养4 h;H/R+ARP 组在更换完全培养液后加入ARP-100(0.03 mol/L),后续处理同H/R 条件组;收集各组细胞培养上清液,于4 ℃下1 417×g离心5 min,0.45 µm 滤器过滤去除死细胞及细胞碎片等杂质,−20 ℃保存或即刻用于H9c2细胞干预实验。
3.2 H9c2 细胞培养与分组 使用含10%胎牛血清、1%青霉素-链霉素的完全培养液培养H9c2细胞,细胞放置于37 ℃、5% CO2+95%空气条件下的培养箱中,当细胞密度达90%以上时,用0.25%胰酶消化后按照1∶2 或1∶3 传代,取对数生长期细胞用于实验。对H9c2 采用随机数字表法分为5 组:control 组、normal 组、ARP 组、H/R 组和H/R+ARP 组,待H9c2 细胞密度达到70%以上,control 组更换完全培养液,normal 组、ARP 组、H/R 组和H/R+ARP 组中分别加入等体积上述对应的条件培养液,在37 ℃、5% CO2+95%空气条件下的培养箱中继续培养。
3.3 细胞Western blot 实验 取各组对数生长期细胞,将RIPA 裂解液、蛋白酶抑制剂混合物和磷酸酶抑制剂混合物A按100∶1∶1比例配制,取适量加入培养皿中冰上摇匀,15 min 后细胞刮刮取裂解后的细胞,在4 ℃冷冻离心机14 170×g离心15 min,收集上清液并使用BCA 蛋白浓度试剂盒对总蛋白进行定量。配制5%积层胶和10%分离胶后进行电泳。起始电压为80 V,待染料进入分离胶后,将电压增为120 V 直至染料到达分离胶底部后停止电泳,在4 ℃条件下,300 mA 稳流进行90 min 转膜,5%脱脂奶粉封闭液室温下振荡封闭2 h,加入Ⅰ抗(Cx43 抗体、p-Cx43 和GAPDH 抗体,分别按1∶6 000、1∶1 000 和1∶5 000 稀释),置入4 ℃冰箱振荡过夜,1×TBST 洗膜3次后加入Ⅱ抗(1∶5 000)室温下振荡孵育1 h。使用ECL 显色后曝光显影。用内参照GAPDH 蛋白条带作为标准灰度值,用 ImageJ 软件计算相应蛋白的相对含量。
3.4 荧光划痕示踪技术 荧光黄染液在心肌细胞中通过缝隙连接扩散的距离,被用以评估心肌细胞间缝隙连接的功能[10]。H9c2 细胞以每孔2×105个接种于6 孔板,细胞融合至80%时吸出原培养液,使用钙镁PBS(CaMg-PBS)清洗3 次,按照分组加入完全培养液或条件培养液继续培养至密度为90%~100%。吸出培养液后使用CaMg-PBS清洗3次,然后每孔加入提前配制并预热的0.05%荧光黄染液1 mL,用手术刀在板底部划三条划痕。细胞膜因机械刺激而通透性改变,使荧光黄染液进入细胞中。然后将6 孔板放入37℃,95% N2+5% CO2空气条件下培养箱孵育10 min。随着细胞膜通透性的恢复,染料困于细胞质中。然后用CaMg-PBS 清洗5~6 次,洗去细胞外的荧光黄染液,而细胞质中的染液可通过缝隙连接通道扩散至相邻的细胞,并用以评估细胞间的缝隙连接功能。最后每孔用4%多聚甲醛(2 mL)固定20 min,取出6孔板置于倒置荧光显微镜下观察(LY:激发波长为428 nm,发射波长为536 nm)。
3.5 明胶酶谱法 本实验根据之前报道的实验方法及胶原蛋白酶MMP2 和MMP9 检测试剂盒说明书进行操作[11]。在制备SDS-PAGE 凝胶时额外加入MMP 底物蛋白,并使之稀释10 倍。条件培养液使用分光光度计定量后,按照1∶1 稀释于SDS-PAGE 非还原性缓冲液,20 mA 恒流低电流电泳,溴酚蓝染色剂跑至凝胶底部时切断电源,室温加入10 mL缓冲液A洗涤凝胶18 h,弃掉缓冲液A 并重复一次。加入10 mL 缓冲液B,室温孵育过夜,倒掉缓冲液B 后加入考马斯亮蓝工作液以覆盖凝胶,快速振荡2 h,使用脱色液(甲醇∶冰醋酸:水=5∶7∶88)清洗2 次,每次2 h。然后置于扫描仪上扫描。
3.6 大鼠离体心脏I/R 模型的构建 本实验根据之前报道的方法构建了大鼠离体心脏I/R 模型[12]。首先向大鼠腹腔注射2.5%肝素钠(2 000 U/kg),15 min后再向腹腔注射3%戊巴比妥(60 mg/kg)。待大鼠完全麻醉后,平躺于手术台上并固定四肢,切开腹部,沿剑突下的纵隔向上剪开胸腔,暴露心脏后用眼科剪剪取心脏。然后立即将其放入4 ℃的Krebs-Henseleit(K-H)液(0.12 mol/L NaCl, 0.004 5 mol/L KCl, 0.001 25 mol/L CaCl2, 0.001 2 mol/L MgCl2·6H2O, 0.001 2 mol/L KH2PO4, 0.02 mol/L NaHCO3,0.01 mol/L C6H12O6, pH 7.4),将主动脉连接Langen‐dorff 灌注系统并对离体大鼠心脏逆行恒温灌注(37 ℃),逐渐增加K-H 液(与95% O2和5% CO2平衡)流速至8~9 mL/min。SD 大鼠随机分为4 组,每组8只:control 组、ARP 组、I/R 组和I/R+ARP 组。control组:37 ℃ K-H 液平衡灌注15 min后继续灌注75 min,90 min 时灌注含DMSO 的37 ℃ K-H 液30 min;ARP组:37 ℃ K-H 液平衡灌注15 min,持续灌注75 min后继续灌注含ARP-100(0.03 mol/L)的37 ℃ K-H 液30 min;IR 组:37 ℃ K-H 液平衡灌注15 min 后继续灌注15 min,注 射心 脏停 跳液Thomas 液(0.12 mol/L NaCl, 0.016 mol/L KCl, 0.016 6 mol/L MgCl2, 0.001 2 mol/L CaCl2, 0.010 mol/L NaHCO3, pH 7.8; 0.02 mL/g, 4 ℃),心脏置于4 ℃ K-H 液中60 min,期间于停搏30 min 时半量复灌Thomas 液(0.01 mL/g, 4 ℃),90 min 时使用37 ℃ K-H 液(含DMSO)再灌注30 min;I/R+ARP 组:37 ℃ K-H 液平衡灌注15 min 后继续灌注15 min,注射 心 脏停 跳 液Thomas 液(0.02 mL/g,4 ℃),心脏置于4 ℃ K-H 液中60 min,中途半量复灌Thomas 液(0.01 mL/g, 4 ℃),90 min 时使用含ARP-100(0.03 mol/L)的37 ℃ K-H液再灌注30 min。
3.7 微电极阵列(multi-electrode array,MEAs)技术 按照之前报道的实验方法利用MEAs 技术采集离体大鼠心脏的心电活动[13]。将EMS64-USB-1003型64 通道电生理标测放大器(8×8, grid;触点材料:银;网孔尺寸:3.0 mm×3.0 mm;电极直径:0.1 mm;电极间距:0.43 mm;电极阻抗:1.5~1.7 Ω)放于SD大鼠左室处,选择EMapScope5.0 软件中MEAs 模式采集数据。采集平衡灌注15 min(T0),再灌注即刻(T1)及再灌注30 min(T2)时的室性心律失常类型、频率及持续时间,根据Lambeth 惯例进行评分[14],利用EMapScope5.0软件进行数据分析。
3.8 免疫组织化学实验 取SD 大鼠的心尖使用4%的中性缓冲福尔马林进行样本固定,置于不同浓度(依次70%、80%、95%、100%)的乙醇中脱水。将样本浸入石蜡中包埋,使用切片机将组织样本切成4 µm 的薄片并附着于玻璃片上。然后使用二甲苯脱蜡,采用不同浓度(依次100%、95%、80%、70%)的乙醇水化。使用柠檬酸溶液孵育3 min,加入10%山羊血清37 ℃封闭30 min,加入Ⅰ抗(Cx43 抗体,1∶500)后4 ℃孵育过夜。PBST洗片3次(3×5 min)加入Ⅱ抗(1∶200),37 ℃孵育30 min。用二氨基联苯胺(diaminobenzidine, DAB)染色以及苏木精反染后,组织切片脱水,用中性香脂封片,在荧光显微镜下对切片进行观察,并使用ImageJ软件对图像进行分析。
3.9 组织Western blot 实验 取各组左心室的心脏组织50 mg,加入0.5 mL 组织裂解液匀浆,冰上裂解30 min 后在4 ℃冷冻离心机14 170×g离心15 min。然后用BCA 试剂盒检测蛋白质浓度,用10% SDSPAGE 凝胶分离蛋白质,然后将其转移到PVDF 膜上,将膜与5%脱脂牛奶封闭液室温孵育2 h。然后在4 ℃下加入Ⅰ抗(Cx43 抗体、p-Cx43 和GAPDH 抗体,分别按1∶6 000、1∶1 000 和1∶5 000 稀释)孵育过夜。1×TBST 洗膜3 次后加入Ⅱ抗(1∶5 000)室温下振荡孵育1 h。使用ECL 显色后曝光显影。用内参照GAPDH 蛋白条带作为标准灰度值,用 ImageJ 软件计算相应蛋白的相对含量。
4 统计学处理
用SPSS 16.0 统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析,组间两两比较采用最小显著性差异法(LSD法)。以P<0.05表示差异有统计学意义。
结 果
1 H/R 处理后的大鼠成纤维细胞条件培养液影响Cx43蛋白表达及缝隙连接功能
与control 组相比,normal 组中Cx43 蛋白表达及磷酸化水平无显著差异(P>0.05),H/R 组中Cx43 蛋白表达及磷酸化水平显著降低(P<0.01),见图1A。与control 组相比,normal 组中荧光扩散范围无显著差异(P>0.05),H/R 组中荧光扩散范围变窄(P<0.01),见图1B、C。
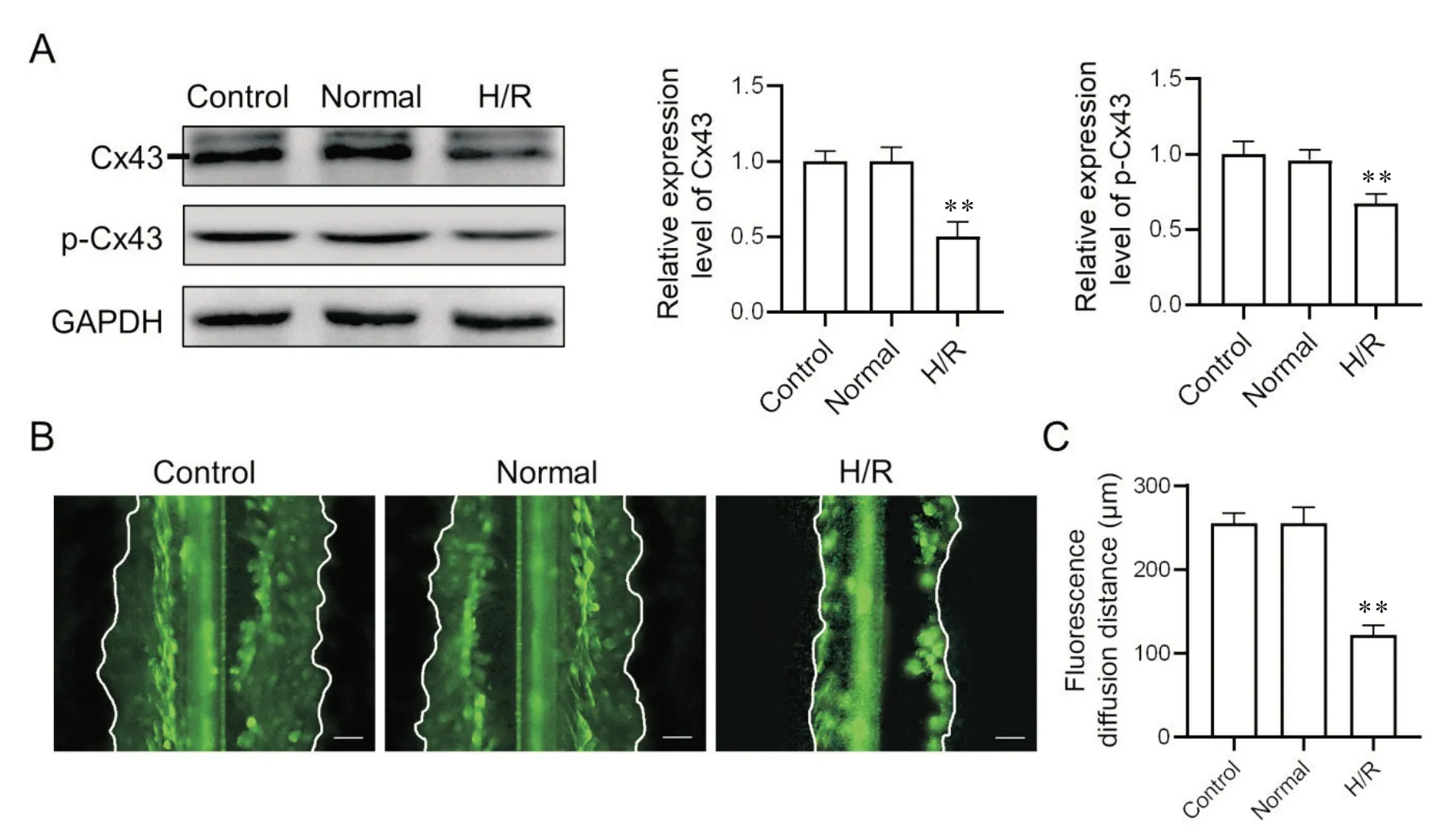
Figure 1. The conditioned medium from H/R-treated rat cardiac fibroblasts impaired gap junction function. A: Western blot analysis of Cx43 and p-Cx43 in H9c2 cells treated with conditioned medium from H/R-treated rat cardiac fibroblasts; B: functional gap junction channels were detected by the scrape loading/dye transfer assay(scale bar=40 µm); C: quantification of the lucifer yellow diffusion. Mean±SD. n=6. **P<0.01 vs control group.图1 H/R后大鼠心肌成纤维细胞条件培养液影响缝隙连接功能
2 ARP-100 减弱H/R 条件培养液对心肌细胞中Cx43表达及缝隙连接功能的影响
明胶酶谱法结果显示,与control 组相比,H/R 组MMP2 活性显著增强(P<0.01),见图2A。H/R 条件培养液使用MMP2特异性抑制剂ARP-100后,与H/R组相比,H/R+ARP 组可抑制H/R 诱导的MMP2 活性增强(P<0.01),见图2B。Western blot 实验结果显示,与control 组相比,ARP 组中Cx43 蛋白表达及磷酸化水平无显著差异(P>0.05);与H/R 组相比,H/R+ARP组中Cx43蛋白表达水平增加(P<0.05),磷酸化水平上调(P<0.05),见图2C。与control 组相比,ARP 组中荧光扩散范围差异无统计学意义(P>0.05);与H/R 组相比,H/R+ARP 组荧光扩散范围增宽(P<0.05),见图2D、E。

Figure 2. ARP attenuated gap junction dysfunction caused by H/R. A and B: Gelatin zymography was conducted to detect the MMPs activities in the medium; C: Western blot analysis of Cx43 and p-Cx43 in H9c2 cells treated with or without ARP; D: func‐tional gap junction channels of H9c2 cell were examined using the scrape loading/dye transfer assay after the treatment of ARP( scale bar=40 µm); E: quantification of the lucifer yellow diffusion. Mean±SD. n=6. **P<0.01 vs control group; #P<0.05, ##P<0.01 vs H/R group.图2 ARP-100减轻H/R引起的缝隙连接功能障碍
3 ARP-100减少在大鼠离体全心I/R 模型中的再灌注心律失常(reperfusion arrhythmia, RA)评分
各组典型心律失常心电图如图3A所示。与con‐trol组比较,ARP 组RA 评分无显著差异(P>0.05),I/R 组RA 评分显著增高(P<0.01);与IR 组比较,IR+ARP组RA评分显著降低(P<0.01),见图3B。
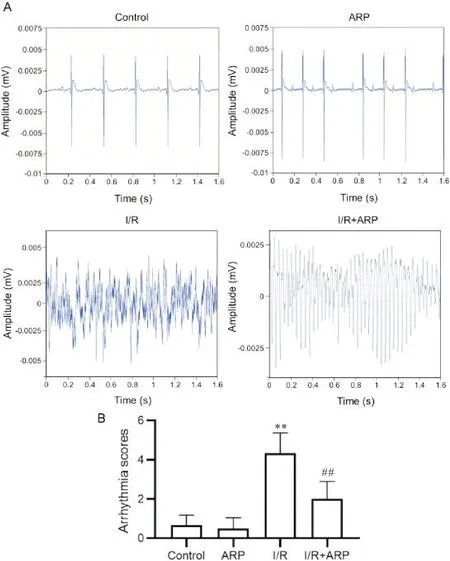
Figure 3. ARP reduced arrhythmia score in isolated rat hearts subjected to I/R injury. A: representative electrocardiograph recordings of all experimental groups; B: arrhythmia score was calculated to quantify arrhythmia severity. Mean±SD. n=8. **P<0.01 vs control group; ##P<0.01 vs I/R group.图3 ARP-100减少离体I/R大鼠心脏的心律失常评分
4 ARP-100增加I/R心肌组织闰盘中Cx43的表达
免疫组织化学染色结果表明,与control 组相比,I/R 组心肌组织闰盘中Cx43 蛋白分布减少;与I/R 组相比,I/R+ARP 组心肌组织闰盘中Cx43 蛋白分布增加,见图4A。Western blot 实验结果显示,与control组相比,I/R组中Cx43蛋白表达及磷酸化水平均显著下降(P<0.01 或P<0.05);与I/R 组比较,I/R+ARP 组Cx43 蛋白表达水平显著升高(P<0.05),磷酸化水平无显著变化,见图4B。

Figure 4. The effect of ARP on the distribution and expression of Cx43. A: representative immunohistochemical images of Cx43 ex‐pression at the intercalated discs of myocardium( scale bar=50 µm); B: Western blot analysis of Cx43 and p-Cx43 in myo‐cardium perfused with or without ARP. Mean±SD. n=8. *P<0.05, **P<0.01vs control group; #P<0.05 vs I/R group.图4 ARP-100对Cx43蛋白分布及表达的影响
讨 论
RA 是心肌缺血再灌注损伤(myocardial isch‐emia-reperfusion injury, MIRI)的主要并发症之一。Cx43蛋白的下调或分布异常可导致心肌细胞间通讯异常,电活动受阻,并可能是导致心律失常、心肌炎和心肌梗死等病理过程的潜在机制之一[15-17]。在大鼠离体心脏I/R 模型中,闰盘处Cx43 蛋白的表达明显下调[12]。此外,心房注射编码Cx43 的腺病毒联合电穿孔技术可使猪心房细胞中Cx43 蛋白的含量增加2.5 倍,显著减少心房颤动的发生率[18]。另一方面,Cx43的基因突变可能导致缝隙连接丢失,细胞间通讯异常,与心脏畸形和婴儿猝死有关[19]。总之,目前的研究表明Cx43 蛋白的下调可能导致细胞间通讯异常、电传导速度减慢和心律失常。
心脏的主要细胞类型包括心肌细胞、成纤维细胞、内皮细胞和平滑肌细胞,其中心肌细胞和成纤维细胞是心脏中的关键细胞类型[20]。成纤维细胞占心脏细胞总数的60%~70%,它们可以通过旁分泌信号、ECM 和机械相互作用等方式直接或间接地与心肌细胞进行细胞通讯,以维持心脏的正常功能并调节心脏对致病刺激的反应[21-22]。虽然心电活动主要存在于心肌细胞中,但近年来,成纤维细胞在心律失常中的作用越来越受到重视。通过shRNA 和siRNA敲减成纤维细胞中的Pitx2c会增加成纤维细胞的活性并影响心脏的电生理和房颤的发生[23]。此外,H/R后的CFs培养液可下调大鼠心肌细胞中Cx43的表达水平[9]。本研究进一步揭示了H/R 使大鼠CFs 培养液中MMP2活性显著增加,而外源性抑制MMP2活性可减弱大鼠CFs 条件培养液对大鼠心肌细胞中Cx43表达、磷酸化水平和缝隙连接的影响。在大鼠离体心脏I/R 模型中也验证了MMP2 特异性抑制剂的心肌保护作用。这些结果提示H/R 处理的大鼠CFs 可能通过分泌MMP2影响大鼠心肌细胞中Cx43蛋白的表达、磷酸化水平和缝隙连接功能。抑制大鼠心肌中MMP2 的过度活化,保持ECM 的动态平衡可能是减少离体大鼠心脏MIRI有希望的策略。
心脏ECM 是一个动态而复杂的网络,在为心脏细胞提供结构支持、调节基因表达和缝隙连接形成方面发挥着重要作用[24]。成纤维细胞可影响ECM中蛋白的表达,而ECM 的重塑可能导致心肌动作电位的传导延迟和心律失常发生的风险增加[25]。本研究结果表明H/R处理可导致大鼠CFs条件培养液中MMP2的活性增加,这可能是H/R条件培养液影响大鼠心肌细胞中Cx43 蛋白表达及缝隙连接功能的潜在机制。但我们未进一步探究MMP2调节Cx43蛋白的具体机制。MMP2可降解ECM中的蛋白成分,这可能影响位于细胞表面的Cx43 蛋白的表达和分布,该领域的深入探究可能为RA的发生机制提供新的见解。
本研究采用Langendorff 灌注装置建立SD 大鼠低温全心I/R 模型,通过MEAs 系统记录电极接触部位心肌细胞的电活动和心律失常发生情况。研究局限性是使用离体大鼠模型来模拟I/R 损伤,而不是体内模型。在大鼠离体心脏I/R 模型中排除了外部因素如心脏的神经元和激素调节以及血液成分的干扰,然而在体内心肌I/R 损伤的病理生理机制更为复杂,MMPs 的激活及作用机制可能更复杂。此外,也需要使用其他MMP2抑制剂或MMP2基因沉默/敲除技术进行后续研究以验证本研究的结果。
综上所述,H/R 处理后的大鼠CFs条件培养液影响大鼠心肌细胞中Cx43 蛋白的表达和缝隙连接功能,其机制可能是大鼠CFs条件培养液中MMP2活性增加介导的。抑制MMP2 活性可减少大鼠离体全心I/R模型中心律失常评分。
