冰片通过TRPM8减轻小鼠心肌梗死后炎症反应并抑制心脏重构*
2024-04-07何滢蓉王武帅段清华
何滢蓉, 胡 陶, 王武帅, 杨 曦, 段清华, 杜 萱,3, 王 强△
(1西南医科大学临床医学院心血管内科,四川 泸州 646000;2西部战区总医院心血管内科,四川 成都 610083;3成都医学院,四川 成都 610500)
冠心病和心肌梗死(myocardial infarction, MI)是威胁国人健康的重大疾病,传统医学在治疗冠心病方面也有一定的经验积累,我国有相当一部分冠心病患者在接受中药复方制剂的治疗,如速效救心丸、复方丹参滴丸、通心络胶囊、银丹心脑通和麝香保心丸等,以上中药复方制剂在治疗冠心病方面显示出较好的疗效[1-2]。冰片(borneol)是上述中药复方制剂的共有成分,既往研究发现冰片具有心肌保护作用,冰片可缩小大鼠MI 面积和减轻病理损伤[3],然而冰片的作用靶点和心肌保护作用机制尚不清楚。近期研究发现,冰片通过直接激活外周感觉神经元上的瞬时受体电位阳离子通道M 亚家族成员8(transient receptor potential cation channel subfamily M member 8, TRPM8)发挥镇痛作用,随机对照双盲临床实验证实外用冰片对术后患者的伤口疼痛有良好的镇痛作用[4-5]。本课题组前期研究发现,TRPM8 参与调控MI 后心脏重构(cardiac remodeling)过程[6],因此我们推测TRPM8 可能也是冰片在心脏的作用靶点,冰片可能通过激活TRPM8缩小MI面积,从而发挥心肌保护作用。
本研究拟采用TRPM8基因敲除(TRPM8gene knockout,TRPM8−/−)小鼠为研究对象,构建小鼠MI模型,研究冰片对MI 后炎症反应和心脏重构的作用,探讨冰片是否通过TRPM8 发挥心肌保护作用,为中医药治疗冠心病提供理论依据。
材料和方法
1 动物
8 周龄雄性SPF 级野生型(wild-type, WT)C57BL/6小鼠,体重20~25 g,购自成都达硕实验动物有限公司;8周龄雄性TRPM8基因敲除(TRPM8−/−)小鼠,体重20~25 g,购自美国Jackson 实验室。严格按照实验动物3R原则给予人道的关怀。
2 主要试剂
冰片购于Sigma Chemical;TRPM8 抗体、GAPDH抗体、中性粒细胞标志物抗Ly6g 抗体和巨噬细胞标志物Anti-Monocyte+Macrophage antibody(MOMA-2)购自Abcam;白细胞介素1β(interleukin-1β, IL-1β)、IL-6、肿瘤坏死因子α(tumor necrosis factor-α, TNFα)和单核细胞趋化蛋白1(monocyte chemotactic pro‐tein-1, MCP-1)ELISA 试剂盒购于eBioscience;Mas‐son 三色(胶原染色)试剂和苏木精-伊红(hematoxy‐lin-eosin, HE)染色试剂购自北京索莱宝科技有限公司。
3 主要方法
3.1 动物的分组及干预 WT 小鼠和TRPM8−/−小鼠各自随机分为4组:假手术(sham)+对照(control)组、sham+冰片组、MI+control 组(结扎冠状动脉左前降支)和MI+冰片组(结扎冠状动脉左前降支并接受冰片治疗),共8 组,每组30 只小鼠。按照本课题组前期实验方法建立小鼠MI模型[6],简要步骤如下:腹腔注射戊巴比妥钠(50 mg/kg)麻醉小鼠,仰卧位固定小鼠,胸骨左侧第3、4 肋间隙将心脏挤出,于左心耳下缘2 mm 处使用0/6 号缝线结扎冠状动脉左前降支,复位心脏,排除胸腔气体后缝合创口,以此建立小鼠MI 模型;假手术组小鼠缝线仅穿过冠状动脉左前降支周围而不结扎。小鼠MI 建模术前5 d 开始,冰片组给予冰片灌胃(100 mg·kg−1·d−1),对照小鼠给予生理盐水灌胃,每天1次,连续灌胃至术后第28天。记录各组小鼠死亡时间和数量,绘制小鼠生存曲线。
3.2 心脏功能及血流动力学的检测 按照课题组前期的方法[7],以戊巴比妥钠(50 mg/kg)腹腔注射麻醉后,取仰卧位进行消毒、铺巾,使用VisualSonics 高分辨率小动物超声成像系统分别测定小鼠左心室射血分数(left ventricular ejection fraction, LVEF)和左心室短轴缩短率(left ventricular fractional shortening,LVFS)。将压力导管经小鼠右侧颈总动脉插入左心室,使用PowerLab 生理多导仪记录小鼠左心室压力曲线,使用Chart 5 软件分别对等容收缩期左室内压力上升最大速率(dP/dtmax)和等容舒张期左室压力下降最大速率(dP/dtmin)进行测量。测量结束后将小鼠安乐死,摘取心脏标本,用磷酸盐缓冲液(phosphatebuffered saline, PBS)反复进行冲洗,置于多聚甲醛固定和-80 ℃冰箱冻存。
3.3 RT-qPCR 检测TRPM8 的mRNA 表达 分别取各组小鼠梗死交界区(peri-infarct zone)和非梗死区(remote area)心肌组织,提取RNA,测定RNA 浓度,逆转录成cDNA。PCR 仪进行real-time PCR 检测,反应程序如下:95 ℃预变性30 s;95 ℃变性5 s,64 ℃退火30 s,共40 个循环。以GAPDH 为内参照,采用2−ΔΔCt法对各组TRPM8的mRNA表达进行相对定量分析。TRPM8 的上游引物序列为5′-AACCCATT‐GACAAGCACAAGAAG-3′,下游引物序列为5′-CAGGAGGAAGGCGATGTAGAAGA-3′,产物长度为107 bp;GAPDH 的上游引物序列为5´-GAAGGTG‐GAAGAGTGGGAGTT-3´,下游引物序列为5´-GA‐CATCAAGAAGGTGGTGAAGC-3´,产物长度为117 bp。
3.4 Western blot 检测TRPM8 蛋白表达 分别取各组小鼠梗死交界区和非梗死区心肌组织,提取蛋白质和测量蛋白浓度,SDS-PAGE 分离等量的蛋白,将其转移到PVDF 膜上,5%牛血清白蛋白溶液封闭1 h,滴加Ⅰ抗(TRPM8 抗体,1∶1 000 稀释;GAPDH 抗体,1∶2 000 稀释)孵育,4 ℃孵育过夜,TBST 洗膜,Ⅱ抗孵育1 h 后再次洗膜,发光液下显影,Image-Pro Plus软件测量蛋白灰度。
3.5 中性粒细胞和巨噬细胞数量的测定 免疫组化参照课题组前期方法[8],4%多聚甲醛固定心脏标本,经脱水、石蜡包埋、切片、脱蜡,抗原修复后滴加山羊血清封闭液封闭20 min,滴加Ⅰ抗(抗Ly6g抗体和MOMA-2,均1∶100 稀释)孵育,4 ℃过夜后PBS 洗涤,滴加Ⅱ抗,37 ℃孵育30 min 后再次PBS 洗涤,滴加DAB 显色液,室温显色,蒸馏水洗涤切片,终止显色,测量梗死交界区巨噬细胞和中性粒细胞的数量。
3.6 ELISA 法检测心肌组织中炎症因子水平 切下部分梗死交界区心肌组织,用PBS 反复冲洗,吸除多余的PBS,在冰浴环境中使用组织匀浆器进行匀浆,经3 000 r/min 离心5 min 后取上清液。采用ELI‐SA 法分析TNF-α、IL-1β、IL-6 和MCP-1 含量,按照试剂盒说明书进行操作。
3.7 心肌组织病理检测 将心脏逆行灌流PBS 缓冲液后,使用4%多聚甲醛固定后进行石蜡包埋,常规切片后行HE 和Masson 染色。使用Image-Pro Plus软件测量心肌细胞面积和心肌纤维化面积,计算非梗死区心肌胶原容积分数(collagen volume fraction,CVF)。CVF(%)=胶原面积/总面积×100%。计算方法参照本课题组文献[9]。每张切片随机取5个视野,计算取其平均值。
4 统计学处理
使用SPSS 26.0 软件进行数据统计分析。各组小鼠生存率采用log-rank 检验进行统计分析,并绘制生存曲线。所有计量资料以采用均数±标准差(mean±SD)表示,组间均数比较采用单因素方差分析,两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
结 果
1 冰片对小鼠心脏中TRPM8表达的影响
WT 小鼠MI 后第5 天,梗死交界区心肌组织中TRPM8 mRNA 和蛋白表达增加(P<0.01),提示TRPM8 可能参与MI 后心脏重构的调控过程;而在sham 组和MI 组中,冰片干预后TRPM8 mRNA 和蛋白表达未见明显变化(P>0.05),提示冰片不影响心脏中TRPM8的表达,见图1。
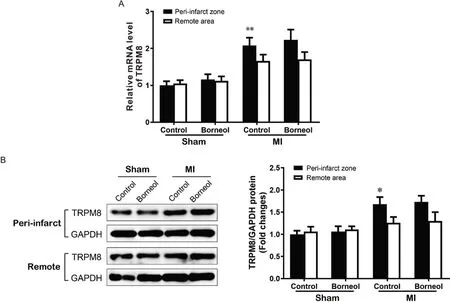
Figure 1. Effect of borneol on TRPM8 mRNA(A) and protein(B) expression in the peri-infarct zone and remote area of the heart from wild-type mice after myocardial infarction (MI) on day 5. Mean±SD. n=6. *P<0.05, **P<0.01 vs sham+control group.图1 冰片对心肌梗死后野生型小鼠心脏中TRPM8表达的影响
2 冰片对小鼠生存率和心脏功能的影响
记录MI 模型建立至术后28 d 各组小鼠死亡时间和数量,绘制生存曲线。在WT小鼠MI模型中,与对照组相比,冰片干预后小鼠生存率提高(P<0.05);而在TRPM8−/−小鼠MI模型中,与对照组相比,冰片干预后小鼠生存率未见明显变化(P>0.05),见图2A、B。MI后第28天进行小鼠心脏功能及血流动力学检测,结果显示,小鼠左心室腔扩大,LVEF 和LVFS 显著减小,dP/dtmax显著降低,同时dP/dtmin显著升高(P<0.01),提示小鼠MI 模型成功建立;在WT 小鼠MI 模型中,与对照组相比,冰片干预后小鼠的LVEF、LVFS 和dP/dtmax显著增加,dP/dtmin显著减小(P<0.05);而在TRPM8−/−小鼠MI模型中,与对照组相比,冰片干预的MI 小鼠LVEF、LVFS、dP/dtmax和dP/dtmin未见显著差异(P>0.05),见图2C~F。这提示冰片可能通过TRPM8增加小鼠MI后生存率,并改善心脏收缩和舒张功能。
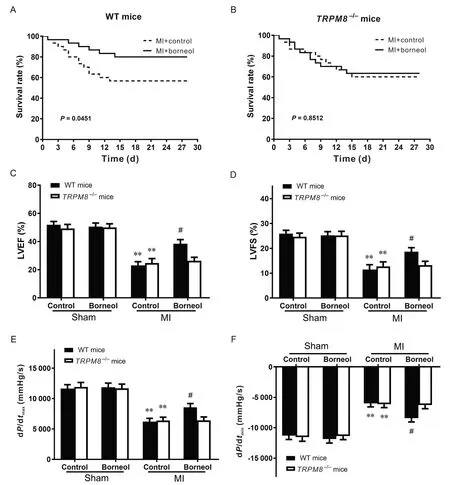
Figure 2. Effect of borneol on the survival rate and cardiac function of wild-type( WT) and TRPM8−/− mice after myocardial infarction(MI). The survival curves were plotted for WT( A) and TRPM8−/−( B) mice after MI with or without borneol, and the values of LVEF( C), LVFS( D), dP/dtmax( E) and dP/dtmin( F) in each group were determined. Mean±SD. n=10. **P<0.01 vs sham+control group; #P<0.05 vs MI+control group.图2 冰片对心肌梗死后小鼠生存率和心脏功能的影响
3 冰片对小鼠MI后炎症细胞浸润的影响
MI 后第5 天,梗死交界区心肌组织中性粒细胞和巨噬细胞数量均显著增加(P<0.01);在WT 小鼠MI模型中,与对照组比较,冰片组梗死交界区中性粒细胞和巨噬细胞数量均显著减少(P<0.01);而在TRPM8−/−小鼠MI模型中,与对照组相比,冰片干预后梗死交界区中性粒细胞和巨噬细胞浸润未见明显变化(P>0.05),见图3。这提示冰片可以减轻小鼠MI后炎症细胞浸润,TRPM8 可能是冰片在心脏的作用靶点。
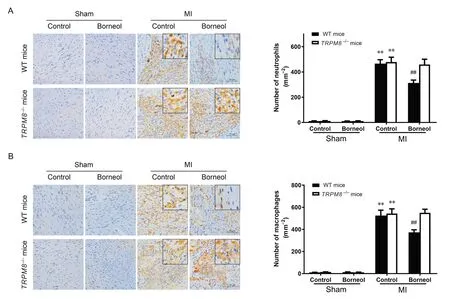
Figure 3. Effect of borneol on the infiltration of neutrophils( A) and macrophages( B) in the peri-infarct zone of the heart from wildtype( WT) and TRPM8−/− mice with myocardial infarction( MI) on day 5( scale bar=50 µm). Mean±SD. n=10. **P<0.01 vs sham+control group; ##P<0.01 vs MI+control group.图3 冰片对小鼠心肌梗死交界区炎症细胞浸润的影响
4 冰片对小鼠MI后心肌炎症因子表达的影响
通过测量梗死交界区炎症因子TNF-α、IL-1β、IL-6 和MCP-1 的含量来评估心肌组织炎症反应,结果显示,MI 后第5 天,梗死交界区TNF-α、IL-1β、IL-6和MCP-1 的表达显著增加(P<0.01);在WT 小鼠MI模型中,与对照组比较,冰片组梗死交界区TNF-α、IL-1β、IL-6 和MCP-1 的表达显著减少(P<0.05 或P<0.01);而在TRPM8−/−小鼠MI模型中,与对照组相比,冰片组梗死交界区TNF-α、IL-1β、IL-6 和MCP-1 的表达未见明显变化(P>0.05),见图4。这提示冰片可能通过TRPM8降低小鼠MI后心肌炎症因子的表达,从而抑制MI后心肌炎症反应。

Figure 4. Effect of borneol on the expression of inflammatory factors in the peri-infarct zone of wild-type(WT) and TRPM8−/− mice with myocardial infarction(MI). The TNF-α( A), IL-1β( B), IL-6( C) and MCP-1(D) levels in the peri-infarct zone were detected by ELISA. Mean±SD. n=10. **P<0.01 vs sham+control group; #P<0.05, ##P<0.01 vs MI+control group.图4 冰片对小鼠心肌梗死交界区心肌炎症因子表达的影响
5 冰片对小鼠MI面积和心肌纤维化的影响
MI 术后第28 天,通过Masson 染色评估MI 面积及心肌纤维化,结果显示,在WT 小鼠MI 模型中,与对照组比较,冰片组小鼠MI 面积显著减小(P<0.01),非梗死区心肌间质和血管周围胶原含量减少,心肌纤维化程度显著减轻(P<0.05);但在TRPM8−/−小鼠MI模型中,与对照组相比,冰片组小鼠MI面积大小及心肌间质和血管周围纤维化未见明显改善(P>0.05),见图5。这提示冰片可能通过TRPM8缩小小鼠MI面积和抑制MI后心肌纤维化。
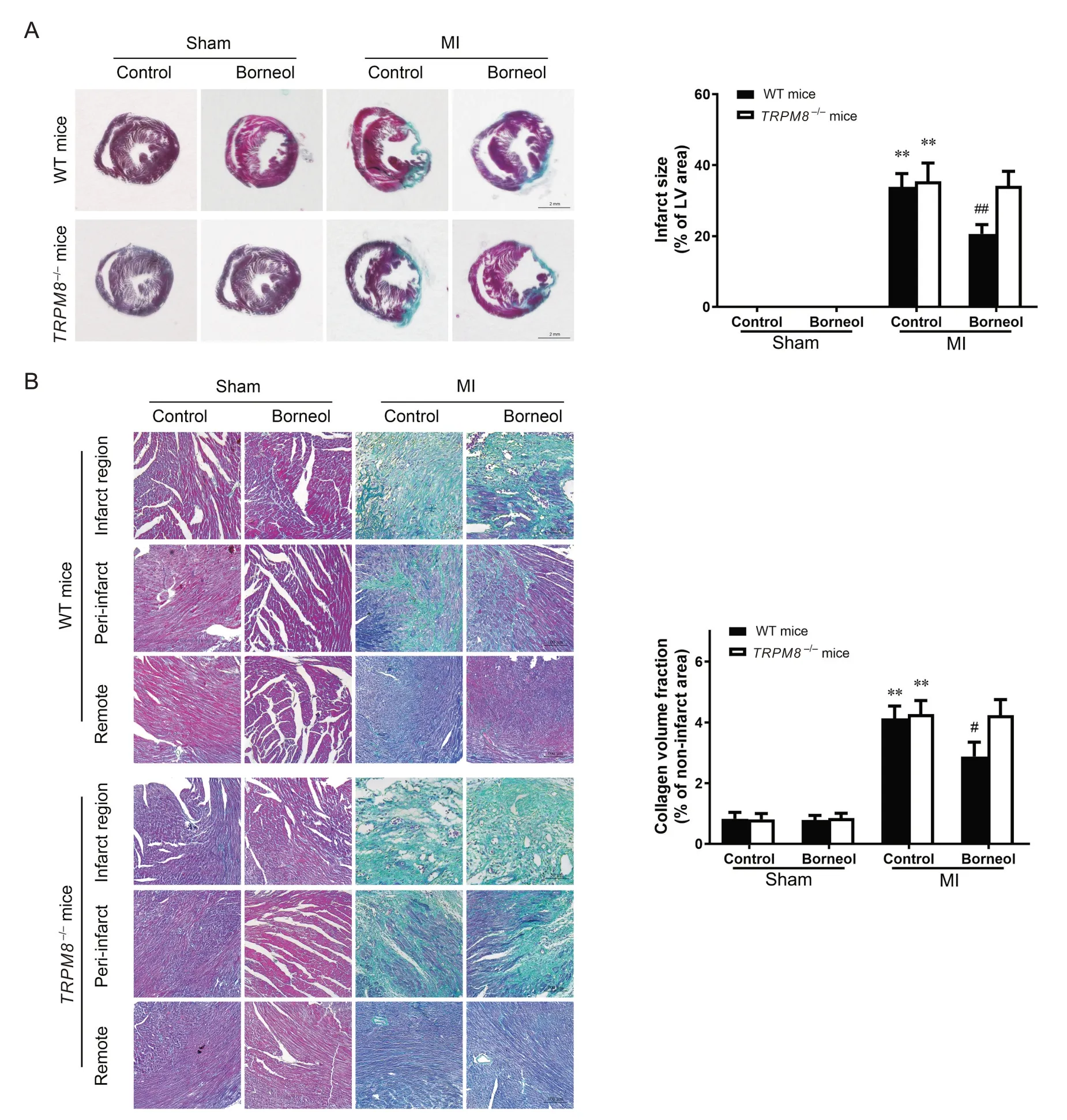
Figure 5. Effect of borneol on the infarct size( A; scale bar=2 mm) and collagen deposition( B; scale bar=50 or 100 µm) in wild-type(WT) and TRPM8−/− mice after myocardial infarction (MI) on day 28(Masson staining). Mean±SD. n=10. **P<0.01 vs sham+control group; #P<0.05, ##P<0.01 vs MI+control group.图5 冰片对小鼠心肌梗死面积和心肌纤维化的影响
6 冰片对小鼠MI后心肌肥大的影响
MI 术后第28 天,HE 染色检测小鼠心肌肥大情况,结果显示,在WT 小鼠MI 模型中,对照组小鼠心脏非梗死区出现明显心肌细胞肥大[心肌细胞面积(415.7±23.6) µm2vs(234.1±12.5) µm2,P<0.01];与对照组相比,冰片组非梗死区心肌细胞面积显著减小[心肌细胞面积(336.3±21.7) µm2vs(415.7±23.6) µm2,P<0.01];而TRPM8−/−小鼠MI 模型中,与对照组比较,冰片组小鼠非梗死区心肌细胞面积未见明显差异(P>0.05),见图6。这提示冰片可能通过TRPM8减轻小鼠心肌肥大,抑制MI后心脏重构。
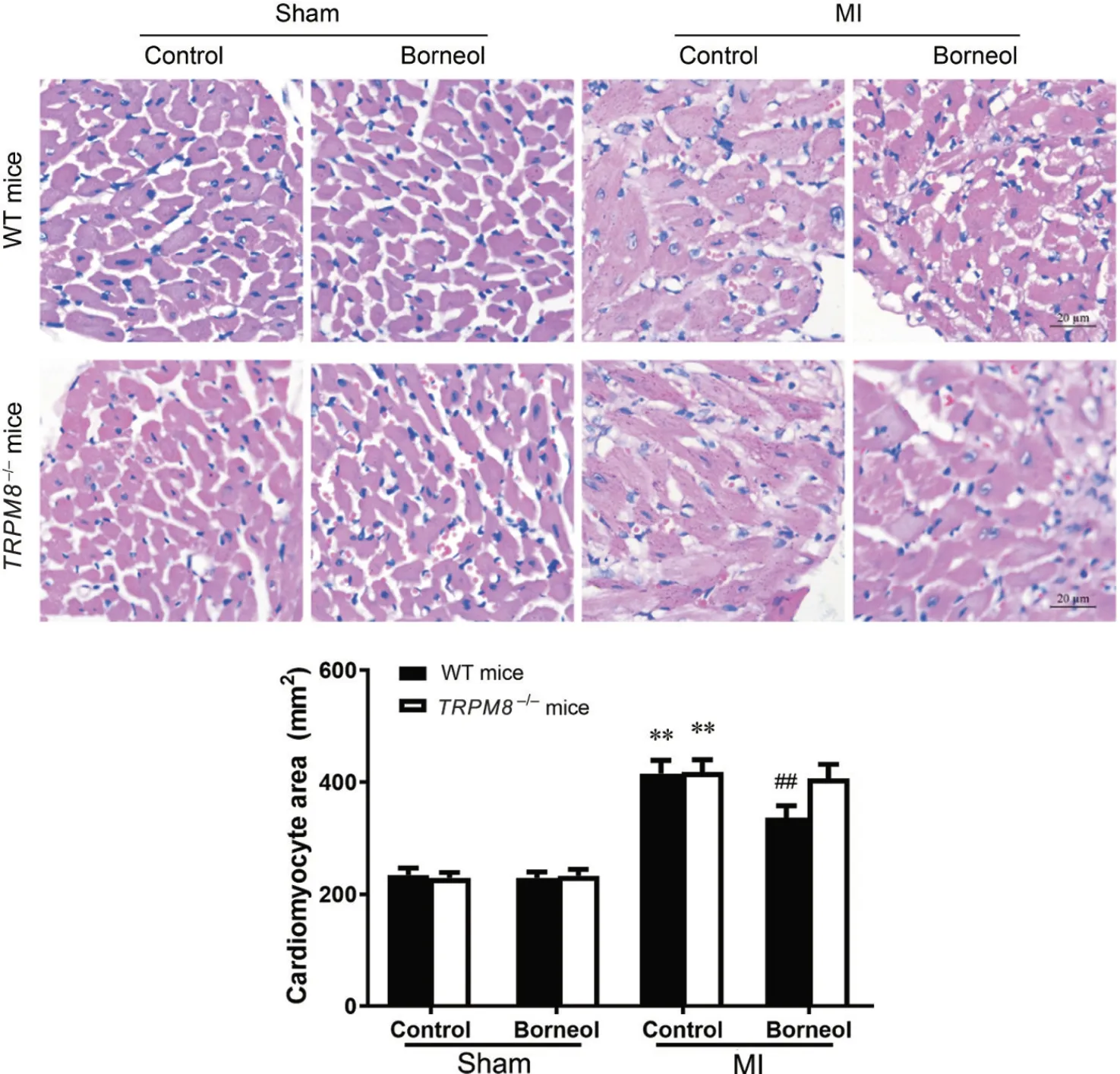
Figure 6. Effect of borneol on cardiomyocyte hypertrophy in wild-type( WT) and TRPM8−/− mice after myocardial infarction( MI) on day 28 (HE staining, scale bar=20 µm). Mean±SD. n=10. **P<0.01 vs sham+control group; ##P<0.01 vs MI+control group.图6 冰片对小鼠心梗后心肌细胞肥大的影响
讨 论
冠心病和MI 的发病率逐年升高,严重威胁人民的健康,随着各级胸痛中心的广泛建设、溶栓治疗和急诊冠脉介入治疗技术的普及,近年来MI 的再灌注治疗率增加,死亡率有所下降。然而,有部分患者的心肌缺血后不能得到及时、有效的再灌注,尤其是缺医少药的广大农村地区;根据《中国心血管健康与疾病报告2022》,近年来农村地区的冠心病和MI 的死亡率已明显超过城镇地区[10]。MI 后启动心脏重构,主要表现为梗死区扩展、心肌细胞肥大和心肌纤维化,并最终进展为心力衰竭[11]。中药复方制剂(如速效救心丸、复方丹参滴丸、通心络胶囊、银丹心脑通和麝香保心丸等)在我国用于冠心病的治疗十分普遍,尤其是广大基层地区,并显示出较好疗效;速效救心丸和复方丹参滴丸深得民心,已成为家庭常备心脑血管药品[1-2]。前期的一些动物实验证实,速效救心丸和麝香保心丸等中药复方制剂具有减轻心肌缺血缺氧损伤和抑制心脏重构的作用[12-15]。前期也有动物实验发现,作为上述中药复方制剂的共有成分,冰片可促进血管生成,缩小大鼠MI 面积,减轻心肌损伤[3,16]。然而冰片的具体作用靶点和心肌保护作用机制目前尚不清楚。
TRPM8 是TRP 家族成员,可以被低温刺激和清凉化合物(如薄荷醇)激活,通过介导钙离子内流发挥生物学效应[17]。我们和其他课题组先后发现,TRPM8 可通过拮抗RhoA/Rho 激酶途径和抑制心肌炎症反应,缩小MI 面积,抑制心脏重构,改善心脏功能[6,18]。有研究证实,冰片通过直接激活外周感觉神经元上的TRPM8,对术后患者的伤口疼痛有良好的镇痛作用[4-5]。本实验中,我们发现:在WT 小鼠中,TRPM8 在梗死交界区心肌组织中表达增加,冰片可以提高MI小鼠的生存率,缩小MI面积,抑制MI后心脏重构,改善心脏功能;而在TRPM8−/−小鼠MI 模型中,冰片对小鼠生存率、MI面积、心肌肥大、心肌纤维化和心脏功能未见明显影响。这提示TRPM8 可能是冰片在心脏的关键作用靶点,冰片可能通过TRPM8抑制小鼠MI后心脏重构,改善心脏功能。
炎症反应在MI 后心脏重构中发挥重要作用,MI可迅速激活固有免疫,进而促进炎症反应以清除细胞外基质碎片和死亡的心肌细胞;可是过度的炎症反应也给心肌带来了一系列不良影响,如心肌细胞的坏死,进一步加剧梗死范围,同时还促进心脏重构,加速心力衰竭发展。既往研究发现,TRPM8通过调节CGRP 和炎症介质(IL-1β 和IL-6)抑制结肠炎的慢性炎症反应[19-20],提示TRPM8 可能是调节炎症反应的重要分子。我们前期发现TRPM8 可抑制心肌炎症反应,缩小MI面积[6]。另有实验证实,复方丹参滴丸等可抑制MI 后炎症反应,减轻心肌缺血性损伤[15]。本实验中,我们发现:在WT小鼠中,冰片可减少中性粒细胞和巨噬细胞在梗死交界区的浸润,抑制炎症因子(TNF-α、IL-1β、IL-6 和MCP-1)的过度表达;而在TRPM8−/−小鼠MI模型中,冰片对炎症细胞和炎症因子的表达未见明显影响。这提示冰片可能通过TRPM8 下调MI 后炎症反应,进而抑制心脏重构,缓解心力衰竭。
冰片通过TRPM8 调控MI 后炎症因子表达和炎症细胞浸润的具体机制,是通过心肌发挥作用,或者作用于炎症细胞[19-20],目前尚不清楚。我们实验中观察到冰片对心脏中TRPM8 表达无影响,结合前期研究[4-5],推测冰片通过激活TRPM8 发挥作用,我们拟在后续实验中探讨冰片对心肌细胞和炎症细胞中TRPM8 活性影响,并在细胞和动物水平通过TRPM8基因过表达观察其对冰片所致心肌细胞和心脏重构的影响。此外,冰片对人类MI 后心脏重构和心力衰竭的防治效果仍需要进一步的深入研究。
综上所述,本研究提示TRPM8 可能是冰片在心脏的重要作用靶点,冰片可能通过TRPM8减轻MI后炎症反应,抑制心脏重构,改善小鼠MI 后的心脏功能。本研究结果将为冠心病和MI 患者的中医药治疗提供理论依据。
