ATP5J通过TOMM20调节线粒体功能并促进人肝细胞癌细胞转移*
2024-04-07冷君志王根旺柳科军惠永峰
冷君志, 王根旺, 刘 迪, 柳科军, 王 琦, 惠永峰
(宁夏医科大学总医院肝胆外科,宁夏 银川 750004)
肝细胞癌是一种常见的原发性肝癌,是全球第六大常见肿瘤。现阶段,如何寻找特异性和敏感性的基因,已经成为研究的关键。肝癌的发生涉及多基因相互作用,尤其是负责线粒体能量代谢过程中的线粒体合酶相关蛋白[1]。在众多线粒体合酶蛋白中,ATP 合成酶H+转运线粒体F0 复合体亚基F6(ATP synthase mitochondrial F0 complex H+trans‐porting, subunit F6, ATP5J)是F1F0-ATP 合酶的脂溶性成分F0的一个亚基,主要供线粒体内能量转化传导信息[2]。ATP 合酶相关蛋白在肿瘤能量代谢过程中发挥着关键作用,ATP5J是催化线粒体ATP 合成的关键基因。在胃癌研究中,富集于线粒体氧化呼吸链的ATP5J 蛋白表达显著上调,影响细胞线粒体的氧化磷酸化功能[3]。有文献报道,ATP5J在结肠癌组织中显著高表达,且与5-氟尿嘧啶耐药有关[4]。线粒体外膜转位酶20(translocase of outer mitochondrial membrane 20, TOMM20)负责识别和运输前体蛋白,在多种肿瘤中高表达,可作为靶向线粒体的关键蛋白[5]。研究表明,TOMM20过表达增强结直肠癌细胞增殖、迁移和侵袭的生物学行为,而降低TOMM20表达显著抑制结直肠癌细胞的生物学行为[6]。然而,ATP5J 在肝癌细胞能量转化中的作用以及与TOMM20 在肝癌细胞中的作用关系尚不明确。基于此,本项工作旨在阐明ATP5J 在肝癌细胞能量转化中的作用,以及是否通过TOMM20 影响肝癌细胞转移,从而为肝癌靶向治疗的进一步研究提供参考。
材料和方法
1 细胞系
人肝癌细胞株(Li-7;目录号:SCSP-5062)购买自中国科学院典型培养物保藏委员会细胞库(https://www.cellbank.org.cn/),所有细胞都在含有10%的胎牛血清和1%青霉素/链霉素的DMEM 培养液(Gib‐co)中,并放置于含5% CO2的恒温培养箱中培养。
2 主要试剂
培养细胞用的胎牛血清、1%青霉素/链霉素、DMEM 培养液购自Gibco;ATP5J 抗体(货号:14114-1-AP)、TOMM20 抗体(货号:11802-1-AP)和β-actin抗体(货号:20536-1-AP)均购自Proteintech;辣根过氧化物酶标记的山羊抗兔IgG(货号:ZB-2301)购自北京中杉金桥生物技术有限公司;线粒体膜电位检测试剂盒(JC-1;货号: M8650) 购自北京索莱宝科技有限公司;pCMV-Mito-AT1.03(线粒体 ATP 荧光探针)检测试剂盒(货号:D2606)、Actin-Tracker Green-488 (微丝绿色荧光探针)检测试剂盒(货号:C2201S)和活性氧检测试剂盒(货号:S0033S)、Li‐po8000™转染试剂(货号: C0533)均购自上海碧云天生物技术有限公司;Transwell 细胞培养小室购自Corning;ATP5J 过表达质粒[ID:498;克隆载体:pcD‐NA3.1(+)]购自上海生工生物工程股份有限公司。
3 方法
3.1ATP5J过表达质粒、小干扰序列模型的构建和实验分组 取生长状态良好的Li-7 细胞以每孔3×105个接种于6 孔板,随机分为4 组,siRNA 阴性对照(siRNA-NC)组,过表达(overexpression,OE)空载体阴性对照(OE-NC)组,ATP5J过表达(ATP5J-OE)组和ATP5J小干扰RNA(ATP5J-siRNA)组。将ATP5J全长克隆到pcDNA3.1载体上,空载体(OE-NC)作为对照;构建三条干扰序列,筛选最佳转染效果的序列作为实验序列(ATP5J-siRNA:Sense:5´-GAGGACCU‐GUUGAUGCUAGUUTT-3´;Antisense:5´-AACUAG‐CAUCAACAGGUCCUCTT-3´。SiRNA-NC:Sense:5´-UUCUCCGAACGUGUCACGUTT-3´; Antisense: 5´-ACGUGACACGUUCGGAGAATT-3´)。按照上海碧云天生物技术有限公司的转染说明,将细胞在37 ℃和5% CO2下培养,细胞融合度达到80%时,使用Lipo8000 转染试剂将过表达质粒和siRNA 序列转染到细胞中,培养48 h后收集细胞,提取蛋白进行验证转染效果,实验重复3次。
3.2 线粒体膜电位实验 各组完成相应干预后,加入1 mL 细胞培养液和1 mL 提前配制好的JC-1 染色工作液,并于细胞培养箱中在37 ℃下孵育20 min。孵育结束后,吸出上清,用配制好的JC-1染色缓冲液(1×)洗涤细胞 2 次,根据试剂盒说明,CCCP 作为诱导线粒体膜电位下降的阳性对照。将试剂盒中的CCCP 按照1∶1 000 加入到细胞培养液中,稀释至10µmol/L,处理细胞20 min。最后在荧光显微镜下观察,使用Image J 软件对图像进行分析,实验重复3遍,进行统计[7]。
3.3 线粒体ATP 荧光探针实验 将Li-7 细胞接种于6 孔板,在37 ℃和5% CO2下培养,当细胞融合度达到80% 时,根据Lipo8000 说明书将pCMV-Mi‐toAT1.03 质粒转染到各组细胞,并用荧光显微镜观察、拍照,通过Image J 软件对图像进行分析[8],实验重复3遍,进行统计。
3.4 微丝绿色荧光探针实验 根据Actin-Tracker Green-488 试剂盒说明书对Li-7 细胞进行微丝荧光成像,将细胞用4%甲醛溶液在室温下固定20 min,用0.1% Triton X-100 的PBS 洗涤细胞3 次,每次5 min, 然后使用Actin-Tracker Green 染色试剂在37 ℃下避光孵育60 min,最后用DAPI对细胞核复染5 min(蓝色)。在荧光显微镜下观察并拍照记录,实验重复3遍,进行统计[9]。
3.5 Transwell 实验 将Li-7 细胞无血清饥饿24 h,制备细胞悬液。取细胞悬液200 µL 加入预铺Matri‐gel 的Transwell 小室中。在24 孔板的下室中加入600 µL 的完全培养液,在37 ℃、5% CO2常规培养48 h。取出Transwell小室,弃去孔中培养液,用4%多聚甲醛溶液固定10 min,0.1%结晶紫染色20 min,PBS洗2 遍,用棉签擦去上室内的细胞。随机取中央及四周5 个视野,倒置显微镜观察随机拍照、计数和统计,实验重复3遍[10]。
3.6 Western blot实验 使用RIPA 裂解缓冲液将细胞在冰上裂解20 min,用BCA 检测试剂盒提取蛋白浓度,经SDS-PAGE 分离后转移到PVDF 膜上。用5%的脱脂奶粉溶液在室温下阻断2 h,加入对应的Ⅰ抗在4 ℃下过夜,所用Ⅰ抗为ATP5J(1∶1 000)、TOMM20(1∶1 000)和β-actin(1∶2 000)。之后再用TBST洗涤3次,加入辣根过氧化物酶标记的Ⅱ抗IgG(1∶5 000)孵育1 h,采用ELC 发光液,β-actin 作为内参照,采用ImageJ 软件进行条带分析[11],实验重复3遍。
3.7 细胞内活性氧(reactive oxygen species, ROS)检测 用2´,7´-二氯荧光素二乙酸酯(DCFH-DA)来评估细胞内ROS 水平。按照1∶1 000 的比例用无血清培养液稀释DCFH-DA,使最终浓度为10 µmol/L,将各组细胞与DCFH-DA 工作液在37 ℃下孵育20 min[12],仅在阳性对照孔中加入Rosup 作为阳性对照。使用荧光显微镜观察荧光强度,随机拍照,实验重复3遍。
4 统计学处理
使用SPSS 23.0进行数据分析,计量数据采用均值±标准差(mean±SD)表示,柱状图采用GraphPad Prism 8.0 软件制作,多组间比较采用单因素方差分析。以P<0.05表示差异有统计学意义。
结 果
1 构建和验证ATP5J过表达、siRNA序列转染效果及ATP5J 对肝癌细胞线粒体膜电位水平、线粒体ATP产生的影响
本实验合成三条ATP5J-siRNA(ATP5J-siRNA1、ATP5J-siRNA2 和ATP5J-siRNA3)序列进行转染,显示ATP5J-siRNA3 转染效果较为显著(P<0.01),后续作为实验序列,见图1A。过表达质粒亦能显著增加ATP5J蛋白的表达(P<0.01),转染效果见图1B。
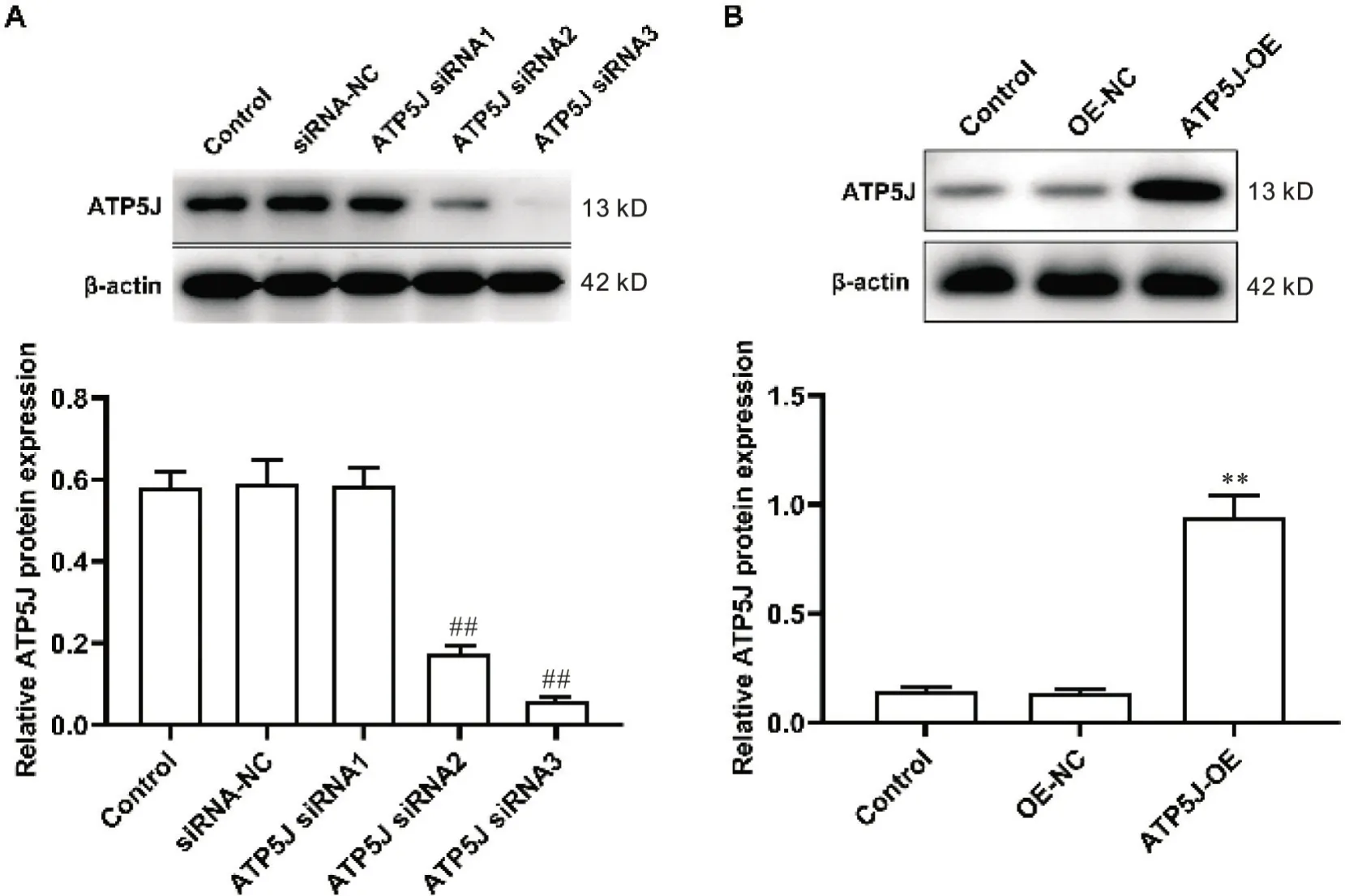
Figure 1. Verification of ATP5J overexpression and knockdown efficiency using Western blot. A: the protein level of ATP5J was de‐tected by Western blot after knockdown of ATP5J; B: the protein level of ATP5J was detected by Western blot after ATP5J overexpression. Mean±SD. n=3. **P<0.01 vs OE-NC; ##P<0.01 vs siRNA-NC.图1 应用Western blot验证ATP5J过表达、敲减转染的效果
线粒体ATP 荧光探针实验结果显示,与OE-NC组相比,过表达ATP5J 显著上调线粒体ATP 荧光强度(P<0.01),而敲减ATP5J与之相反(P<0.01),见图2A。线粒体膜电位实验结果显示,与OE-NC 组相比,过表达ATP5J显著上调线粒体膜电位水平(P<0.01),敲减ATP5J后,线粒体膜电位水平显著降低(P<0.01),见图2B。

Figure 2. Effects of ATP5J on mitochondrial membrane potential and mitochondrial ATP fluorescence intensity in hepatoma carcino‐ma cells. A: compared with OE-NC group, the fluorescence intensity of ATP in ATP5J-OE group was significantly in‐creased; ATP5J siRNA significantly decreased the fluorescence intensity compared with siRNA-NC group, scale bar=20µm. B: compared with OE-NC group, the red fluorescence intensity in ATP5J-OE group was significantly increased;ATP5J siRNA significantly decreased the red fluorescence intensity compared with siRNA-NC group, scale bar=20 µm.Mean±SD. n=3. **P<0.01 vs OE-NC; ##P<0.01 vs siRNA-NC; △△P<0.01 vs positive control.图2 ATP5J对肝癌细胞线粒体ATP荧光强度、线粒体膜电位水平的影响
2 ATP5J调节肝癌细胞ROS生成,并重塑细胞骨架
活性氧检测结果显示,与OE-NC组相比,过表达ATP5J可下调ROS 生成(P<0.01);相比较于siRNANC 组,敲减ATP5J后,ROS 水平显著升高(P<0.01),见图3A。微丝绿色荧光探针检测显示,过表达ATP5J可促进肌动蛋白丝排布及空间构象重塑,驱动细胞膜前端形成突起(P<0.01);敲减ATP5J可抑制肌动蛋白丝的重塑和细胞膜前端突起(P<0.01)。见图3B。
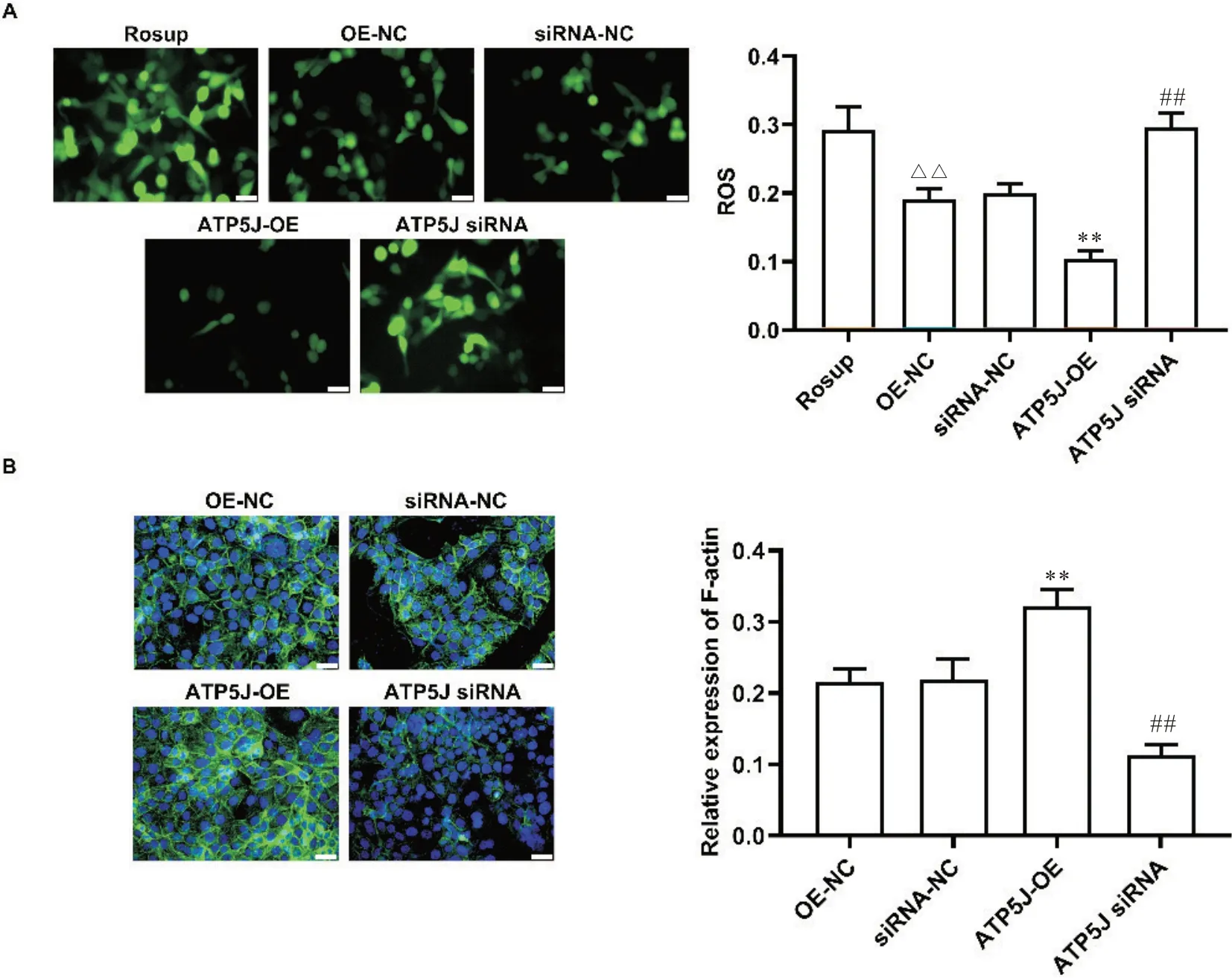
Figure 3.ATP5J regulates ROS production and remodels the cytoskeleton in hepatoma carcinoma cells. A:compared with OE-NC group, the intensity of fluorescence in ATP5J-OE group was significantly decreased; ATP5J siRNA significantly increased the fluorescence intensity compared with siRNA-NC group, scale bar=20 µm. B: compared with OE-NC group, fluores‐cence intensity of microfilaments in ATP5J-OE group was significantly increased; ATP5J siRNA significantly decreased the fluorescence intensity of microfilaments compared with siRNA-NC group, scale bar=20 µm. Mean±SD. n=3. **P<0.01 vs OE-NC; ##P<0.01 vs siRNA-NC; △△P<0.01 vs Rosup.图3 ATP5J调节肝癌细胞ROS生成,并重塑细胞骨架
3 ATP5J 可调节肝癌细胞的侵袭能力,并调节TOMM20表达影响肝癌细胞线粒体功能
Transwell 实验结果显示,过表达ATP5J显著促进Li-7 细胞的侵袭能力(P<0.01)。敲减ATP5J后,肝癌细胞侵袭能力减弱(P<0.01)。见图4A。

Figure 4. ATP5J regulates the ability of invasion and the expression of TOMM20 in hepatoma carcinoma cells. A: compared with OENC group, the numbers of invasion cells in ATP5J-OE group were significantly increased, ATP5J siRNA significantly de‐creased the numbers of invasion cells compared with siRNA-NC group, scale bar=50 µm. B: compared with OE-NC group,Western blot results showed that TOMM20 protein expression in ATP5J-OE group was increased; ATP5J siRNA signifi‐cantly decreased TOMM20 protein expression compared with siRNA-NC group. Mean±SD. n=3. **P<0.01 vs OE-NC; ##P<0.01 vs siRNA-NC.图4 ATP5J可调节肝癌细胞的侵袭能力,并调节TOMM20表达
Western blot 实验结果显示,过表达ATP5J后TOMM20 的表达增多(P<0.01),敲减ATP5J可显著降低TOMM20蛋白的表达水平(P<0.01),见图4B。
讨 论
在肝癌发展过程中,低效的诊断策略和有限的治疗靶点是临床医生面临的主要困难。随着研究的深入,观察到线粒体能量代谢相关蛋白影响着肝癌的进展。线粒体ATP 合酶的异常表达在肿瘤能量代谢过程中起着重要作用[13]。本研究旨在探索线粒体ATP 合酶ATP5J 通过TOMM20 调节线粒体膜电位水平和线粒体ATP 产生介导细胞骨架重塑影响肝癌细胞转移的作用机制。
有研究表明,结直肠癌细胞中ATP5J 表达上调可增强细胞迁移和5-氟尿嘧啶耐药性,下调ATP5J可逆转这一反应[2]。胃癌研究中,胃癌组织与癌旁组织相比差异显著的基因(包括ATP5J等)主要富集于线粒体氧化呼吸链,线粒体膜电位水平高低介导胃癌细胞ROS 的生成,两者相互作用影响细胞凋亡的发生[3]。研究显示,通过调节ROS 水平可影响肺癌细胞的转移能力[14]。本实验观察到ATP5J 可影响肝癌细胞ROS 的产生,此结果与上述的研究结果相似,这为了解ATP5J 在肝癌进展中的作用提供新参考。重要的是,实验观察到ATP5J 可调节线粒体膜电位水平,进一步表明ATP5J 是调节肝癌细胞线粒体功能的关键指标之一。综上,推测ATP5J 是细胞能量代谢和ROS产生的重要介质。
在肿瘤转移过程中,线粒体ATP 和线粒体膜电位水平的升高,可显著增强肿瘤细胞能量转换,这无疑给肿瘤的治疗带来了挑战[15]。针对大量的线粒体功能蛋白,仅有少数的蛋白在肿瘤治疗中有研究意义[16]。ATP5J 是ATPase 的一部分,在能量转化过程中至关重要,有研究显示ATP5J 表达水平的变化可控制肌肉中的能量代谢和线粒体表型[17]。在结直肠癌研究中,下调ATP5J 表达会减弱结肠癌细胞迁移,提示ATP5J 成为结直肠癌患者预后的一个重要因素[4]。敲低ATP5J表达可增强耐药细胞对靶向药物治疗的敏感性[18]。Yang 等[19]研究表明,雌二醇通过抑制雌激素受体β (ERβ)与ATP5J 的相互作用,从而抑制JAK1-STAT6信号通路,抑制肝癌进展。本实验结果显示,过表达ATP5J可显著上调线粒体膜电位水平、促进线粒体ATP 产生,介导细胞骨架重塑,增强肝癌细胞侵袭能力;然而,敲减ATP5J则出现相反的作用。总之,ATP5J 可能通过调节线粒体膜电位和线粒体ATP 产生重塑细胞骨架,影响肝癌细胞转移。本研究结果与Lusby等[20]的观点描述相似,也表现出ATP5J 在肿瘤细胞侵袭中的作用。但是与Yang 团队阐述的角度不同,本实验主要从线粒体功能、能量代谢到细胞骨架重塑的角度,揭示了ATP5J在肝癌细胞转移中的作用。肿瘤细胞生物学行为离不开能量供应,本研究从细胞实验中观察到肝癌细胞能量代谢途径的相关因子——ATP5J,这为研究肝癌发展和靶向治疗方案提供参考依据。未来将深入开展ATP5J在肝癌细胞代谢中的作用。
TOMM20 在肝癌组织中高表达,可促进肝癌细胞的增殖、侵袭和迁移[21]。在人软骨肉瘤细胞中,过表达TOMM20 可诱导软骨肉瘤肿瘤在体内生长,表明TOMM20 在软骨肉瘤细胞增殖、细胞凋亡抵抗和化疗抵抗中的作用[5]。本实验结果显示,ATP5J可调节肝癌细胞TOMM20 表达,ATP5J 具有介导肝癌细胞侵袭、调节线粒体膜电位和ROS的作用,而在这个过程中观察到,ATP5J 可能通过TOMM20 调节线粒体功能和线粒体ATP 产生,介导细胞骨架重塑影响肝癌细胞转移。ATP5J 对TOMM20 的调节作用为肝癌细胞能量代谢机制提供了新的参考,推测这种作用关系与肝癌进展有关。
综上,ATP5J 可调节肝癌细胞线粒体能量转化,其可能通过TOMM20 调节线粒体膜电位水平和线粒体ATP产生介导细胞骨架重塑影响肝癌细胞转移。
