TNF-α 通过CXCL10/CXCR3 信号通路促进结肠癌细胞上皮间质化的相关分子机制
2024-04-07李艳萌徐德龙夏向峰吴西彩李园园律洁
李艳萌 徐德龙 夏向峰 吴西彩★ 李园园 律洁
结肠癌是临床常见的消化道肿瘤,在近些年来的流行病学统计中发现,其发病率与死亡率居高不下,给患者自身身心健康及家庭和社会带来极大负担。在结肠癌的发生与进展过程中,癌细胞的转移严重影响了患者的预后[1]。上皮间质化(epithelial-mesenchymal transition,EMT)指的是在机体中由于生理与病理状态改变,使得上皮细胞通过多种复杂的特殊事件向间质样细胞转化,在这个过程中丧失极性并使得上皮细胞粘附,同时获得转移能力,引起癌细胞的迁移与侵袭[2]。近年来,国内外大量研究表明EMT 在多种恶性肿瘤慢性炎症引起的侵袭、迁移过程中发生,包括乳腺癌、胃癌、肝癌及非小细胞肺癌等[3]。肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)是肿瘤微环境中的主要炎症介质,通过诱导多种趋化因子建立复杂的网络来诱导肿瘤的生长与转移[4]。最近的报道显示CXC 趋化因子配体10/CXC 趋化因子受体3(CXC chemokine ligand-10,CXCL10/CXCchemokine receptor3,CXCR3)信号通路与癌细胞的侵袭和转移相关[5]。但目前关于TNF-α 否能通过调控趋化因子表达而影响EMT 介导的结肠癌细胞转移作用尚不清楚。因此本研究将探讨TNF-α 是否能够通过调控SW480 细胞中CXCL10/CXCR3信号通路的表达从而影响EMT 的发生,最终引起细胞的迁移发生。
1 材料与方法
1.1 实验试剂
SW480 细胞购自中科院上海细胞库;PCR 引物由上海生工公司合成;TRIzol Reagent 总RNA提取试剂盒、CXCL10、CXCR3、Vimentin、Fibronectin及E-cad抗体及二抗购自美国Abcam 公司;β-actin抗体购自北京中杉金桥公司;重组人TNF-α 购自北京义翘神州公司;siRNA-CXCR3 购自赛默飞世尔科技有限公司。
1.2 实验仪器
细胞培养箱购自德国赛默飞有限公司(Thermoforma 3111);全自动凝胶图像分析系统购自美国伯乐公司(ChemiDoc);Real-time PCR 仪购自美国伯乐公司(CFX Connect);荧光倒置显微镜购自日本奥林巴斯株式会社(U-HGLGPS)。
1.3 实验方法
1.3.1 细胞培养及处理
将SW480 原代细胞株细胞置于加入了双抗及10%胎牛血清的DMEM 培养基的细胞培养皿中进行培养。当细胞处于对数生长期时使用重组人TNF-α 刺激细胞及使用siRNA-CXCR3 转染沉默处理细胞。其中正常培养的细胞为NC 组,使用TNF-α 刺激的细胞为TNF-α 组,使用TNF-α 刺激及siRNA-CXCR3 转染的细胞为TNF-α+si-CXCR3 组。
1.3.2 实时荧光定量试验(Real-time PCR)检测各项指标的mRNA 水平
收集细胞,通过Trizol 试剂盒制备总RNA 的并反转录成cDNA,随后加入SYBR Green 染料及CXCL10、CXCR3、Vimentin、Fibronectin、E-cad与β-actin上下游引物混合离心,引物序列见表1,随后于PCR 仪上进行扩增,完成后做溶解曲线。以采集到的荧光信号值(Ct 值)运用2-ΔΔCt方法进行相对定量分析。

表1 各组基因上下游引物序列Table 1 Primers sequence of upstream and downstream genes
1.3.3 免疫印迹试验(Western Blot)检测各项指标的蛋白水平
收集细胞悬液提取总蛋白。以Western Blot法分别通过电泳、转膜等操作后进行相关抗体孵育,包括CXCL10、CXCR3、Vimentin、Fibronectin、E-cad与β-actin等抗体的孵育,孵育完成洗膜后进行二抗孵育,通过显影仪拍照,将结果用ImageJ 软件分析。
1.3.4 免疫组化检测SW480 中E-cad 与Vimentin的变化情况
收集细胞悬液,离心后冲洗,固定细胞,封闭1 h。同时分别加入E-cad与Vimentin抗体(1∶200,CST)在4℃下培养SW480 细胞过夜,取出后冲洗2次,荧光二抗(1∶1 200,CST)继续培养2 h,染色结束后在荧光倒置显微镜下检测荧光强度表达。
1.3.5 划痕实验
将正常SW480 细胞及分别使用TNF-α 刺激与si-CXCR3 转染处理的SW480 细胞接种在6 孔板中培养,待过夜后在每组中间划3 道竖线,清洗2~3 次,去除划下的细胞,更换新鲜无血清的培养基继续培养,24 h 后在显微镜下观察细胞迁移率。
1.3.6 侵袭实验
将Transwell 小室的上室中加入无血清的DMEM 培养基并培养1 h 使膜层亲水,随后弃去培养基,上室加入细胞下室加入培养基,于培养箱中放置过夜。次日分别对下室细胞进行固定与染色,室温放置5 min 后显微镜下观察各组细胞迁移数量。
1.4 统计学处理
采用SPSS 22.0 统计软件进行数据分析;计量资料以()表示,两组间采用t检验,多组之间比较采用方差分析;以P<0.05 为差异有统计学意义。
2 结果
2.1 RT-PCR 检测相关mRNA 水平
TNF-ɑ 组 细胞中通 路基因CXCL10、CXCR3的mRNA 水平高于NC 组,差异有统计学意义(t1=3.174,t2=11.253,P<0.05);TNF-α+si-CXCR3 组细胞中CXCR3水平低于TNF-α 组,差异有统计学意义(t=6.528,P<0.05)。见图1。

图1 各组细胞中CXCL10 与CXCR3 的mRNA 水平Figure 1 The mRNA levels of CXCL10 and CXCR3 in each group
2.2 Western Blot 检测相关蛋白水平
Western Blot 结果所示,TNF-ɑ 组细胞 中CXCL10(t=4.157)、CXCR3(t=5.380)、Vimentin(t=4.414)与Fibronectin(t=9.625)的蛋白表达量高于NC 组,E-cad 的蛋白表达量低于NC 组(t=3.677),差异有统计学意义(P<0.05);TNF-α+si-CXCR3组细胞CXCR3(t=12.571)、Vimentin(t=8.018)与Fibronectin(t=7.906)的蛋白表达量低于TNF-ɑ 组,E-cad(t=3.152)的蛋白水平高于TNF-ɑ 组,差异有统计学意义(P均<0.05)。见图2。
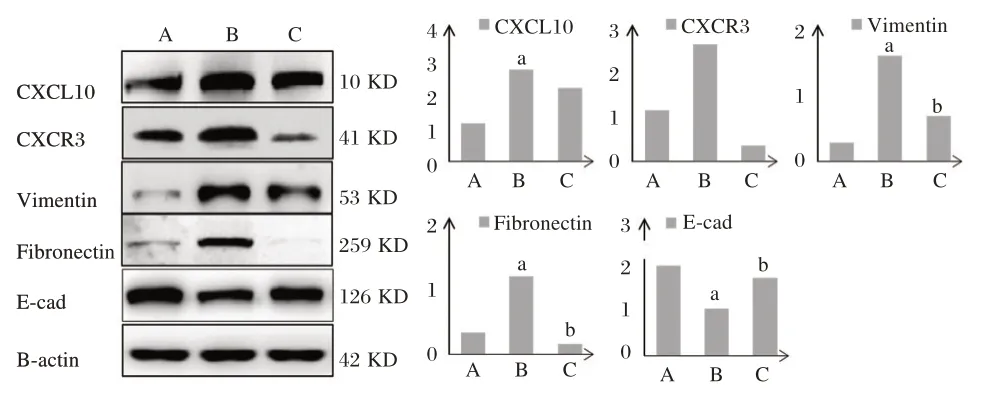
图2 各组细胞中CXCL10、CXCR3、Vimentin、Fibronectin及E-cad 的蛋白水平Figure 2 The protein levels of CXCL10,CXCR3,Vimentin,Fibronectin and E-cad in each group
2.3 免疫荧光检测SW480中E-cad与Vimentin水平
免疫荧光结果显示,TNF-ɑ 组中Vimentin的表达量高于NC 组,差异有统计学意义(t=10.152,P<0.05),E-cad的表达量低于NC 组,差异有统计学意义(t=5.619,P<0.05);TNF-α+si-CXCR3 组中Vimentin的表达量低于TNF-ɑ 组,差异有统计学意义(t=8.105,P<0.05),E-cad的表达量高于TNF-ɑ 组,差异有统计学意义(t=5.447,P<0.05)。见图3。
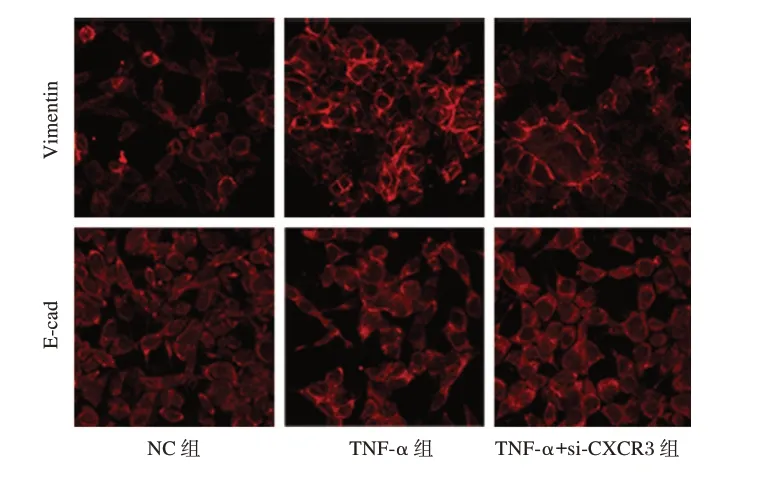
图3 免疫荧光检测各组细胞中E-cad 与Vimentin 水平(DAPI,200×)Figure 3 The levels of E-cad and Vimentin in each group were detected by immunofluorescence(DAPI,200×)
2.4 划痕实验与TransWell 实验检测细胞迁移及侵袭能力
TNF-ɑ 组细胞的迁移数量高于NC 组,其迁移能力显著增加,差异有统计学意义(t=4.690,P<0.05),TNF-α+si-CXCR3 组细胞迁移数量低于TNF-ɑ 组,其迁移能力显著降低,差异有统计学意义(t=5.560,P<0.05),见表2 与图4。TNF-ɑ 组细胞的侵袭能力高于NC 组,差异有统计学意义(t=9.143,P<0.05),TNF-α+si-CXCR3 组细胞侵袭能力低于TNF-ɑ 组,差异有统计学意义(t=6.717,P<0.05)。见表2、图5。

图4 划痕实验检测各组细胞迁移水平(10×)Figure 4 The cell migration level of each group was detected by Wound healing assay(10×)
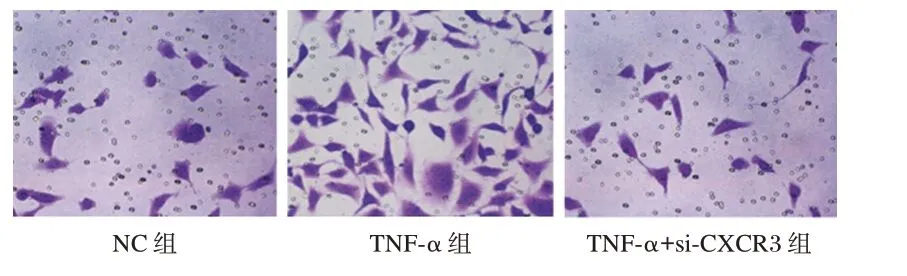
图5 TransWell 实验检测各组细胞侵袭水平(结晶紫,200×)Figure 5 The cell invasion level of each group was detected by Transwell assay(crystal violet,200×)

表2 干预后SW480 侵袭和迁移细胞数比较Table 2 Comparison of SW480 invasion and migration cells after intervention
3 讨论
在我国,结肠癌是发病人群数量仅次于肺癌和乳腺癌的恶性肿瘤,在全世界其死亡率处于前三,是需要特殊关注的严重公共卫生疾病。多项研究表明,结肠癌患者的预后不良的主要因素是癌细胞迁移与局部复发,特别是进展期肿瘤的转移,使得结肠癌的治疗难以取得突破[6]。在之前的研究中,肿瘤转移的发生因素主要包括生长因子、血管生成因子、细胞粘附机制异常、细胞运动机制异常、细胞降解机制异常以及细胞凋亡异常等[7],随着研究的不断深入,EMT 也逐渐被视为肿瘤转移发生的重要因素[8]。研究报道称,当接收外来刺激或机体自身病理状态改变的条件下,上皮细胞发生EMT后会丧失极性,细胞之间粘附性减弱,失去上皮指标如钙粘蛋白E-cad,向着间质样细胞转化,间质标志指标如纤维连接蛋白Fibronectin与波形蛋白Vimentin表达上调[9],其迁移力和侵袭力得到增强,具有了细胞转移侵袭的潜能。但是关于EMT 与肿瘤转移特别是与结肠癌转移间的分子机制尚不明确。
在肿瘤微环境中,趋化因子与相应受体组成的复杂网络可通过对免疫监视的破坏和逃逸促进肿瘤的发生发展,从而影响肿瘤的发生发展。但值得注意的是,这种对肿瘤转移能力的促进作用的获得和维持需要来自肿瘤微环境的持续刺激信号,其中生长因子和炎症因子是的主要原因,炎症介质如TGF-β 和IL-6 已被报道有助于癌细胞的转移和侵袭[10]。TNF-α 是肿瘤相关炎症的关键介导因子,可引起多种趋化因子的产生,研究表明长期慢性低剂量的TNF-α 刺激能够导致肿瘤患者预后不良及发生激素耐受,且已被证明可诱导肿瘤发生EMT[11]。在本研究结果提示TNF-α 刺激能够诱导SW480 细胞发生EMT 与提高其迁移与侵袭能力。
CXCL10与CXCL3属于CXC 类趋化因子。趋化因子是细胞因子家族中的分泌型小分子蛋白质,具有化学趋化作用。在与其受体结合后,使靶细胞趋化性迁移和细胞骨架的重排的同时,还能增强靶细胞与内皮细胞黏附能力[12],在恶性肿瘤发生发展中起到控制肿瘤细胞运动、调节肿瘤相关的血管生成、刺激肿瘤细胞增殖、控制白细胞浸润至肿瘤、激活宿主对肿瘤的特异性免疫应答等作用。CXCL10是由免疫细胞分泌的促炎细胞因子,能够通过旁分泌和自分泌信号与其唯一配体CXCR3相互作用,介导免疫细胞趋化、分化和激活[13]。另一方面,CXCL10已被证明通过自分泌通路刺激肿瘤生长和转移。CXCR3是一个包含7 个跨膜结构域的GTP-蛋白偶连的跨膜受体,通过与配体特异性结合,可产生次级信号并激活多个下游通路,随后介导肿瘤的形成,以及肿瘤细胞的增殖、凋亡、侵袭和转移[14]。临床资料显示,CXCR3在卵巢癌、肝癌及结肠癌等多种恶性肿瘤中表达增加[15]。
综上所述,研究发现TNF-α 刺激能够诱导SW480 细胞发生EMT 与提高其迁移与侵袭能力,其机制可能与上调CXCR10/CXCL3信号通路有关,本研究为结肠癌的治疗提供了一个新的思路。
