外周血CTC、PD-L1 及S100A6BP 水平对胃癌患者诊断及预后价值
2024-04-07徐毅唐岩李冬扬
徐毅 唐岩 李冬扬
胃癌是原发于胃黏膜上皮细胞的常见消化系统恶性肿瘤,流行病学调查显示,2020 年胃癌发病率及死亡率高居全球癌症第5 位及第4 位,中国胃癌发病率及死亡率高于全球平均水平[1]。胃癌早期临床症状不具有典型性,大部分患者确诊是已经处于中晚期,往往出现深度浸润、淋巴管转移、腹腔种植等远处转移,错过最佳治疗时间而导致患者预后不良[2],胃癌早期诊断及治疗对提高患者生存率至关重要。目前临床以胃镜活检作为临床诊断胃癌的金标准,但该方法具有创伤性,部分患者耐受性较低,更方便、准确的辅助诊断方法是国内外关注的持续关注的重点。循环肿瘤细胞(circulating tumor cell,CTC),是由肿瘤病灶脱落进入血液循环的肿瘤细胞,是引起肿瘤复发及转移的重要因素。程序性死亡因子配体-1(Programmed deathligand-1,PD-L1)是下调患者免疫功能的关键分子,在肿瘤免疫逃逸机制中发挥重要作用。钙周期素结合蛋白(calcyclin binding protein,S100A6BP)是一种多配体蛋白,通过与不同因子相互参与细胞骨架重组、增殖、分化以及蛋白质泛素化等过程[3]。本研究探讨外周血CTC、PD-L1 及S100A6BP 水平在胃癌患者诊断及预后预测中的应用价值,具体报道如下。
1 材料与方法
1.1 一般资料
选取南阳市第一人民医院在2020 年5 月至2022 年5 月收治的182 例胃癌患者为观察组,其中男98 例,女94 例,年龄平均(48.34±4.97)岁。根据TNM 胃癌肿瘤分期[4]:Ⅰ期38 例,Ⅱ期41 例,Ⅲ期77 例,Ⅳ期26 例;根据组织学分化程度[5]:低分化98 例,中高分化84 例。选取同期90 名健康志愿者作为对照组,其中男47 例,女43 例,年龄平均(47.78±4.35)岁。两组一般资料比较差异无统计学意义(P>0.05)。
纳入标准:①符合《胃癌规范化诊疗指南》中胃癌相关诊断标准[6],经组织病理学、影像学、生物标志物检测等综合临床诊断确诊为胃癌患者;②未接受手术、放化疗、免疫治疗等其他相关抗癌治疗;③首次确诊为胃癌,无合并其他癌症;④临床资料完整,患者及家属知情并签署知情同意书。排除标准:①合并严重的心脑血管疾病,重要器官功能障碍;②自身免疫性疾病、严重的感染性疾病、多发肿瘤;③术中或术后淋巴结组织样本检测提示阳性或证实存在远处转移;④精神障碍、认知功能异常者。本研究经本院伦理委员会审批通过。
1.2 方法
PD-L1、S100A6BP 检测方法:采用酶联免疫吸附法检测。两组受试者清晨空腹采集外周静脉血5 mL,以离心半径10 cm,转速3 500 r/min,离心10 min 后取上清液。PD-L1 试剂盒购自赛默飞世尔科技公司,货号:BMS2327;S100A6BP 试剂盒购自美国Novus 公司,货号:NBP2-74962。
CTC 检测方法:两组受试者清晨采集外周静脉血5 mL,加入样本密度分离液(可荣生物有限公司,货号:KMQ0141)以离心半径15 cm,转速1 500 r/min,离心15 min,取单核细胞层,并采用微流控芯片分离技术富集肿瘤细胞,将富集所得细胞涂片在载玻片上,加入CD45 白细胞探针、CK 上皮型RNA 探针及DAPI 细胞核染液进行免疫荧光染色,采用荧光显微镜进行观察。CTC 阳性标准[7]:免疫荧光检测DAPI 染色明亮,出现核偏位、巨大核仁或异常核分裂,核质比>0.8,CK(+)、CD45(-),则判读为CTC。统计CTC 阳性率并根据五点取样法对荧光显微镜视野下CTC进行计数。
对胃癌患者进行为期1 年随访调查,根据实体瘤疗效评价标准[8]分为预后良好组(疾病缓解,病情稳定,无复发、转移或死亡)及预后不良组(疾病进展,死亡)
1.3 统计学方法
采用SPSS 23.0 对数据进行统计分析。计量资料以()表示,两组比较用t检验,多组间比较采用单因素方差分析;计数资料用n(%)表示,行χ2检验,多因素使用Logistic 回归分析,并采用受试者工作特征(ROC)曲线分析外周血CTC、PD-L1及S100A6BP 水平及三者联合检测在胃癌患者预后预测效能。P<0.05 为差异有统计学意义。
2 结果
2.1 两组CTC、PD-L1 及S100A6BP 水平比较
观察组CTC、PD-L1 及S100A6BP 水平均高于对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组CTC、PD-L1 及S100A6BP 水平比较()Table 1 Comparison of CTC,PD-L1 and S100A6BP levels between the two groups()

表1 两组CTC、PD-L1 及S100A6BP 水平比较()Table 1 Comparison of CTC,PD-L1 and S100A6BP levels between the two groups()
2.2 CTC、PD-L1 及S100A6BP 水平对胃癌患者的诊断效能分析
CTC、PD-L1 及S100A6BP 三者联合检测灵敏度为94.35%,特异度为95.79%,均较单一检测高(P<0.05)。见表2。

表2 CTC、PD-L1 及S100A6BP 水平对胃癌患者的诊断效能分析Table 2 Diagnostic efficacy analysis of CTC,PD-L1 and S100A6BP levels in patients with gastric cancer
2.3 影响胃癌患者预后单因素分析
182 例胃癌患者中,预后良好者124 例,预后不良者58 例。预后良好者肿瘤直径、TNM(Ⅲ~Ⅳ)、中高分化、淋巴结转移、浸润深度(T3-T4)、CTC、PD-L1 及S100A6BP 水平均较预后不良组低,TNM(Ⅰ~Ⅱ)、低度分化、浸润深度(T1-T2)水平较预后不良组高(P<0.05)。见表3。
表3 影响胃癌患者预后单因素分析[(),n(%)]Table 3 Analysis of single factors affecting prognosis of patients with gastric cancer[(),n(%)]
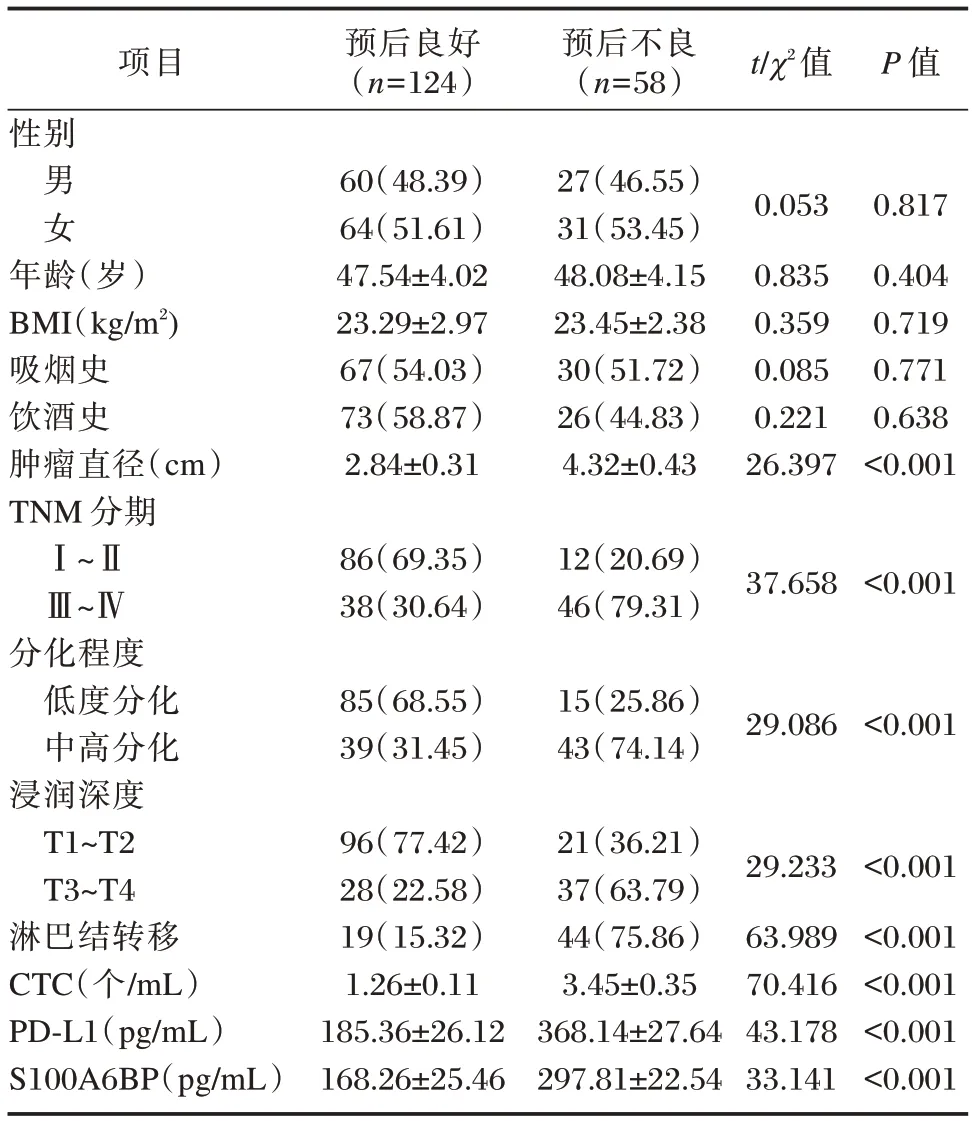
表3 影响胃癌患者预后单因素分析[(),n(%)]Table 3 Analysis of single factors affecting prognosis of patients with gastric cancer[(),n(%)]
2.4 影响胃癌患者预后Logistic 多因素分析
多因素Logistic 回归分析显示,肿瘤直径、TNM 分期、分化程度、浸润深度、淋巴结转移、CTC、PD-L1、S100A6BP 是影响胃癌预后不良的独立危险因素(P<0.05)。见表4。

表4 影响胃癌患者预后Logistic 多因素分析Table 4 Logistic analysis of multiple factors affecting prognosis of patients with gastric cancer
2.5 CTC、PD-L1 及S100A6BP 水平单一及联合检测对胃癌患者预后预测效能
CTC、PD-L1 及S100A6BP 联合检测特异度、灵敏度较单一检测高,CTC、PD-L1、S100A6BP 单一及联合检测AUC 分别为0.808、0.845、0.874、0.955(P<0.05)。见表5、图1。
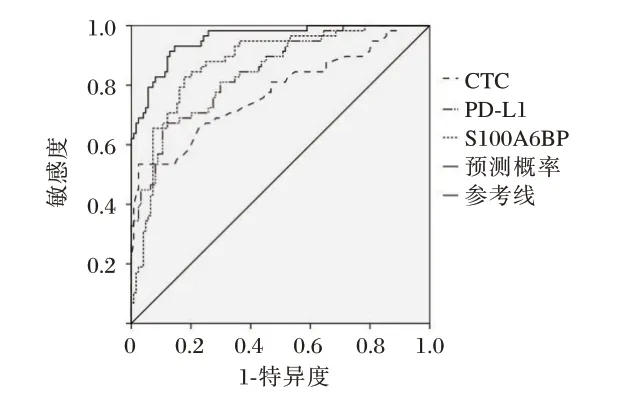
图1 CTC、PD-L1 及S100A6BP 水平单一及联合检测对胃癌患者预后预测效能Figure 1 Predictive efficacy of single and combined detection of CTC,PD-L1 and S100A6BP in patients with gastric cancer
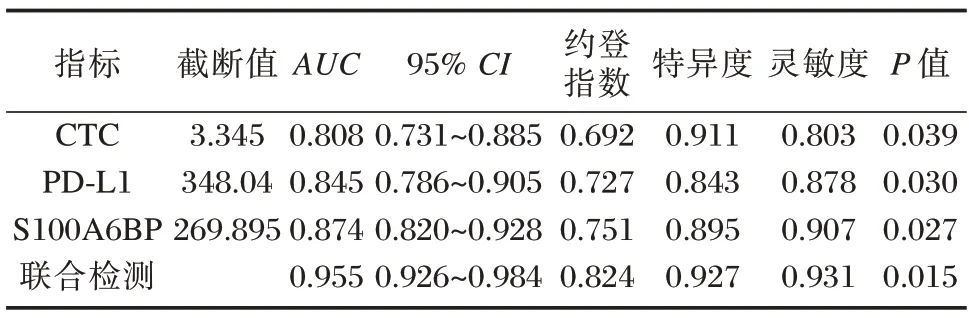
表5 CTC、PD-L1 及S100A6BP 水平单一及联合检测对胃癌患者预后预测效能Table 5 Prognostic efficacy of single and combined detection of CTC,PD-L1 and S100A6BP in patients with gastric cancer
3 讨论
胃癌是由多种因素引起常见消化系统恶性肿瘤,家族史、不良的生活习惯、幽门螺杆菌、EB 病毒感染等均会增加胃癌的发生率。目前临床治疗胃癌的主要方法包括手术切除、辅助化疗、免疫治疗、靶向治疗等,但临床上胃癌的死亡率高、预后较差。对胃癌早期的识别及诊断、分析影响其预后的因素、提高患者生存情况一直是临床探索研究的重要内容[9]。液体活检代表了一种新兴肿瘤监测方法,通过检测微小残留量来获得肿瘤的分子信息,包括CTC、循环肿瘤DNA、外泌体、非编码RNA、蛋白质及细胞因子等,对疾病进行识别和诊断,识别治疗靶点、评估肿瘤耐药性、预测治疗反应,在肿瘤早期诊断、用药指导与耐药机制探索、治疗效果的实时监测,预后预测及风险分级中发挥了巨大的价值[10]。
外周血是液体活检广泛应用的生物体液样本,本研究结果显示,胃癌患者外周血CTC、PD-L1及S100A6BP 水平均较健康受试者高。正常胃粘膜上皮细胞排列紧密、移动性较差,极少出现外周血的远处转移,且由于免疫系统的攻击、高剪切应激及氧化应激,CTC 难以在脉管系统中生存[11]。胃癌患者细胞形态和迁移能力改变,发生上皮间质转化,通过侵袭转移进入血液循环,成为CTC,肿瘤微循环环境中转化生长因子β 表达量增加,诱导凝血功能增强,使CTC 周围形成血小板微凝块,从而保护CTC 免受脉管系统中的高剪切应力,使胃癌患者微循环中CTC 含量增加。因此胃癌患者外周血CTC 水平升高,与Kang 等研究结论相符[12]。PD-L1 是肿瘤免疫逃逸机制的中的关键因子,在肿瘤的发生和发展中起重要作用。PD-L1 通过下调转录因子BATF 表达,抑制效用T 细胞分化,并造成T 细胞胞质磷酸化,抑制T 细胞功能。PD-L1T 细胞上的受体程序性死亡因子-1(PD-1)相互作用,抑制T 细胞功能及肿瘤浸润相关淋巴细胞的增值和活化,抑制机体免疫应答。胃癌细胞过表达PD-L1,并且由于免疫逃逸机制不会被T 细胞清除,导致外周血PD-L1 水平升高。与马晓玲等研究结果相符[13]。S100A6BP 是S100A6 蛋白家族的成员之一,最初是从埃利希腹水肿瘤细胞中分离出来。S100A6BP 参与细胞分化,应激反应以及细胞骨架动力学,S100A6BP 在胃癌的发生和发展中研究较少,但其主要功能与细胞增殖及肿瘤发生有关[14]。S100A6BP 表达上调受肿瘤坏死因子、胃泌素等细胞因子影响,胃癌患者机体处于炎症及应激状态下促进S100A6BP 表达增加。与孟猛等研究结果相符[15]。因此胃癌患者外周血CTC、PD-L1 及S100A6BP 水平呈高表达状态,对胃癌的诊断具有重要意义。CTC、PD-L1 及S100A6BP 在癌细胞的迁移和侵袭中发挥关键作用,与胃癌的远处迁移和病情发展相关。胃癌中S100A6BP 的过表达与肿瘤较大、浸润更深有关,是肿瘤化疗疗效的预测生物标志物[16]。可以反应胃癌的严重程度,与胃癌预后不良有关。PD-1/PD-L1 信号通路可以调节肿瘤细胞的增殖、凋亡、迁移和侵袭,是主要的免疫检查点之一。PD-L1 表达升高预示着治疗预后不佳,而通过阻断PD-1/PD-L1 信号通路,下调PD-L1 水平可以增强T 细胞介导的免疫应答系统,抑制癌细胞的增殖、迁移、侵袭,改善胃癌患者预后[17]。CTC 作为转移性生长的标志物,是胃癌迁移和复发的关键因素。CTC 上皮间质转化过程可以激活Akt 和P13k 信号通路,抑制细胞凋亡,促进肿瘤的侵袭和转移。因此外周血CTC 水平升高是胃癌转移的重要预测因素。
综上所述,外周血CTC、PD-L1 及S100A6BP水平在胃癌的发生、发展的起到关键作用,通过对CTC、PD-L1、S100A6BP 的监测可以对胃癌的诊断、个体化治疗及预后判断和风险评估具有重要意义。
