卡瑞利珠单抗联合nab-PC方案对晚期驱动基因阴性NSCLC的疗效及免疫功能的影响
2024-04-03马丹丹吴圆圆陈婧潘岩曹江威郭超李润浦
马丹丹, 吴圆圆, 陈婧, 潘岩, 曹江威, 郭超, 李润浦
保定市第二中心医院肿瘤科(河北保定 072750)
肺癌是呼吸系统常见的恶性肿瘤,发病率和病死率均居于全球恶性肿瘤前列,其中非小细胞肺癌(NSCLC)在所有肺癌患者中约占到85%,且多数患者就诊时病情已处于晚期阶段[1]。对于晚期NSCLC既往主要采取的治疗方法为化疗,尽管化疗能在一定程度上抑制肿瘤进展,但整体疗效有限[2]。近年来,随着靶向药物和免疫药物的应用,晚期NSCLC的治疗有了更多选择。对驱动基因阳性的晚期NSCLC患者采用靶向治疗可有效延长其生存期,改善患者预后,但对驱动基因阴性的患者而言,并不能从靶向治疗中获益[3]。根据2020年原发性肺癌诊疗指南,对驱动基因阴性的晚期NSCLC,可选择以铂类为基础的双药化疗进行一线治疗,并可在此基础上联合免疫检查点抑制剂(ICIs)治疗,以改善患者生存质量,延长生存期[4]。在化疗方案的选择上,白蛋白结合型紫杉醇+铂类方案是一种相对新型的化疗方案,与普通紫杉醇+铂类方案相比,抗肿瘤疗效更好,且神经毒性等毒性不良反应更少,目前被广泛应用于各种恶性肿瘤的治疗中[5]。卡瑞利珠单抗是我国自主研发的人源化抗程序性死亡受体1(PD-1)单克隆抗体,可通过与PD-1受体结合,对PD-1/程序性死亡受体-配体1(PD-L1)通路进行阻断,从而使机体抗肿瘤免疫力得以恢复[6]。为进一步探讨驱动基因阴性的晚期NSCLC更佳的治疗方案,本研究对我院近年来收治的此类患者给予了卡瑞利珠单抗联合白蛋白结合型紫杉醇+卡铂方案(nab-PC方案)进行治疗,并与单用nab-PC方案治疗作对照。现报告如下。
1 资料与方法
1.1 一般资料 回顾性分析我院2020年6月至2022年6月收治的110例晚期驱动基因阴性NSCLC患者,按随机数字表法分成观察组55例和对照组55例。观察组男31例,女24例;年龄34~79岁,平均(60.14±15.25)岁;美国东部肿瘤协作组(ECOG)体力状况评分:0分18例,1分23例,2分14例;病理类型:腺癌30例,鳞癌20例,其他5例;TNM分期(第8版):ⅢC期27例,Ⅳ期28例;吸烟史30例,饮酒史12例。对照组男35例,女20例;年龄36~80岁,平均(58.95±14.54)岁;ECOG体力状况评分:0分23例,1分21例,2分11例;病理类型:腺癌34例,鳞癌18例,其他3例;TNM分期(第8版):ⅢC期30例,Ⅳ期25例;吸烟史34例,饮酒史10例。两组基线资料对比差异无统计学意义(P>0.05),具有可比性。研究经医院医学伦理委员会批准。
1.2 纳入与排除标准 纳入标准:(1)符合《中华医学会肺癌临床诊疗指南(2019版)》[7]中NSCLC的诊断标准,经细胞学、组织病理学检查等确诊为ⅢC~Ⅳ期NSCLC;(2)表皮生长因子受体(EGFR)/c-ros原癌基因1酪氨酸激酶(ROS1)/间变性淋巴瘤激酶(ALK)/鼠类肉瘤病毒癌基因(KRAS)等驱动基因检测均为阴性;(3)至少存在1处影像学可测量靶病灶;(4)ECOG体力状况评分0~2分;(5)预计生存期≥3个月;(6)年龄18~80岁;(7)血常规、肝肾功能基本正常;(8)对该研究内容知情,签署知情同意书;(9)无卡瑞利珠单抗使用禁忌证。
排除标准:(1)存在其他部位原发恶性肿瘤;(2)伴有严重基础性疾病;(3)合并精神障碍,不能正常沟通;(4)存在先天或后天免疫功能缺陷;(5)伴有严重急慢性感染;(6)合并严重贫血或凝血功能障碍;(7)伴有严重心、脑等重要脏器功能不全;(8)对紫杉醇、铂类药物等试验所用药物过敏;(9)妊娠期女性;(10)有症状的脑转移或症状控制时间<2个月的脑转移。
1.3 方法 对照组采用nab-PC方案治疗,具体是注射用紫杉醇(白蛋白结合型)(江苏恒瑞医药,规格100 mg/瓶,国药准字H20183378)130 mg/m2静脉滴注,时间30 min,d1、d8;卡铂注射液(齐鲁制药,规格10 mL:100 mg,国药准字H20020180)按血药浓度-时间曲线下面积(AUC)=6 mg/(mL·min)静脉滴注,d1;以3周为1个治疗周期。观察组在对照组基础上联合注射用卡瑞利珠单抗(苏州盛迪亚生物医药,规格200 mg/瓶,国药准字S20190027)治疗,具体为200 mg静脉滴注,d1。观察组在卡瑞利珠单抗静脉滴注完毕后30 min再行化疗。连续治疗4个周期后评价两组疗效。
1.4 观察指标 (1)近期疗效:参照文献[8]于4个治疗周期结束后评价近期疗效。完全缓解(CR):靶病灶完全消失;部分缓解(PR):靶病灶直径之和缩小≥30%;疾病进展(PD):靶病灶直径之和的最小值增加≥20%且绝对值增加≥5 mm,或有新病灶出现;疾病稳定(SD):介于PR、PD之间。客观缓解率(ORR)=(CR+PR)/总例数×100%。疾病控制率(DCR)=(CR+PR+SD)/总例数×100%。(2)肿瘤标志物:治疗前后采集研究对象空腹静脉血9 mL,其中3 mL室温静置60 min后,以3 000 r/min转速离心15 min,离心半径10 cm,分离血清,分装后-80℃冻存备检。选用化学发光免疫分析仪(美国雅培公司,i2000SR型),以化学发光免疫法(试剂盒均由深圳迈瑞生物提供)检测血清癌胚抗原(CEA)、细胞角蛋白19片段抗原21-1(CYFRA21-1)、鳞状细胞癌抗原(SCC-Ag)水平,操作均按说明书。(3)外周血调节性T细胞(Treg)、辅助性T细胞(Th)17及树突状细胞亚群表达水平:取余下6 mL静脉血制备外周血单个核细胞,洗涤后以RPMI 1640培养液调整细胞浓度至2×106·mL-1,使用流式细胞仪(美国BD公司,FACSCalibur型)检测外周血Treg、Th17、髓样树突状细胞(mDC)、浆样树突状细胞(pDC)比例,并计算Treg/Th17比值和mDC/pDC比值。(4)毒性不良反应:定期检查试验对象心电图、血尿常规、肝肾功能等指标,统计两组毒性不良反应发生情况。

2 结果
2.1 两组近期疗效比较 观察组ORR、DCR分别为45.45%、89.09%,对照组分别为27.27%、74.55%;观察组ORR、DCR均显著高于对照组(P<0.05)。见表1。

表1 两组近期疗效比较 例
2.2 两组血清肿瘤标志物水平比较 治疗后,两组血清CEA、CYFRA21-1、SCC-Ag水平均较治疗前显著降低(P<0.05),均以观察组下降更显著(P<0.05)。见表2。
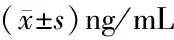
表2 两组血清肿瘤标志物水平比较
2.3 两组外周血Treg、Th17表达水平比较 治疗后,两组外周血Treg、Th17比例和Treg/Th17比值均较治疗前显著降低(P<0.05),均以观察组为著(P<0.05)。见表3。
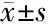
表3 两组外周血Treg、Th17表达水平比较
2.4 两组外周血树突状细胞亚群水平比较 治疗后,两组外周血mDC比例、mDC/pDC比值均较治疗前显著升高(P<0.05),均以观察组上升更显著(P<0.05)。治疗后,观察组外周血pDC比例较治疗前显著降低(P<0.05);对照组治疗前后则无明显变化(P>0.05)。见表4。
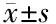
表4 两组外周血树突状细胞亚群水平比较
2.5 两组毒性不良反应比较 两组治疗过程中均出现了不同程度的中性粒细胞减少、血小板减少、贫血、恶心呕吐等毒性不良反应,但均以1~2级为主。其中观察组皮肤毛细血管增生症发生率为63.64%,显著高于对照组(P<0.05)。两组其余各项毒性不良反应发生率比较差异均无统计学意义(P>0.05)。见表5。
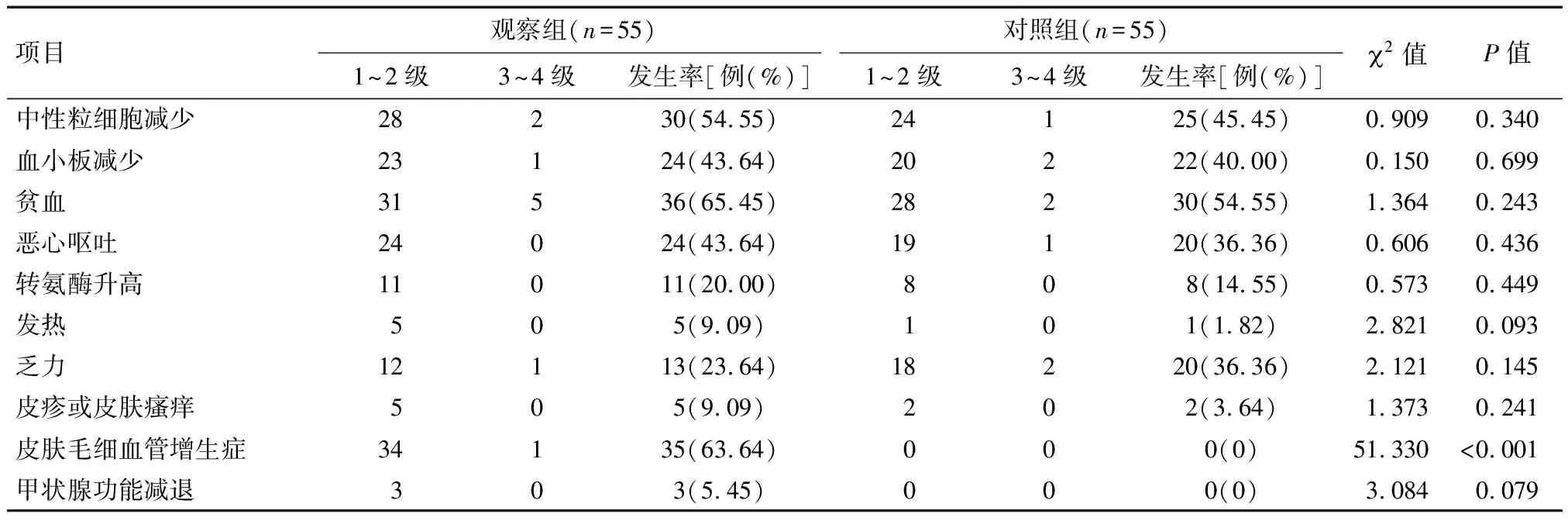
表5 两组毒性不良反应比较 例
3 讨论
肿瘤驱动基因可诱导恶性肿瘤的发生和发展,近年来随着对肿瘤相关驱动基因研究的深入,针对NSCLC的分子靶向治疗成为重要的治疗手段。目前发现的与肺癌相关的主要驱动基因包括EGFR、ROS1、ALK等,对驱动基因阳性的肺癌患者可根据突变的基因类型选择相应的靶向药物治疗,个性化靶向治疗成为指南推荐的治疗驱动基因突变的晚期NSCLC的一线选择[9]。但对驱动基因阴性的肺癌患者而言,靶向治疗并不能使其获益,化疗仍是其最主要的治疗手段。含铂类双药化疗是驱动基因阴性的晚期NSCLC的一线治疗方案,在化疗方案的选择上,本研究选用的是nab-PC方案。其中卡铂是临床常用的第2代铂类化疗药物,可通过与脱氧核糖核酸(DNA)结合形成交叉链,诱导DNA链内与链间交联,从而阻断DNA的复制与转录,促使肿瘤细胞凋亡。白蛋白结合型紫杉醇是一种新型紫杉醇制剂,是应用白蛋白纳米技术制成的靶向化疗药物。传统溶剂型紫杉醇由于水溶性很差,需添加聚氧乙烯蓖麻油与无水乙醇进行助溶,因而毒性较高,安全性较差。而白蛋白结合型紫杉醇以人血白蛋白作为药物载体,毒性较低,具有肿瘤内蓄积多、靶向性强等优点,与传统紫杉醇相比,抗肿瘤效果好且安全性高[10]。然而尽管如此,单用nab-PC方案治疗驱动基因阴性的晚期NSCLC的疗效仍旧有限。本研究中,单用nab-PC方案治疗后ORR、DCR仅为27.27%、74.55%。仅通过化疗延长驱动基因阴性的晚期NSCLC患者的生存期很难取得突破性进展,如何改善这类患者的预后是目前临床关注的热点和难点。
近年来,随着肿瘤分子检测技术的持续发展,免疫治疗成为临床研究的热点,各种免疫检查点抑制剂(ICIs)逐渐被应用于恶性肿瘤的治疗中。有报道显示[11-13],ICIs的出现延长了晚期NSCLC的生存期,其5年生存率由不到5%提升至26%。目前可用于治疗晚期NSCLC的ICIs有PD-1/PD-L1抑制剂、抗淋巴细胞激活基因-3抗体、细胞毒性T淋巴细胞相关抗原4抑制剂等,其中应用最为广泛的是PD-1/PD-L1抑制剂。T细胞表面的特异性受体PD-1可与癌细胞表面的PD-L1结合,向T细胞释放负向调控信号,造成T细胞无法识别恶性肿瘤细胞,使其出现免疫逃逸。PD-1/PD-L1抑制剂可通过阻断PD-1/PD-L1通路,恢复T细胞活性,增强免疫应答,起到杀灭肿瘤细胞、抑制肿瘤细胞增殖和转移的作用。Wu等[14]报道显示,纳武利尤单抗能有效提高既往含铂化疗失败的驱动基因阴性的复发或Ⅲb期和Ⅳ期NSCLC患者的ORR,延长总生存期,改善患者预后。同时陈嘉劼等[15]对含铂化疗进展的驱动基因阴性的晚期NSCLC患者采用帕博利珠单抗二线治疗后DCR显著提高,中位无进展生存期明显延长。可见,对于驱动基因阴性的晚期NSCLC患者可从PD-1/PD-L1抑制剂中明显收益。目前PD-1/PD-L1抑制剂已成为驱动基因阴性的晚期NSCLC患者的有效选择[16]。卡瑞利珠单抗是我国自主研发的PD-1抑制剂,可通过与多种免疫细胞表面的PD-1靶向结合,解除PD-1通路对于T细胞的抑制作用,恢复机体免疫功能,进而发挥抗肿瘤作用。研究显示[17],卡瑞利珠单抗的半数抑制浓度与半数效应浓度分别是0.70 nmol/L、0.38 nmol/L,和帕博利珠单抗近似,与其他PD-1单抗相比显著降低,因此药效更强。吕颖等[18]研究显示,在吉西他滨+卡铂方案化疗基础上同步卡瑞利珠单抗免疫治疗能有效提高驱动基因阴性非鳞NSCLC脑转移患者的近期疗效,改善患者的生存质量,且不良反应可耐受。
本研究结果显示,观察组ORR、DCR分别为45.45%、89.09%,均显著高于对照组的27.27%、74.55%。提示在nab-PC方案基础上联合卡瑞利珠单抗治疗能有效提高晚期驱动基因阴性NSCLC患者的近期疗效。究其原因可能在于卡瑞利珠单抗能有效阻断PD-1/PD-L1通路,影响肿瘤免疫微环境,恢复机体的抗肿瘤免疫力,与nab-PC方案联合使用可起到协同增效的作用。此外本研究中,两组患者治疗后血清CEA、CYFRA21-1、SCC-Ag水平均较治疗前显著降低,且均以观察组下降更明显。表明卡瑞利珠单抗联合nab-PC方案能更有效地下调肺癌相关血清肿瘤标志物水平,抑制病情进展,从而有利于改善晚期驱动基因阴性NSCLC患者预后。另外,在毒性不良反应方面,本研究结果显示,两组患者治疗过程中均出现了中性粒细胞减少、血小板减少、贫血、恶心呕吐、转氨酶升高、乏力等,但毒性不良反应均以1~2级多见,3~4级仅为少数。观察组较对照组而言,除了皮肤毛细血管增生症外,其余各项毒性不良反应发生率比较均无明显差异。提示晚期驱动基因阴性NSCLC患者在卡瑞利珠单抗治疗过程中容易出现皮肤毛细血管增生症,但≥3级的严重皮肤毛细血管增生症很少见,仅出现1例。可见,在nab-PC方案基础上联合卡瑞利珠单抗治疗晚期驱动基因阴性NSCLC并不会明显增加患者严重毒性不良反应的发生,安全性和患者耐受性相对较好。
研究[19]表明,NSCLC的发生、发展和免疫功能密切相关,免疫功能低下是导致NSCLC转移、复发的重要原因。CD4+T淋巴细胞是人体免疫系统中重要的免疫细胞,在特定细胞因子的诱导下初始CD4+T细胞可进一步分化为Th1、Th2、Th17、Treg等不同功能亚群。其中Treg、Th17是近年来新发现的两种T细胞亚群,二者在功能上相互影响、相互制衡,正常情况下机体内Treg、Th17亚群保持着动态平衡,共同维持着机体的免疫稳态。Treg/Th17免疫平衡一旦被打破即可引起一系列自身免疫性疾病的发生。研究[20]证实,NSCLC患者机体内存在Treg/Th17免疫失衡,呈现Treg、Th17细胞比例升高,但以Treg细胞更为明显,进而导致机体免疫耐受增强,呈现出有利于肿瘤侵袭、转移的免疫微环境。刘爱民[21]的研究表明,NSCLC患者外周血Treg、Th17表达水平以及Treg/Th17比值均较健康人群显著升高,且进展期NSCLC患者外周血Treg表达水平、Treg/Th17比值均显著高于局限期患者。本研究结果显示,两组患者治疗后外周血Treg、Th17比例和Treg/Th17比值均较治疗前显著降低,且均以观察组下降更明显。提示在nab-PC方案基础上联合卡瑞利珠单抗治疗能更有效地调节晚期驱动基因阴性NSCLC患者机体免疫稳态,纠正外周血Treg/Th17免疫失衡,从而利于抑制肿瘤细胞增殖和转移。树突状细胞是一种抗原呈递细胞,在肿瘤患者中,其可将肿瘤细胞相关信息呈递给细胞毒性T细胞,从而对肿瘤细胞起到杀伤作用。然而肿瘤患者体内存在树突状细胞数量减少和功能缺陷,是造成肿瘤免疫逃逸的另一重要机制。树突状细胞根据其表面标记与功能可进一步分成mDC和pDC两大亚群,其中mDC可引发Th1免疫应答,参与抗肿瘤免疫,而pDC可激活Th2免疫应答,参与免疫耐受。本研究中,两组治疗后外周血mDC比例、mDC/pDC比值均较治疗前显著升高,且均以观察组上升更明显,且观察组治疗后外周血pDC比例较治疗前显著降低,而对照组治疗前后则无明显变化。可见,卡瑞利珠单抗联合nab-PC方案能更有效地调节晚期驱动基因阴性NSCLC患者外周血树突状细胞亚群水平,减轻其功能缺陷,从而有利于杀灭肿瘤细胞,延缓病情进展。
综上所述,与单用nab-PC方案相比,在nab-PC方案基础上联合卡瑞利珠单抗治疗能有效提高晚期驱动基因阴性NSCLC的近期疗效,降低血清相关肿瘤标志物水平,其作用可能与该联合治疗方案能更有效地调节外周血Treg/Th17失衡以及树突状细胞亚群水平有关。同时该联合方案并未明显增加患者严重毒性不良反应的发生,整体来讲安全性和耐受性较好,值得临床推广应用。
利益相关声明:本研究所有作者均无利益冲突。
作者贡献说明:马丹丹、吴圆圆负责收集数据,病例分析,撰写论文;陈婧、潘岩负责统计学分析;曹江威、郭超负责文献搜集,病例管理;李润浦负责审核论文。
