雄黄对宫颈癌细胞增殖、凋亡及对HPVE6/IL-6/STAT3通路的影响
2024-04-03冯苗苗李锦英邓高丕
冯苗苗, 李锦英, 邓高丕△
1广州中医药大学第一附属医院妇科(广东广州 510405); 2普宁市中医医院妇科(广东揭阳 515343)
根据2020年全球癌症统计,宫颈癌是全球女性的第四大常见癌症,位于乳腺癌、结直肠癌和肺癌之后,其中85%的病例来自于发展中国家,并且在发展中国家作为第二大常见癌症[1]。早期和局部晚期宫颈癌患者的5年生存率分别是93%和65%,而对于转移性和复发性宫颈癌,5年生存率仅为17%[2]。目前,对于复发和转移性宫颈癌患者的治疗主要通过全身化疗获得受益,临床上常用的血管生成抑制剂、免疫检查点抑制剂虽然在一定程度上提高了总生存率,但这些抑制剂仍需要在顺铂基础上联合治疗[2]。由于铂耐药的产生,尤其在晚期或复发性宫颈癌患者中,1年生存率只有10%~20%[3],因此仍然需要不断开发新的药物来提高宫颈癌治疗的有效性。研究发现天然中药具有多靶点、多途径治疗肿瘤的特点,近些年来,从天然中药中寻找抗癌药物受到了越来越多研究者的关注[4]。雄黄在我国传统医学中有悠久的历史,其主要成分为二硫化二砷(As2S2)或四硫化四砷(As4S4),现代医学研究发现雄黄具有明显的抗肿瘤作用[5]。体外实验证实了雄黄具有抑制宫颈癌细胞生长及促进凋亡的作用[6],但其治疗宫颈癌的具体作用机制尚不清楚。大量研究表明IL-6/STAT3信号通路在宫颈癌的发生和发展中起着重要的作用[7],基于此,2021年1月至2022年12月,本研究拟探讨雄黄调控IL-6/STAT3信号轴影响宫颈癌细胞HeLa和Caski增殖与凋亡,为明确雄黄抗宫颈癌作用机制提供一定的理论基础。
1 材料与方法
1.1 材料
1.1.1 实验细胞 人宫颈癌细胞HeLa、Caski细胞购自北纳生物。
1.1.2 药品与试剂 雄黄干粉(编号211001)购自三门峡玉皇山制药有限公司;CCK8试剂盒购自碧云天生物技术公司;Annexvin V APC/PI双染试剂盒购自中国Elabscience公司;p-STAT3抗体购自美国CST公司;STAT3抗体购自英国Abcam公司;辣根酶标记的山羊抗兔购自美国Proteintech公司;RNA提取试剂盒购自日本TaKaRa公司;cDNA合成试剂盒购自美国Thermo Fisher Scientific公司;ECL试剂盒购自美国Millipore公司;GAPDH购自武汉三鹰生物技术有限公司;RPMI1640购自(北京)赛默飞世尔生物化学制品有限公司。
1.1.3 仪器 LX-100手掌型离心肌(江苏海门其林贝尔仪器制造有限公司);Applied Biosystems Step One qPCR仪(美国ABI公司);Direct-Pure UF纯水系统(上海乐枫生物科技有限公司);电泳仪(北京市六一仪器厂);GL-3250A磁力搅拌器(江苏海门其林贝尔仪器制造有限公司);Novocyte D2060R流式细胞仪(Agilent)[艾森生物(杭州)有限公司];酶标仪(华东电子)。Mini-PROTEAN 3 Cell(美国Bio-Rad公司);Mini Trans-Blot Electrophoretic Transfer Cell(美国Bio-Rad公司);YXQ-LS-30SII型立式压力蒸汽灭菌器(上海博讯实业有限公司医疗设备厂)。
1.2 方法
1.2.1 药物制备 称取100 mg雄黄溶于4 mL无菌水中,配制成25 mg/mL的雄黄溶液(母液),分别吸取1、2、3、4 μL母液于每毫升培养液中,根据既往研究[8],分别制备出25、50、75、100 mg/L雄黄培养液。
1.2.2 细胞培养 HeLa、Caski细胞培养于含10%胎牛血清的RPMI1640培养液中,并置于5%CO2、37℃培养箱中,当细胞生长汇合度达到80%时进行传代,选择对数生长期细胞进行干预。
1.2.3 CCK8检测细胞活力 取对数生长期的HeLa和Caski细胞,以每孔细胞接种1×104个到96孔板中,在培养箱中培养过夜,次日,将细胞分别设置为对照组和不同浓度的雄黄组(25、50、75、100 μg/mL),每组设置3个复孔,加入不同浓度雄黄后继续培养24 h,培养结束后,每孔加入含10 μL的CCK-8试剂孵育2 h,用酶标仪测定各组450 nm波长处OD值。
1.2.4 细胞凋亡实验 各组细胞用胰酶消化,离心收集细胞,加入2 mL Binding Buffer,离心收集细胞,去上清。加入100 μL Stain Buffer重悬细胞,加入5 μL Annexin V APC和5 μL PI溶液,室温孵育15 min。加入100 μL Stain Buffer,通过流式细胞仪检测。Q1为坏死细胞,Q2为晚期凋亡细胞,Q3为正常细胞,Q4为早期凋亡细胞,细胞凋亡率=Q2+Q4。
1.2.5 Western blot实验 加入RIPA裂解液冰上裂解细胞,取上清液测蛋白浓度,加入Loading buffer,加热使蛋白变性,低温保存备用。蛋白上样量为15 μg,采用12%SDS-PAGE凝胶电泳,电泳结束后对蛋白进行湿性转膜,TBST清洗PVDF膜,加入5%脱脂奶粉的PBS,室温封闭1 h。一抗(GAPDH稀释比例1∶2 000,STAT3稀释比例1∶1 000,p-STAT3稀释比例1∶2 000)室温结合1 h,分别TBST洗3次,每次10 min,二抗(GAPDH稀释比例1∶10 000,STAT3稀释比例1∶4 000,p-STAT3稀释比例1∶4 000)室温孵育1 h,TBST洗3次,每次10 min。显影,曝光5 min,拍照。计算各蛋白和GAPDH条带的灰度值。
1.2.6 qPCR实验检测 采用Trizol法分别提取各组中总RNA,依据RNA浓度,逆转录合成cDNA,以cDNA为模板,在ABI Step One QPCR仪上进行反应,以GAPDH为内参物,引物由生工生物工程(上海)股份有限公司合成。反应条件:预变性94 ℃ 5 min,变性94 ℃ 15 s,退火60 ℃ 1 min,共40个循环。以GAPDH为内掺,采用2-ΔΔCt法计算相对表达量。引物序列见表1。
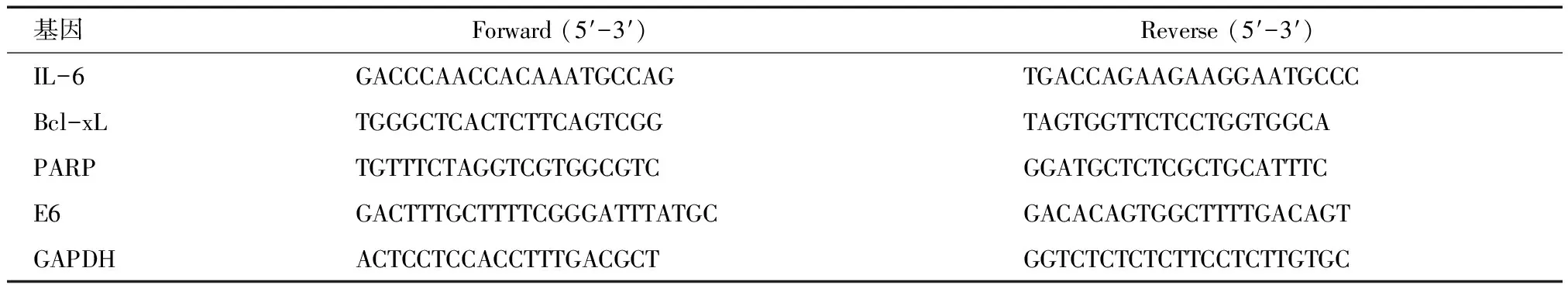
表1 PCR引物序列
1.3 统计学方法 使用SPSS 26.0和GraphPad Prism 5统计软件。数据以均数±标准差表示,采用t检验及单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 雄黄溶液对HeLa、Caski细胞增殖的影响 CCK8实验显示,与对照组相比,不同浓度的雄黄组(25、50、75、100 μg/mL)分别作用于HeLa和Caski细胞24 h后,随着浓度的增加,宫颈癌细胞增殖抑制率显著增加,且呈剂量依赖性,差异有统计学意义(P<0.05),见图1。
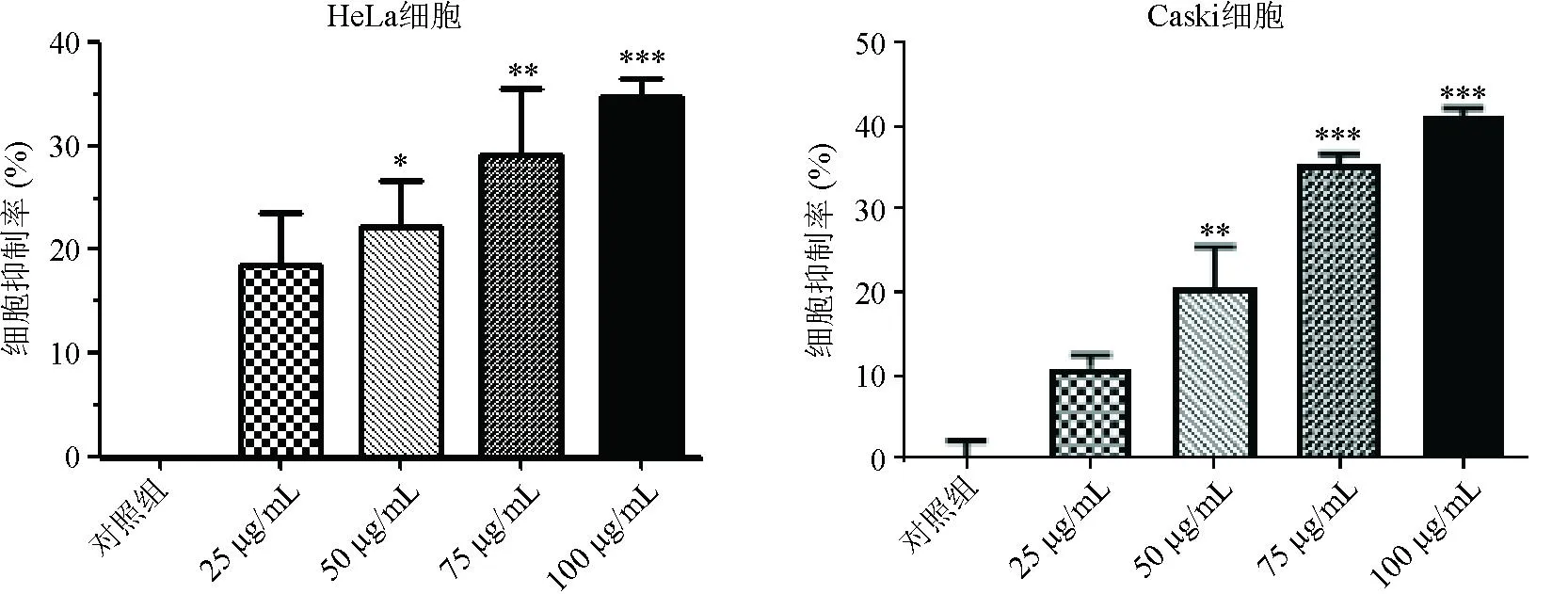
注:与对照组比较,*P<0.05,**P<0.01,***P<0.001
2.2 雄黄溶液对HeLa、Caski细胞凋亡的影响 流式细胞实验结果提示,与对照组相比,雄黄组(25、50、75、100 μg/mL)分别作用于HeLa和Caski细胞24 h后,宫颈癌细胞凋亡率随着浓度增加而增加,见图2、3。
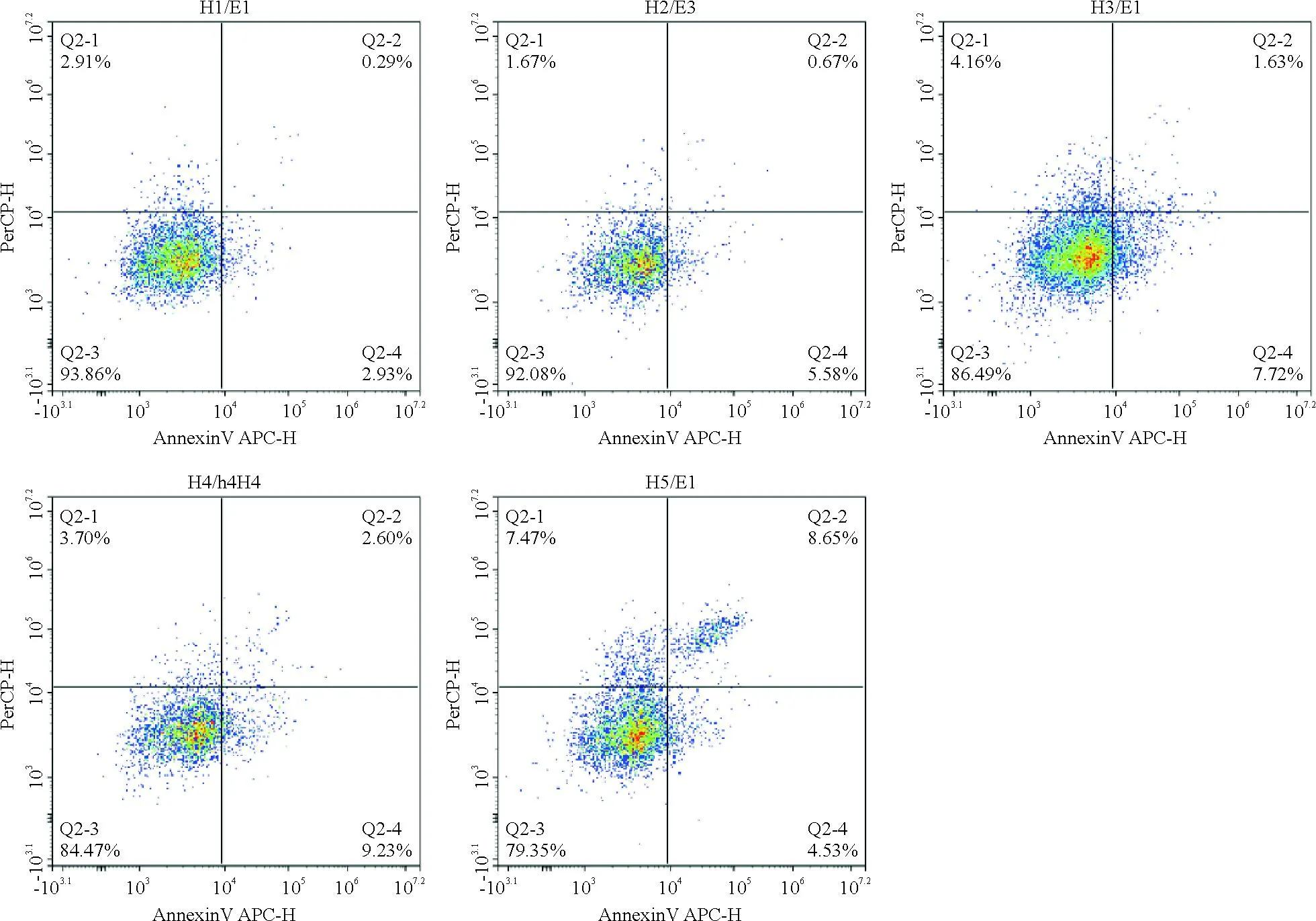
注:H1:对照组;H2:25 μg/mL;H3:50 μg/mL;H4:75 μg/mL;H5:100 μg/mL
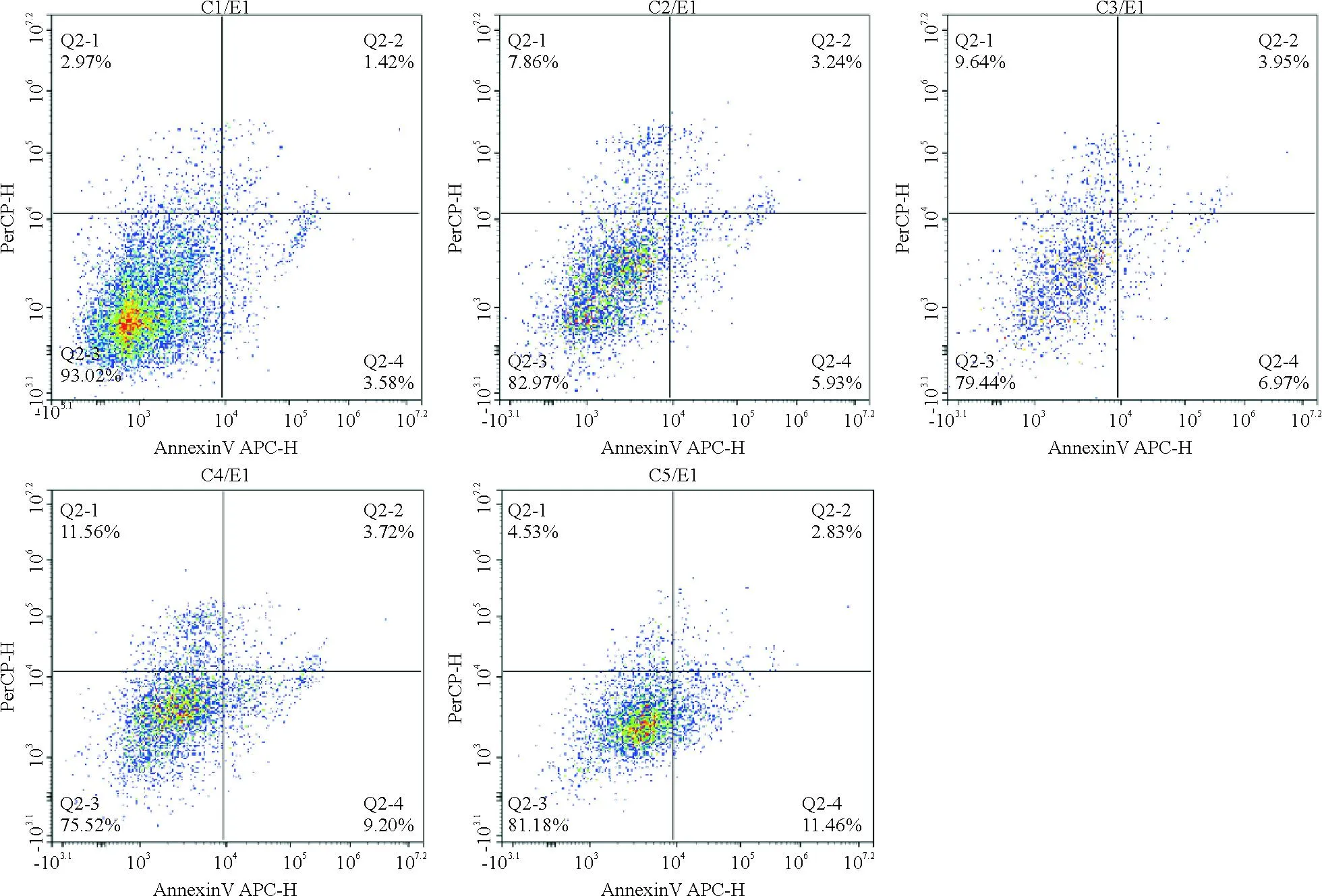
注:C1:对照组;C2:25 μg/mL;C3:50 μg/mL;C4:75 μg/mL;C5:100 μg/mL
2.3 雄黄抑制STAT3蛋白的激活 Western blot实验显示,与对照组相比,不同浓度的雄黄组(25、50、75、100 μg/mL)分别作用于HeLa(图4A)和Caski(图4B)细胞24 h后, STAT3和p-STAT3蛋白表达均在两种细胞中明显下降(P<0.01),且呈剂量依赖性,见图4、表2。

注:A:宫颈癌HeLa细胞;B:宫颈癌Caski细胞;与对照组比较,*P<0.01, **P<0.001
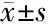
表2 宫颈癌HeLa和Caski细胞各组中STAT3、P-STAT3蛋白的表达量
2.4 雄黄对IL6、PARP、E6、Bcl-xL mRNA表达的影响 qPCR实验显示,与对照组相比,不同浓度的雄黄组(25、50、75、100 μg/mL)作用于HeLa和Caski细胞24 h后,均能够显著下调两种细胞中E6和 IL-6 mRNA的表达,同时凋亡相关基因PARP和Bcl-xL也随着降低,且呈剂量依赖性(P<0.01),见图5、表3。提示雄黄可能通过抑制HPVE6癌蛋白来抑制IL-6/STAT3通路激活,诱导宫颈癌细胞凋亡。

注:A:宫颈癌HeLa细胞;B:宫颈癌Caski细胞;与对照组比较,*P<0.05,**P<0.01,***P<0.001
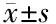
表3 宫颈癌HeLa和Caski细胞各组中IL-6、PARP、E6、Bcl-xL mRNA的表达量
3 讨论
随着恶性肿瘤发病率的逐年升高,中医学者针对恶性肿瘤提出了“癌毒”病机的概念,对于宫颈癌,各大医家认为其是由湿、瘀、热三毒夹杂、搏结所致的“癌毒”的形成。清热解毒、以毒攻毒是这一病机的治疗原则[9]。现代药理学研究表明,以毒攻毒治法是通过中药的细胞毒作用,抑制细胞生长,诱导细胞凋亡,调节及增强免疫功能等机制抗肿瘤[10],雄黄就是这种以毒攻毒类中药之一,因此其可能在寻找合适的临床抗肿瘤中药中提供一定的参考。
在现代,雄黄在白血病、肺癌、乳腺癌、肝癌、宫颈癌等研究中均存在一定的抗癌作用。雄黄能够抑制宫颈癌细胞增殖,促进细胞凋亡,尤其在Caski和HeLa细胞中产生G2/M期阻滞[8],近期研究发现纳米雄黄能够在体外抑制肺癌干细胞和小鼠肺癌移植瘤的生长[11],另一项研究发现纳米雄黄能够抑制小鼠乳腺癌移植瘤模型的侵袭和转移[12]。研究发现雄黄通过作用于Bcl-2/Bax/Cyt-C/AIF信号通路诱导急性早幼粒细胞白血病(APL)细胞死亡[13]。在我国,含有雄黄的典型抗癌药有六神丸和复方黄黛片,其中复方黄黛片联合全反式维甲酸是治疗APL的最佳理想方案[14]。
雄黄最早记载于《神农本草经》的中品:“雄黄生山之阳,故曰雄;是丹之雄,所以名雄黄也”。《名医别录》云:“雄黄生武都山谷、敦煌山之阳,采无时。”即雄黄出自山的阳处而禀受阳气。《神农本草经疏》曰:“雄黄禀火金之胜,得正阳之气以生。盖以阳明虚则邪恶易侵,阴气胜则精鬼易凭,得阳气之正者,能破幽暗,所以杀一切鬼邪,胜五兵也。”《金匮方歌括》:雄黄气重,能排邪而引正;雄黄味苦,能燥湿解毒。由此可知雄黄禀纯阳之气、苦之味、气重的特性。
《医宗必读》云:“积之成也,正气不足,而后邪气踞之。”宫颈癌发病病机归于正虚邪实。一则正气亏虚为本,患者由于先天禀赋不足,脏腑功能薄弱;又因后天房劳多产或饮食失调导致肾气亏损、脾胃受损,引起精血耗伤,气血生化匮乏,无以充养机体,最终正气亏虚,外邪侵入难御。二则以湿热瘀毒为标,临床表现为下焦宫颈癥瘕形成, 高危HPV持续感染是外来湿热之毒侵袭机体,客于胞门,“邪之所凑,其气必虚”,当正气亏虚,湿热之毒有机可乘,体虚无力驱邪,致瘀久成毒,最终形成癌毒。故对于宫颈癌应以扶正、清利湿热、解毒驱邪为治疗原则。通过古代医家对雄黄的记载,其禀纯阳之气、苦之味、气重的特点正是起到了扶正、祛除湿热瘀毒之邪的功效,由此推测这可能是雄黄治疗宫颈癌可行之处。
本研究结果显示,雄黄对宫颈癌HeLa和Caski细胞增殖具有抑制作用,对凋亡也有促进作用,且具有浓度依赖性。本研究还发现,雄黄下调了宫颈癌HeLa、Caski细胞中STAT3蛋白表达,并抑制其磷酸化水平。IL-6/STAT3信号通路常常在肿瘤中是高度激活的,与肿瘤的发生、发展、转移和侵袭等生物学行为密切相关[15]。炎症刺激下IL-6被过度分泌,导致JAK/STAT3信号通路的过度激活,激活的STAT3形成同源二聚体并作为转录因子进入细胞核中,与目标基因的特异性DNA反应元件结合,诱导调节细胞增殖、分化和凋亡的基因转录,另外肿瘤细胞中STAT3的过度激活又会诱导IL-6的产生。宫颈癌中STAT3呈组成型激活状态,且与宫颈癌发生、进展相关,在体内实验中发现shRNA敲低STAT3会导致小鼠高危型HPV阳性宫颈癌移植瘤生长减慢[16];还有研究发现高危型HPV阳性宫颈癌细胞中STAT3磷酸化水平比HPV阴性宫颈癌更高[3]。这两项研究提示高危型HPV与STAT3存在一定的关系,因为高危型HPV致癌机制主要由其编码的癌蛋白E6/E7驱动,而癌蛋白E6对IL-6/STAT3信号通路具有激活作用,激活的IL-6/STAT3又促进宫颈癌细胞的增殖,由此形成了正反馈作用[17]。本研究发现不同浓度的雄黄对E6和IL-6基因均具有抑制作用,且呈浓度依赖性,由此推测雄黄可能通过抑制HPVE6介导的IL6/STAT3发挥抗肿瘤作用,从而阻断了这一正反馈通路,诱导细胞凋亡。
Bcl-xL是抗凋亡Bcl-2蛋白家族的重要成员,是STAT3的关键转录靶点。Bcl-xL通过多种途径抵抗细胞凋亡。在线粒体中,Bcl-xL通过调节线粒体外膜的通透性来防止细胞凋亡。研究发现Bcl-xL可以促进静息G0期延长并延迟G0到S的转变,静止的细胞通常对细胞死亡更具抗性[18]。另外Bcl-xL通过易位到细胞核中来调节上皮-间质转化(EMT)相关基因,如基质金属蛋白酶-2和转化生长因子-β的表达促进癌细胞转移和侵袭,这一过程也协助了癌细胞逃避凋亡[19]。据报道,Bcl-xL还可以刺激癌细胞中活性氧簇(ROS)的产生,同时还可以保护细胞免受ROS毒性[20]。研究发现Bcl-xL比Bcl-2具有更强的抗凋亡作用,在乳腺癌细胞系中发现Bcl-xL抗凋亡作用是Bcl-2的10倍,这可能是因为Bcl-xL能够阻止不同细胞器导致的凋亡[21],也与Bcl-xL同时抑制Bax和Bar有关;显然Bcl-xL在癌细胞生存中是关键的调节因子。Bcl-xL作为IL-6/STAT的靶基因,雄黄处理宫颈癌细胞过程中也明显降低了该靶基因的表达,且随着浓度的升高,降低越显著。另外,PARP作为DNA损伤修复的关键分子,维持基因组的稳定性,PARP的明显下降也代表了细胞凋亡的发生,本研究中同样发现雄黄作用后PARP出现明显的下降。
综上所述,根据雄黄的中药特性和宫颈癌病机特点,推测雄黄对宫颈癌具有一定的抑制作用。本研究发现不同浓度的雄黄可能通过抑制HPVE6/IL6/STAT3信号通路,导致抗凋亡关键因子Bcl-xL和PARP表达下降从而抑制宫颈癌细胞的增殖,诱导细胞凋亡。
利益相关声明:所有作者均声明不存在任何利益冲突。
作者贡献说明:冯苗苗负责实验设计、论文撰写;李锦英负责实验和数据分析;邓高丕负责监督和指导。
