耐热型罗伊氏乳杆菌液态微胶囊的制备及其体外模拟消化特性
2024-04-03冯明星管军军崔耀明
冯明星,管军军,崔耀明
(河南工业大学生物工程学院,河南郑州 450000)
益生菌在维持肠道菌群和阻止致病微生物在肠道定植方面起着重要作用[1]。罗伊氏乳杆菌是一种存在于人和动物肠道中的重要益生菌,具有很强的肠黏附能力[2],能产生独特的抗菌物质罗伊氏菌素,抑制大肠杆菌、沙门氏菌等有害细菌的生长,维持肠道健康而不对正常菌群产生不良影响等[3]。近年来,罗伊氏乳杆菌应用于酸奶、豆奶、酸奶和冰淇淋,除此之外,罗伊氏乳杆菌还可以取代抗生素作为生物防腐剂,并被添加到饲料、乳制品和肉制品中[4],但是在生产、加工、储存、运输、销售、消费等过程中,受到温度、食品成分(高酸、高盐、添加剂等)和宿主的消化系统(胃酸、消化酶等)的影响[5],导致活菌数量下降。磷脂是一种天然的表面活性剂,具有亲水基团和亲油基团,可作为乳化剂稳定剂。麦芽糊精具有糊粘度高、溶解性好、增稠稳定性强等特性。研究表明[6-8],采用微胶囊包埋技术可显著提高菌体对不利环境的耐受力[8],增加菌体进入肠道内的存活数量。
目前益生菌微胶囊技术有喷雾干燥、冷冻干燥、乳化法等[9]。喷雾干燥法是一种通过热干燥介质使液体从液体形态转变为粉末颗粒,该过程在热气流的条件下会降低菌体的存活率;而冷冻干燥是指通过升华从冻结的生物产品中去掉水分或其他溶剂的过程,样品在冷冻过程中水分由于热胀冷缩会破坏菌体细胞,而且冷冻干燥技术耗时长成本高;乳化法是一种化学包埋方法,将益生菌和壁材料溶液混合搅拌形成稳定的水油乳液[10]。将益生菌进行微囊化,从而形成液体微胶囊。因为大多数益生菌通常是亲水性的该方法可以维持乳化液体系的平衡,从而提高微胶囊的包埋率,该方法工艺流程简单,便于工业化生产。由于加工的需要,对罗伊氏乳杆菌耐热性的研究很有必要,王巧丽等[11]和张巧玲[12]对罗伊氏乳杆菌在65 ℃处理2 h 活菌数为5×108CFU/mL 和75 ℃处理30 s 活菌数为3.54×109CFU/mL。对菌体存活的影响,目前通过微胶囊化提高其耐热性的研究尚不多见。
为了提高罗伊氏乳杆菌在更高温度加工的存活数量,本试验在前期研究的基础上[13],以磷脂和麦芽糊精作为耐热保护剂,制备罗伊氏乳杆菌液态微胶囊,探讨70~100 ℃对罗伊氏乳杆菌存活的影响,并研究罗伊氏乳杆菌液态微胶囊的包埋效果、电位、粒径、微观结构等,为罗伊斯乳杆菌微胶囊的生产应用提供理论依据。
1 材料与方法
1.1 主要材料与试剂
MT476913 罗伊氏乳杆菌,河南省工业微生物菌种保藏与繁育工程实验室(河南郑州);黄豆,郑州永辉公园茂超市采购;磷脂,郑州四维科技有限公司;金龙鱼大豆油,益海粮油工业有限公司;胃蛋白酶(10 000 NFU/mg),生工生物工程(上海)股份有限公司;脂肪酶(活性20 000 U/g),索莱宝生物科技有限公司;胰蛋白酶 (10 000 NFU/mg),生工生物工程(上海)股份有限公司。
1.2 主要设备
JJ-CJ-1FD 超净工作台,广州瑞丰实验设备有限公司;DSX-30L 手提式高压蒸汽灭菌器,上海申安医疗器械厂;JP-100A-2 高速离心机,永康市久品工贸有限公司;TGL-16B 离心机,上海安亭科学仪器厂;85-2 磁力搅拌器,河南智诚科技发展有限公司;NANOS90 纳米粒度仪,英国马尔文仪器有限公司;Zata 电位分析仪,英国马尔文仪器有限公司;SPX-250B 智能型生化培养箱,常州讯生仪器有限公司;BH200 生物显微镜,舜宇光学科技集团有限公司;722N 分光光度计,上海精科实业有限公司;HH-4 恒温水浴锅,河南智诚科技发展有限公司;SHB 循环水式多用真空泵,郑州长城科工贸有限公司。
1.3 方法
1.3.1 培养基
MRS 液体培养基:蛋白胨10 g、牛肉浸膏10 g、酵母浸膏5 g、葡萄糖20 g、乙酸钠5 g、吐温-80 1 mL、硫酸镁0.2 g、硫酸锰0.05 g、磷酸氢二钾2 g、C6H14N2O72 g。去离子水1 000 mL,用盐酸调节pH值为6.2~6.4,于121 ℃下高温灭菌20 min。
MRS 固体培养基:在MRS 液体培养基加入18 g琼脂,于121 ℃下高温灭菌20 min。
1.3.2 菌泥的制备
菌种活化,第一次活化,在100 mL MRS 液体培养基中加1 mL 菌种,37.0 ℃静置培养14 h;第二次活化,在100 mL MRS 液体培养基中加3 mL第一次活化菌液,37.0 ℃静置培养14 h。取4 mL第二次活化的菌液,接种到100 mL MRS 液体培养基中,37.0 ℃静置培养14 h,5 000 r/min 离心10 min收集沉淀得菌泥。
1.3.3 酶解大豆蛋白的制备
根据参考文献[14]稍有改进,操作如下:
大豆分离蛋白(Soybean Protein Isolate,SPI)的制备:大豆进行清理除去石子等杂物,粉碎过80 目筛,石油醚脱去脂肪,将脱脂大豆粉与蒸馏水1:10(m/m)进行混合,搅拌1 h,2 mol/L NaOH 调pH 值为8.0,50 ℃水浴1 h,5 000 r/min离心30 min,取上清液用2 mol/L HCl 调pH 值为4.8,4 ℃存放过夜,次日5 000 r/min 离心50 min,取出沉淀物用蒸馏水进行混合均匀,调pH 值为7.0,冷冻干燥后得SPI。
酶解大豆蛋白(Enzymatic Hydrolysate of Soybean Protein Isolate,ESP)的制备:配置质量分数3%的SPI 溶液,调pH 值为2.0 后37 ℃搅拌10 min,加入胃蛋白酶(酶与底物比1:100)进行酶解反应,保持pH 值恒定不变,2 h 后停止反应,调节pH 值为7.0 灭酶冷冻干燥后得酶解大豆蛋白。
1.3.4 模拟胃液与肠液的制备
根据参考文献[15]稍有改进,操作如下:
模拟胃液,称取10 g 氯化钠加蒸馏水溶解,用1.5 mol/L HCl 将pH 值调至1.5,转入500 mL 容量瓶中定容加入0.2 g 的胃蛋白酶,现用现配。
模拟肠液,称取6.8 g 的磷酸氢二钾加蒸馏水溶解,再加入8.57 g 胆汁,用1 mol/L NaOH 将pH值调至7.4,转入1 000 mL 容量瓶中定容加入2 g胰蛋白酶与2 g 脂肪酶,现用现配。
1.3.5 罗伊氏乳杆菌液态微胶囊的制备
取1 g菌泥与2 g酶解大豆蛋白放入平底烧瓶中,1 000 r/min 真空搅拌20 min。加入磷脂6 g 和10 g大豆油,再加入麦芽糊精溶液20 g 和1 g 甘油,真空(-0.1 MPa)搅拌90 min 后,得到罗伊氏乳杆菌液态微胶囊,于4 ℃冰箱中储存。
1.3.6 包埋率的测定
将罗伊氏乳杆菌微胶囊样品进行适当的稀释,然后进行菌落计数为N0,再将样品进行适当的稀释然后进行离心取下清液,平板计数法进行菌落计数为N。包埋率(ME)[16]:
式中:
A——包埋率,%;
N——离心下清液的菌落总数,CFU/mL;
N0——微胶囊样品的菌落总数,CFU/mL。
1.3.7 粒径、Zeta电位的测定
将罗伊氏乳杆菌液态微胶囊样品用蒸馏水稀释1 000 倍,取出1 mL 在25 ℃条件下,使用马尔文粒径测定仪与Zeta 电位测定仪,测定微胶囊的粒径与Zeta 电位。
1.3.8 乳化活性指数(EAI)与乳化稳定指数(ESI)测定
根据参考文献[17,18],罗伊氏乳杆菌液态微胶囊用0.10%十二烷基硫酸钠稀释1 000 倍数,以质量分数0.10%十二烷基硫酸钠为空白组调零,500 nm波长处测定,记录0 min 与30 min 时的吸光值,分别记为A0与A30。吸光度在0.2~0.8 之间。计算乳化稳定指数(End System Identifier,ESI)、乳化活性指数(Emulsification Activity,EAI):
式中:
B——乳化稳定指数(ESI),min;
A0——0 min 时的吸光度;
A30——30 min 时的吸光度。
式中:
C——乳化活性指数(EAI),m2/g;
T——常数2.303;
n——稀释倍数;
ρ——乳液蛋白质质量分数,5%;
φ——油质质量分数,%。
1.3.9 显微观察
罗伊氏乳杆菌液态微胶囊进行稀释10 倍,用光学显微镜观察,然后将样品涂布固定,革兰氏染色法进行染色,结晶紫染色1 min,碘液媒染1 min,体积分数95%的乙醇脱色30 s,沙皇复染1 min,并在16×40 和16×100(油镜)下拍照。
1.3.10 响应面优化设计
根据单因素试验结果,以磷脂含量g(A)、麦芽糊精浓度%(B)、乳化时间min(C)作为考察因素,每个因素三个水平(表1),以包埋率为响应值,采用三因素三水平进行响应面分析,建立二次多元回归方程,得到最佳工艺条件并进行3 次验证。

表1 因素与水平表Table 1 Single factors and horizontal table
1.3.11 耐热性试验
取1 g 罗伊氏乳杆菌液态微胶囊用蒸馏水稀释10倍,在70、85 和100 ℃下分别处理30、45 和60 s。通过梯度稀释平板法进行活菌计数,每个处理做3 个重复[19],以罗伊氏乳杆菌溶液作对照试验。
1.3.12 体外模拟消化试验
根据参考文献[20]稍有改动,按以下操作:
静态消化,模拟胃液和罗伊氏乳杆菌液态微胶囊加入三角瓶中,37 ℃水浴110 r/min 振荡2 h,每隔30 min 取样并立即测定相关指标。胃液取样完成后立即加入模拟肠液,肠液取样时间和方法与模拟胃液相同。同时进行对比实验。
动态消化,罗伊氏乳杆菌液态微胶囊加入三角瓶中,37 ℃水浴110 r/min 振荡2 h,将模拟胃液以25 mL/h 加入到三角瓶中,每隔30 min 取样并立即测定相关指标。胃液取样完成后,将模拟肠液以50 mL/h 加入到三角瓶中,每隔30 min 取样并立即测定相关指标。同时进行对比实验。
1.4 数据处理
数据采用SAS 9.0 软件进行方差分析、多重比较(Fisher,sLSD)和响应面优化(Box-Behnken)。每组试验重复3 次。
2 结果与讨论
2.1 罗伊氏乳杆菌液态微胶囊外观及显微观察
罗伊氏乳杆菌液态微胶囊由壁材磷脂、麦芽糊精等包埋罗伊氏乳杆菌而成,图1a 制备好的微胶囊为乳白色液体,稀释10 倍(图1b)为白色液体进行显微观察,40 倍镜下为大小均匀的球状(图1d),100 倍油镜下观察为菌体聚团(图1e)。说明液态微胶囊化对菌体进行了包裹,壁材在菌体外围形成一种屏障,使菌体与外界环境相隔离,增强了菌体的稳定性与活性。将制备好的微胶囊稀释一定的倍数(图1c)来测定相关指标。
2.2 磷脂对罗伊氏乳杆菌液态微胶囊的影响
磷脂是一种天然的表面活性剂,具有亲水基团和亲油基团,可作为乳化剂稳定剂、粘合剂和润滑剂[21]。微胶囊总体系40 g 中根据添加磷脂不同的质量,探究微胶囊的特性。结果如下,由图2 可知,随着磷脂浓度的增加乳化稳定性、乳化活性、包埋率变化显著,先增加后减少(P<0.05)。当磷脂含量为6 g 时,乳化稳定值、乳化活性值和包埋率都最大。随着磷脂含量的增加,该体系的乳化稳定性包埋率都在不断提高(P<0.05),e1比e2圆球密集且多,e3比e4菌体聚团大。当添加7 g 的磷脂时明显下降(P<0.05)。由于磷脂是一种乳化剂,体系中的蛋白与磷脂都是双亲,磷脂疏水基团和蛋白疏水基团能更好地包裹油滴,磷脂亲水基团和蛋白亲水基团更好地延展到水相中,从而形成乳液的稳定结构,降低水与油的界面张力[22],但当磷脂达到一定浓度时,蛋白质与磷脂的结合达到饱和,乳液的乳化性能趋于平缓,甚至降低了稳定性与李秋慧等[23]研究相符合,磷脂添加过量导致复合体系形成不同尺寸的乳滴,导致乳液滴分布不均匀,易迁移、流动等。随着磷脂含量的增加粒径先减小后增加,磷脂含量在3、5、7 g 时有两个主要峰,在4 g 时峰相对较矮且宽,而6 g 时峰高且窄,说明乳液滴分布相对比较均匀。

图3 麦芽糊精质量分数对罗伊氏乳杆菌液态微胶囊的影响ESI、EAI (a),包埋率和电位(b),平均粒径(c),粒径分布(d)以及显微观察(e1~e4)Fig.3 Effect of maltodextrin concentration on liquid microcapsules ESI and EAI (a), embedding rate and potential (b), average diameter (c), diameter distribution (d) and microscopic observation (e1~e4) of L. reuteri

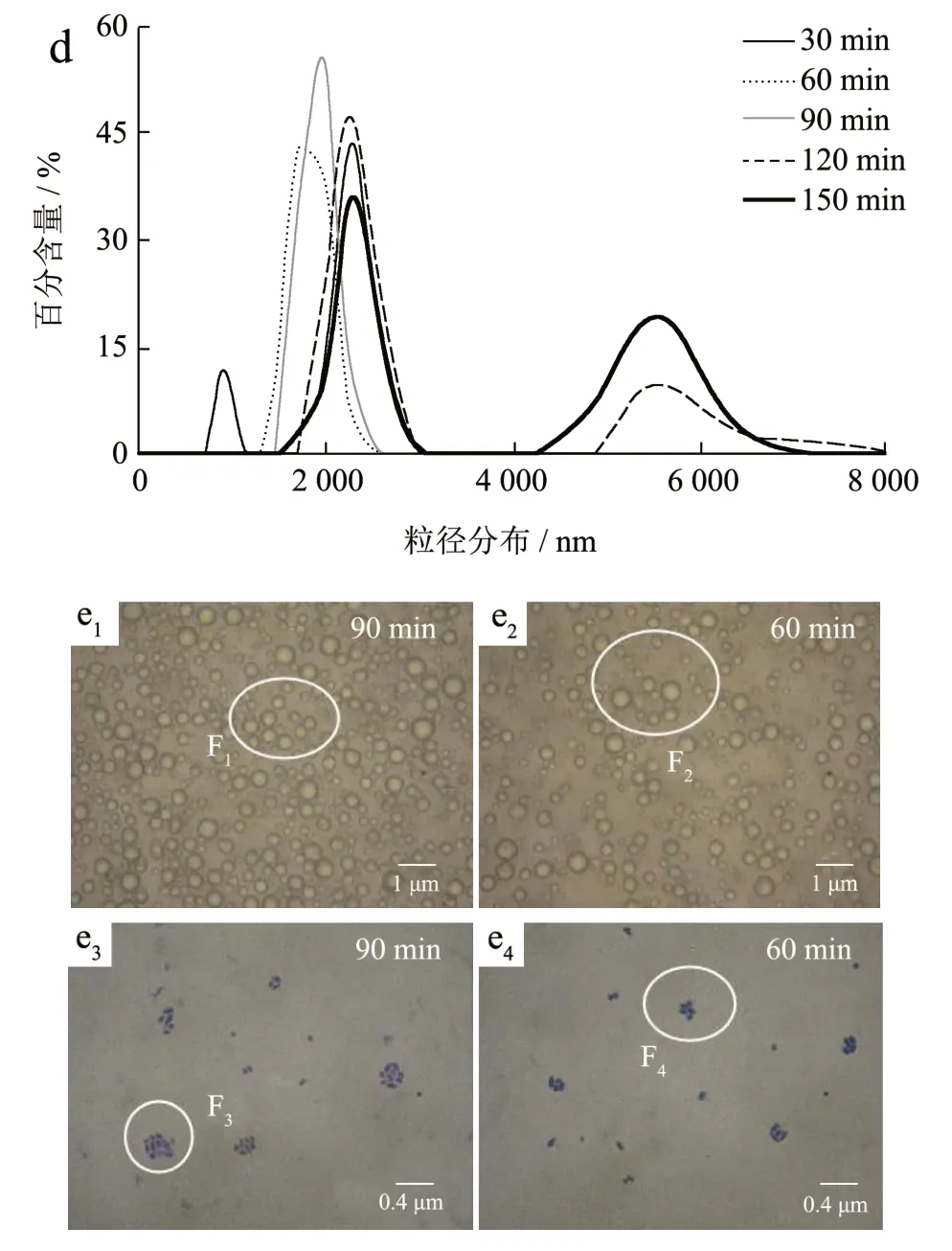
图4 乳化时间对罗伊氏乳杆菌液态微胶囊ESI 和EAI(a),包埋率和电位(b),平均粒径(c),粒径分布(d)以及显微观察(e1~e4)Fig.4 Effect of emulsification time on ESI and EAI (a),embedding rate and potential (b), average diameter (c),diameter distribution (d) and microscopic observation (e1~e4)of L. reuteri liquid microcapsules
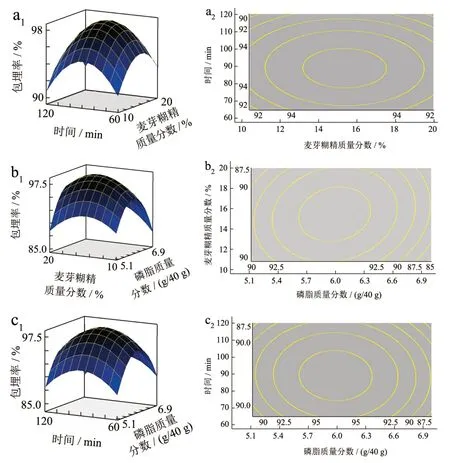
图5 乳化时间和麦芽糊精质量分数(a1、a2)、麦芽糊精质量分数和磷脂含量(b1、b2)、乳化时间和磷脂含量(c1、c2)对ME 影响的响应面图和高线图Fig.5 Response surface map and height map of the effect of emulsification time and maltodextrin concentration on ME (a1, a2),maltodextrin concentration and phospholipid content on ME (b1, b2),emulsification time and phospholipid content on ME (c1, c2)
2.3 麦芽糊精质量分数对罗伊氏乳杆菌液态微胶囊的影响
麦芽糊精是食品微胶囊的天然优良壁材之一,已应用于不同的食品领域,如包埋功能油、风味物质、益生菌等[24],有很好的乳化效果和良好的成膜性,易被人体吸收,也特别适合作为病人和婴儿食品的基本原料[25]。随着麦芽糊精质量分数的增加,EAI 和ESI 都随着麦芽糊精质量分数的增加先增大后减小(P<0.05),当麦芽糊精质量分数达到15%时,EAI 和ESI 值最大。包埋率随着麦芽糊精质量分数的增加先增大后减小(P<0.05),当麦芽糊精质量分数到达15%时包埋率最高;e1比e2圆球密集且多,e3比e4菌体聚团。麦芽糊精是很好的乳化剂和包埋剂壁材,随着质量分数的增加乳化作用增强更好的与油相相融合,所以大幅度的提高了包埋效果;当麦芽糊精质量分数到达20%和25%时,可能是麦芽糊精与乳化剂磷脂有很强的相互作用,影响了微胶囊的稳定性从而影响了包埋效果[26]。电位随着麦芽糊精质量分数的增加其绝对值先减少后增大(P<0.05),麦芽糊精质量分数为15%时其绝对值最大。麦芽糊精质量分数在5% 和10% 时粒径是没有显著差异的(P<0.05),当麦芽糊精质量分数到达15%时粒径减小(P<0.05),之后随着质量分数的增加粒径逐渐增大(P<0.05);5%和10%质量分数下的平均粒径分布峰窄而且低,20%和25%质量分数下的峰都有两个峰低并且峰比较宽宽,说明包被不均匀;15%质量分数的峰最高有一个峰并且峰窄,说明麦芽糊精质量分数在15%时,微胶囊乳液滴分布比较均匀。
2.4 乳化时间对罗伊氏乳杆菌液态微胶囊的影响
随着乳化时间的增加EAI 和ESI 先逐渐上升(P<0.05),当乳化时间到达90 min 时达到最大,当乳化时间再增加时EAI 和ESI 没有明显的变化(P<0.05)。包埋率随着乳化时间的增加先增大后减小(P<0.05),乳化时间在30~90 min 到达逐渐增大90 min 时包埋率最大,其原因是随着乳化时间的逐渐增加,磷脂的亲水性和亲油性基团不断与油相和水相结合,包埋率逐渐增加,乳液在短时间内混合不够均匀并且乳化不够完全,乳液没有完全处于真空状态,液滴内存在大量空气,导致部分菌体没有包埋进去包埋不够紧密,乳化不完全也可能影响了麦芽糊精的成膜效果所以包埋率低;当乳化时间超过90 min 时包埋率下降(P<0.05),图e1比图e2球体密集且多,图e3比图e4菌体聚团大,可能由于长时间的磁力搅拌,破坏了包埋体系打破了麦芽糊精与乳化剂磷脂的相互作用,降低了乳液的稳定性造成乳液破乳,乳液中的游离菌体增加从而降低了包埋率[27]。粒径随着乳化时间的增加先减小后增大,30 min 的平均粒径图峰窄且矮,60 min 的图峰比90 min 和150 min 的峰高且峰比较宽,120 min 的峰有两个峰说明乳液粒径分布不均匀,然而90 min 的峰又尖又窄说明乳液分布比较均匀。
2.5 响应面试验结果
建立的二次多元回归方程为:Y=-206.58+90.35A+0.83C-7.63A2-0.01C2回归模型方差分析结果见表2,可知Pr>F=0.04<0.05,表明所建立的二次回归模型显著;失拟项P=0.19>0.05,失拟项不显著,表明所建立的回归方程拟合较好。计算得到,磷脂的最佳质量分数为14.83%,麦芽糊精质量分数为15%乳化时间为86.39 min 的条件下,罗伊氏乳杆菌微胶囊包埋率为99.03%。3 次验证试验的平均包埋率为99.11%,可用于罗伊氏乳杆菌微胶囊的制备。得罗伊氏乳杆菌微胶囊的制备配方:菌泥1 g,5%(m/m)酶解大豆蛋白2 g,磷脂5.93 g,大豆油10 g,15%(m/m)麦芽糊精20 g,甘油1 g。

表2 响应面分析设计及结果Table 2 Response surface analysis design and results
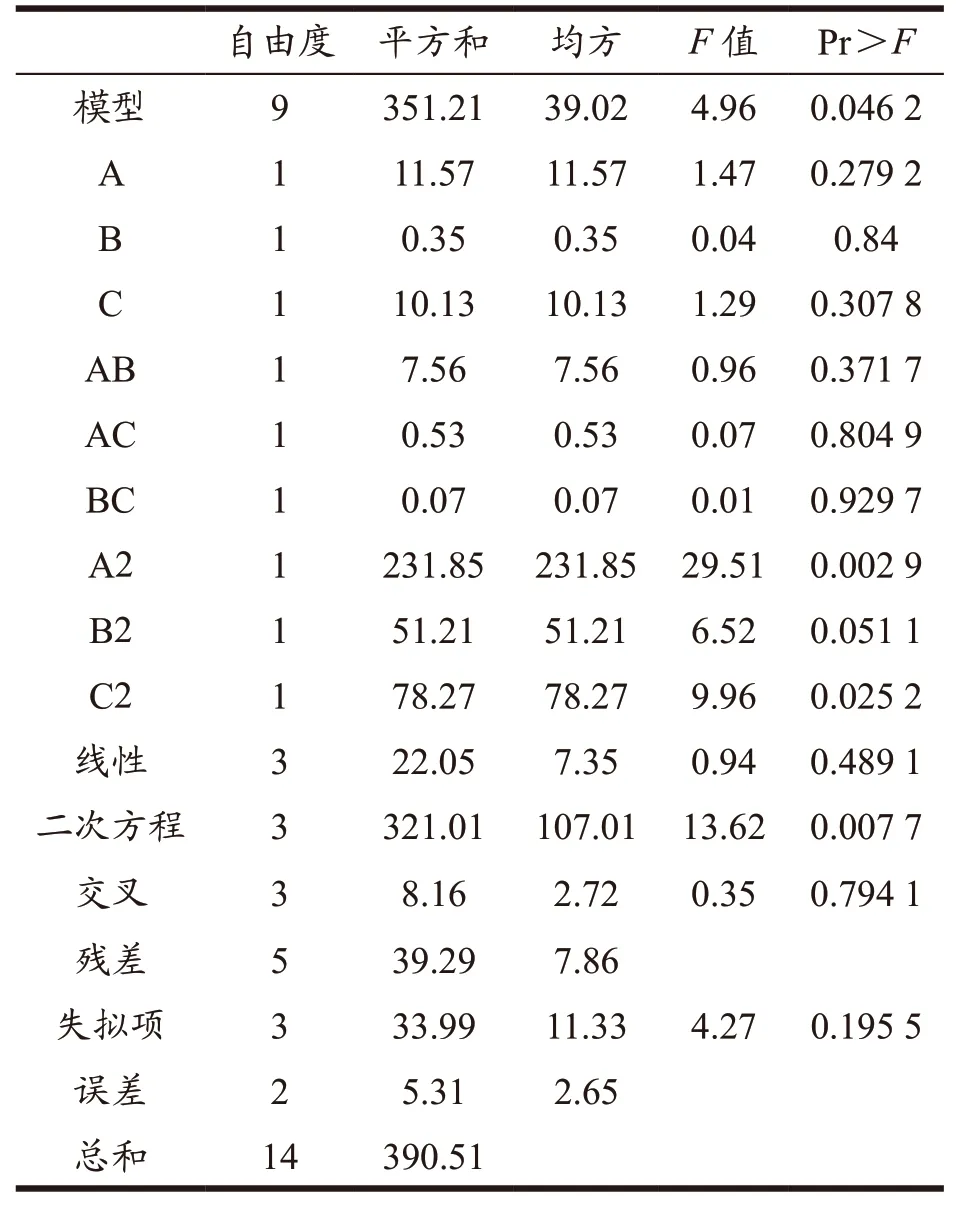
表3 回归模型方差分析Table 3 ANOVA with regression models
2.6 耐热性试验结果
大多数益生菌是不耐热的,提高耐热性可以增加益生菌在加工过程中活菌数。在试验前,首先将菌液和微胶囊的菌落总数分别稀释为1.8×109CFU/mL和2.1×109CFU/mL。由图6 可知,70 ℃时对照组随着处理时间的加长菌落总数显著下降(P<0.05),微胶囊组也随着处理时间的加长菌落总数也存在显著下降(P<0.05),而且对照组和微胶囊组菌落总数相差不是很大,对照组为菌液,菌液里面含有MRS 培养基对菌体有一定的保护作用。在85 ℃时随着处理时间的加长,对照组和微胶囊组都没有明显的变化,但微胶囊组菌落总数明显多于对照组,说明包被壁材具有一定的抗热性能。在100 ℃时随着处理时间的加长对照组和微胶囊组都变化不显著,但菌液对照组菌体存活数在每个时间处理段微胶囊组照菌落总数明显多于对照组,说明包被壁材麦芽糊精具有很好的耐热性。

图6 温度对罗伊氏乳杆菌微胶囊和菌液的菌落总数的影响以及显微观察(e1~e6)Fig.6 Effect of temperature on microencapsulated bacteria and liquid bacteria of L. reuteri and microscopic observation (e1~e6)
2.7 体外模拟静态消化试验结果
在试验前将对照组和微胶囊组菌落总数调为一致。试验结果为,由图7a 可知,微胶囊在模拟胃液消化过程中没有显著变化(P>0.05),在肠液中增加后没有显著变(P>0.05);对照菌液组在刚加入胃液后显著变小(P<0.05),之后在胃液和肠液中没有显著变化(P<0.05);说明都能够顺利通过胃液到达肠液并裂解出来,由于包埋壁材对罗伊氏乳杆菌有一定的保护作用,避免强酸环境对罗伊氏乳杆菌的破坏;当微胶囊到达肠液中,肠液为碱性和胃液酸性中和,导致溶液的pH 值增大反而适合罗伊氏菌的生长,所以在肠液中菌的菌落总数要多于胃液;对照组中菌液含有液体培养基,培养基本身也是一种营养物质同时也为罗伊氏乳杆菌提供营养,在肠液中pH 值增大也促进菌体生长繁殖以至于肠液中菌落总数多于胃液。
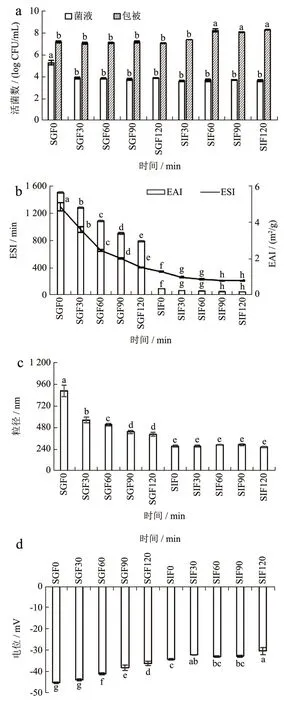

图7 不同消化时间胃肠液中的微胶囊和菌液的菌落总数(a),EAI 和ESI 的影响(b),粒径和电位的影响(c、d),粒径分布(e1、e2)Fig.7 The total number of microcapsules and bacterial fluid in gastrointestinal juice at different digestion time (a), the effect of different digestion time on EAI and ESI (b), the effect of different digestion time on particle size and potential(c, d), particle size distribution (e1, e2)
由图7b 可知,随着消化时间的增加,EAI 和ESI 都逐渐下降到肠液之后变化不显著(P>0.05),加入胃液后pH 值快速减小微胶囊处于强酸环境中,降低了稳定性所以导致EAI 和ESI 都逐渐下降。由图7c 可知,粒径在胃液中随着消化时间的增加粒径减小(P<0.05),在肠液中没有显著变化在小肠中微胶囊裂解然后进行了二次乳化,大小均匀;在整个消化中电位数值的绝对值随着消化时间的增加逐渐减小(P<0.05)。
在图8 中,a1~a5的显微图片圆球密集且多,b1~b5的显微图片圆球稀少,与消化试验中随着消化时间的增加,EAI 和ESI 都逐渐下降(P<0.05),到达肠液之后变化不显著(P<0.05);c1~c5和d1~d5可以得出微胶囊在胃液消化中一直处于聚团状态,到达肠液后随着消化时间的增加逐渐散开直至没有聚团,说明微胶囊在胃液中保护了菌体不被破坏,让菌体顺利达到肠道中。
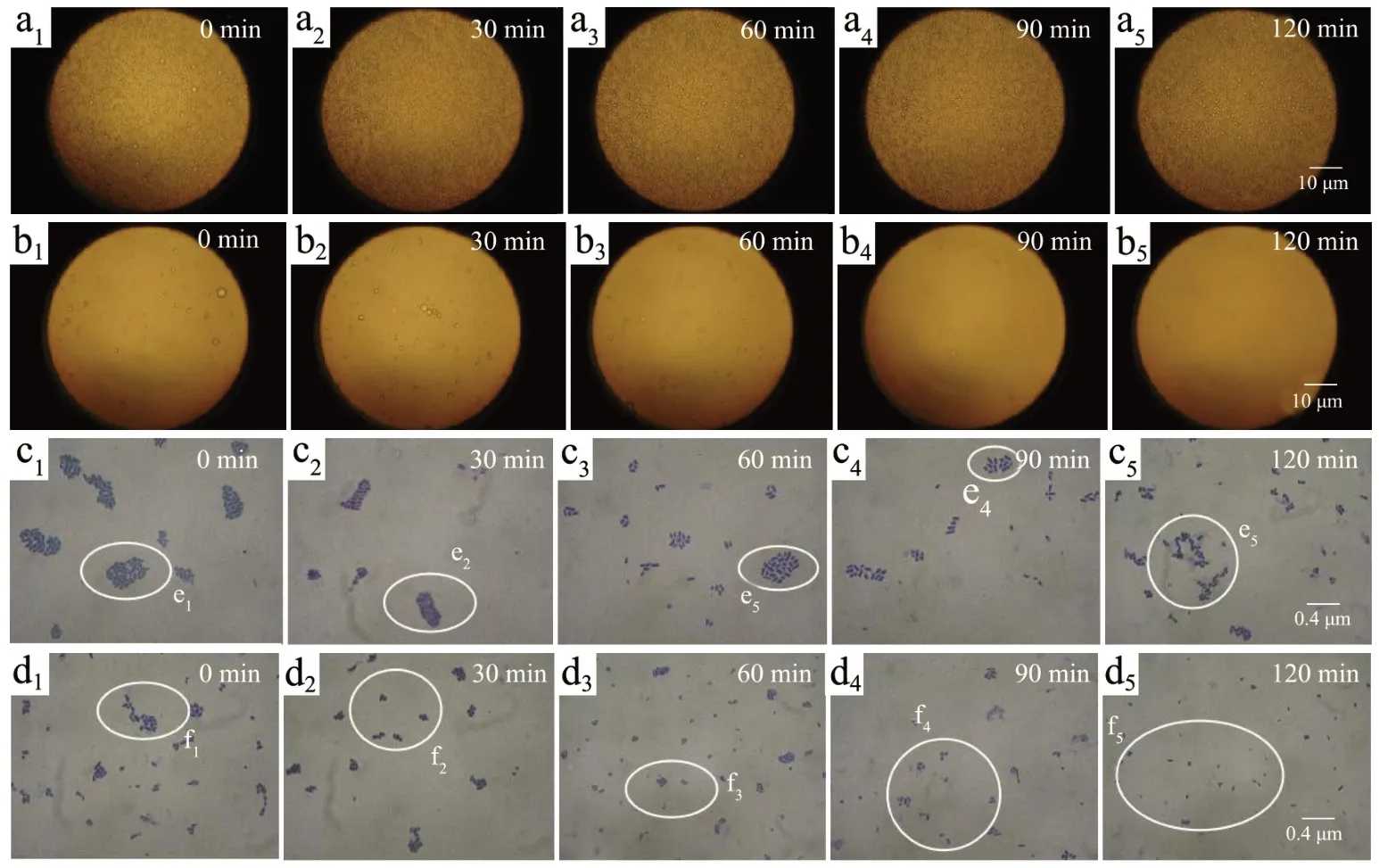
图8 不同消化时间胃肠液中的微胶囊的显微图Fig. 8 Micropictures of microcapsules in gastrointestinal juice at different digestion times
2.8 体外模拟动态消化试验结果
在试验前将对照组和微胶囊组菌落总数调为一致。实验结果如下,在图9 中,随着消化时间的增加,微胶囊包被组菌落总数在胃液中先减少到达肠液中再慢慢增加均有一定的缓释效果(P<0.05),对照组在胃液中先减少后变化不显著(P<0.05);EAI 和ESI随着消化时间的增加先减小(P<0.05),之后变化不显著(P<0.05);粒径先增大后减小(P<0.05);电位的数值绝对值先减小后增大又减小(P<0.05)。
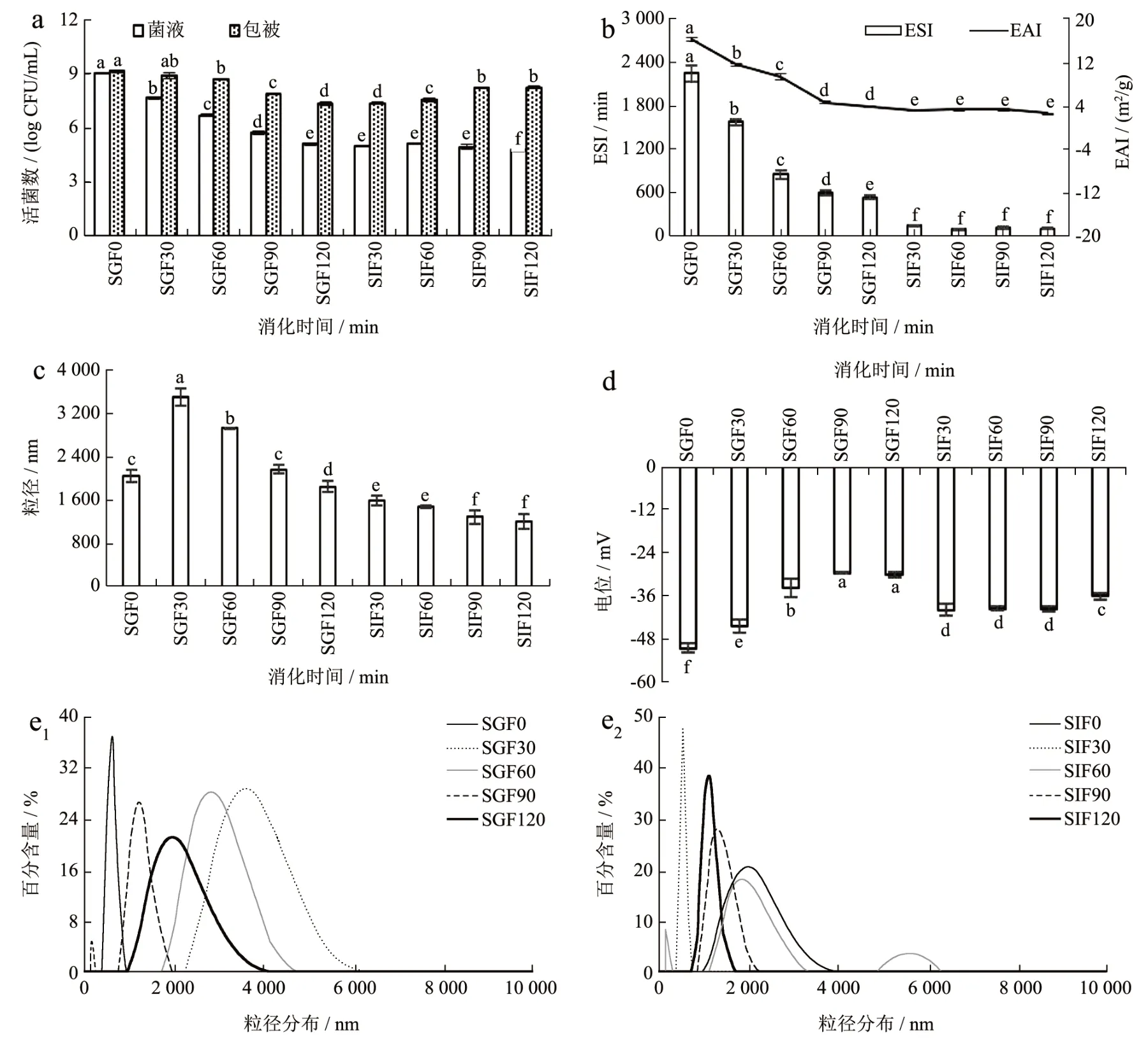
图9 不同消化时间胃肠液中的微胶囊和菌液的菌落总数(a),EAI和ESI的影响(b),粒径和电位的影响(c、d),粒径分布(e1、e2)Fig.9 The total number of microcapsules and bacterial fluid in gastrointestinal juice at different digestion time (a), the effect of different digestion time on EAI and ESI (b), the effect of different digestion time on particle size and potential (c, d), particle size distribution (e1, e2)
在图10 中,a1的圆球密集且多,而a2~a5的圆球要大一些,圆球出现了大小不一的聚集,可能液态微胶囊遇到强酸发生了不规则的聚集,但圆球完整没有出现破乳现象,说明微囊化中的罗伊氏乳杆菌在通过胃时可以受到保护。随着肠液不断的加入,pH 值增大微胶囊不规则聚集被破坏,b1~b5的圆球逐渐变小散开;c1~c5和d1~d5可以得出微胶囊在胃液消化中一直处于聚团状态,到达肠液后随着消化时间的增加逐渐散开直至没有聚团,说明微胶囊在胃液中保护了菌体不被破坏,让菌体顺利达到肠道中。

图10 不同消化时间胃肠液中的微胶囊的显微图Fig.10 Micropictures of microcapsules in gastrointestinal juice at different digestion times
3 结论
本研究采用磷脂、麦芽糊精等复合壁材,经乳化法制备液态微胶囊,在100 ℃热处理60 s 活菌数为3.86×108CFU/mL,在肠道中具有缓释作用,经过胃肠液消化4 h 后微胶囊活菌数为1.85×108CFU/mL。因此,由磷脂、麦芽糊精等制备的罗伊氏乳杆菌液态微胶囊为乳白色液体,具有很好的耐热性和缓释性,从而提高其对消化酶等不利因素的耐受性,使其有足够多的活菌进入肠道,进而发挥益生功效,为罗伊氏乳杆菌在食品加工中的应用奠定理论基础。
