GABA 处理延缓荔枝果皮褐变及与酚类物质变化的关系
2024-04-03黄世鑫郑斯文周颖钿王凯赵雷刘旭伟胡卓炎
黄世鑫,郑斯文,周颖钿,王凯,赵雷,刘旭伟,胡卓炎
(华南农业大学食品学院,广东广州 510642)
荔枝(Litchi chinesisSonn.)是无患子科的一种非过渡、亚热带和热带水果,我国南方及东南亚广泛种植[1]。荔枝本身采后极其不易贮运,极易出现荔枝果皮褐变等现象,直接影响其商业价值,主要原因是采后的褐变及腐烂,这直接关系到荔枝产业的发展问题[2]。因此,采后对荔枝进行一定的处理措施以延缓褐变和保持品质是极其有必要的。
荔枝果皮褐变主要原因是酚类物质发生酶促氧化形成醌进而聚合成褐色物质,褐变与荔枝果皮中的酚类物质含量及相关代谢酶等密切相关[3]。苯丙氨酸解氨酶(Phenylalanine Ammonia-lyase,PAL)为苯丙烷代谢的关键酶,是许多植物次生代谢产物合成途径的第一限速酶,对合成酚类,黄酮类及花色苷类物质都起到重要作用,有研究报道PAL与荔枝果皮褐变具有显著相关性[4]。乔沛等[5]报道,多酚氧化酶(Polyphenol Oxidase,PPO)和氧化物酶(Peroxidase,POD)能够将酚类物质氧化为醌进而引起荔枝果皮褐变,是导致荔枝果皮褐变的主要相关酶。Zhang 等[6]研究报道,漆酶(Laccase,LAC)在荔枝果皮中的酶促褐变同样扮演着重要角色,参与酚类物质的降解,调控褐变的过程。
γ- 氨基丁酸(γ-Aminobutyric Acid,GABA)是一种非蛋白质氨基酸,植物在逆境条件下发生GABA 累积,是应对胁迫环境的代谢产物。在1998年GABA 已被美国环境保护署(EPA)登记,确认在水果上的应用对人体健康或环境无任何毒副作用,并且在2009 年GABA 被中国卫生部正式批准为新资源食品,GABA 的外源应用研究逐渐备受关注。前期研究发现,荔枝在低温贮藏下GABA含量显著增加并有利于果实品质的保持[7]。近年又有研究报道,外源GABA 处理可促进桃果实中内源GABA 积累,增强果实的抗逆境能力,减少病害发生[8]。此外,有研究报道GABA 和酚类物质代谢之间可能存在一定关系,GABA 处理可调控双孢菇酚类物质代谢,维持较高水平总酚含量,延缓菇帽褐变[9]。南果梨在冷藏下会发生果皮褐变,而外源5 mmol/L GABA 处理梨果实15 min 可促进内源GABA 积累,显著改善果皮抗氧化能力和褐变情况[10]。目前有关外源GABA 处理对荔枝果皮褐变和酚类物质变化的影响未见报道。本研究拟采用5 mmol/L 的GABA 溶液处理荔枝,对荔枝果皮的外观颜色指标以及酚类物质相关指标进行评价,试图探讨荔枝采后逆境下对褐变相关的物质及其影响规律,揭示GABA 处理对荔枝果皮褐变及酚类物质变化的影响规律,为丰富荔枝保鲜领域的数据和研发绿色保鲜剂的提供参考依据。
1 材料与方法
1.1 材料与仪器
荔枝鲜果,品种为‘桂味’,产地为广东省广州市,于2021 年6 月16 日采收,2 h 内运回实验室进行试验处理;GABA,上海麦克林生化技术有限公司;没食子酸(标准品)、1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-Picrylhydrazyl,DPPH)分析纯,Sigma-Aldrich 中国;芦丁(Rutin,标准品)、福林酚(分析纯),上海源叶生物科技有限公司;甲醇、乙醇、盐酸、氢氧化钠、碳酸钠、亚硝酸铝、硫代巴比妥酸、三氯乙酸、愈创木酚等其他试剂均为国产分析纯。
Uvmini-1240 紫外可见扫描分光光度计,日本SHIMADZU 公司;NR60CP 色差仪,深圳市三恩时科技有限公司;SpectraMaxi3x 连续波长多功能微孔板检测平台,美国Molecular Devices 公司。
1.2 实验方法
1.2.1 实验设计
选取果实大小及颜色一致,无机械损伤,表面无病菌虫害的果实作为试验原料。试验设置两个处理组,清水对照组(CK)和GABA 处理组,每个处理组别荔枝果实5.0 kg。根据Shekari 等[9]的研究工作,经预备试验,选择5 mmol/L 的GABA 溶液,浸泡处理时间15 min,自然晾干后,按实验设计随机取样品按20 颗/袋分装于0.025 mm PE 保鲜袋,封口。另外,两个处理组分别随机取10 颗荔枝果实装于保鲜袋中,用于拍照,以观察贮藏过程中荔枝果皮褐变的进程。各样品在恒温箱内避光贮藏[ (20±1) ℃,相对湿度为85%~90% ]。在0、1、2、4、 6 d 中抽取样品,每次取样随机取荔枝(20 颗)用于测定相关指标,取样后先测定色差,褐变率和好果率,随后将果皮用液氮研磨成粉,用于测定总酚、MDA 含量和不同酶活力等指标,实验重复三次,取平均值。
1.2.2 测定指标
1.2.2.1 褐变指数(Browning Index,BI)和好果率(Good Fruit Rate,GFR)测定
参考Zhang 等[3]的方法,按照果皮外表面褐变面积占整个果实外表的面积的大小,把果皮褐变程度分为4 级:
无褐变或褐变面积与果实外表面积之比小于1/4 为1 级果;
褐变面积占果实外表面积的1/4~1/2 为2 级果;褐变面积占果实外表面积的1/2~3/4 为3 级果;褐变面积占果实外表面积大于3/4 或果实已经腐烂为4 级果;
式中:
B——褐变指数(BI);
F——好果率(GFR),%;
L——褐变等级;
L1——一级果数目;
n——该级果数;
N——总果数。
1.2.2.2 失重率(Weight Loss,WL)测定
采用天平分别称量贮藏前荔枝果实的初始质量和贮藏后荔枝的质量,通过贮藏前后荔枝果实的重量变化率来计算荔枝果实失重率。
式中:
L——果实失重率(WL),%;
W0——果实初始质量,g;
W1——测定果实质量,g。
1.2.2.3 果皮色差测定
使用色差仪对每个果的赤道面取3 个三角对称的点测定L*(明度/暗度)、a*(红色/绿色)、b*(黄色/蓝色)值。
1.2.2.4 丙二醛(Malondialdehyde,MDA)含量测定
取0.25 g 荔枝果皮粉,加入10%(m/V)三氯乙酸5 mL 均质后离心。将1 mL 上清液加入4 mL 10%(m/V)三氯乙酸 [含0.5%(m/V)硫代巴比妥酸]中。混合溶液在95 ℃下加热15 min,然后在冰浴中冷却,离心得澄清溶液分别在450、532 和600 nm 处测量吸光度。计算如下:
式中:
D——丙二醛(MDA)含量,nmol/g。
1.2.2.5 总酚(Total Phenols)含量、DPPH 自由基清除率测定
总酚含量测定:采用福林酚法。取0.5 g 果皮加入预冷的1%(V/V)盐酸甲醇2.5 mL,冰磨,4 ℃暗提取30 min,离心收集上清液。取0.05 mL 提取液加入0.5 mL 福林酚溶液,混匀,在室温下静置3~4 min,加入1.5 mL、20%(m/V)的碳酸钠溶液,以蒸馏水定容至10 mL 后混匀,在室温下避光静置2 h,在765 nm 下测定其吸光值。以0.05 mL 水按同样操作为空白,以没食子酸标准品绘制标准曲线:
DPPH 自由基清除率测定:参考Ali 等[11]的方法,将50 μL 的果皮甲醇提取物与3 mL DPPH 溶液混合,25 ℃避光保存30 min,在517 nm 测定吸光度。
1.2.2.6 总类黄酮(Total Flavonoids)和花色苷(Total Anthocyanin)含量测定
总类黄酮含量测定:参考韩冬梅等[12]的方法稍作修改。取荔枝果皮粉0.5 g,加入5 mL 80%(V/V)冷乙醇,离心后用冷乙醇稀释,稀释液0.5 mL 加入0.3 mL 的5%(m/V)NaNO2,静置5 min 后再加0.3 mL 的10%(m/V)硝酸铝,静置6 min,最后加2 mL 1 mol/L NaOH,定容至10 mL 测510 nm 的吸光值,以芦丁标准品绘制标准曲线:Y=0.043 3x+0.000 8,R²=0.996 6。
花色苷含量测定:参考Zheng 等[13]的方法稍作修改。取1 g 荔枝果皮粉,加入1%(V/V)盐酸甲醇溶液提取4 h,收集提取液,在530、620、650 nm 测定吸光值。最终换算以ΔA/g 表示花色苷含量。
1.2.2.7 PPO 和POD 活力测定
参照Tang 等[14]的方法并做修改进行酶提取液制备。取1 g 荔枝果皮粉,加入0.5 g PVP 和10 mL 0.1 mol/L pH 值为7.0 的磷酸缓冲液,4 ℃,10 000 r/min离心20 min,收集上清液,即为粗制酶液。
PPO:1 mL 0.1mol/L 邻苯二酚、1.9 mL 缓冲液、0.1 mL 酶液,410 nm 下检测,3 min 内的OD 值,每30 s 测一次,以吸光值增加0.001 为1 个活力单位(U)。
POD:2.4 mL 缓冲液、0.1 mL 1%(V/V)过氧化氢、0.4 mL 1%(V/V)愈创木酚、0.1 mL 酶液,470 nm 下检测,3 min 内OD 值,每30 s 测一次,以吸光值增加0.01 为1 个活力单位(U)。
1.2.2.8 PAL 活力测定
参考Yun 等[15]的方法并稍作修改。取0.5 g荔枝果皮粉末,加入3 mL 预冷的硼酸缓冲液,10 000 r/min 冷冻离心30 min,收集上清液为酶提取液,分别取1 mL 缓冲溶液和2 mL 20 mmol/L苯丙氨酸溶液于40 ℃预热10 min,然后样品管加入0.5 mL 粗提物,摇匀后于40 ℃反应1 h, 加入0.1 mL 6 mol/L 盐酸终止反应,290 nm 处检测。以吸光值增加0.01 为1 个活力单位(U)。
1.2.2.9 LAC 活力测定
参考Fang 等[16]的方法并稍作修改。取1 g 荔枝果皮粉末,加入5 mL 预冷的磷酸缓冲溶液,摇匀,4 ℃,10 000 r/min 离心20 min,取0.1 mL 酶提取液,加入到3 mL 表儿茶素溶液中(2 mmol/L)于45 ℃下反应30 min,在380 nm 处检测。以吸光值增加0.001 为1 个活力单位(U)。
1.3 数据处理
使用Excel 2016 软件整理试验数据;使用IBM SPSS Statistics 26软件检验试验数据之间的显著性和相关性分析(*为P<0.05,**为P<0.01);使用Origin 2019 处理数据并作图;使用TBtoolsv1.09867进行相关性热图制作。
2 结果与讨论
2.1 GABA处理对荔枝果皮外观褐变及色泽的影响
GABA 处理对荔枝果皮外观及色泽的影响结果见图1 和表1。采后果实的外观色泽变化是直接反映果实商品价值及贮藏品质的一个重要参数,色泽、褐变指数和好果率是可以简单且直观地评价果实价值的指标。从图1 可观察到,0 d 荔枝整体外观色泽均一,红色饱满鲜艳,无褐变现象。在贮藏6 d 时,与对照CK 组比较,GABA 处理的荔枝果皮维持红色色泽,无大面积褐变。如表1 所示,随着贮藏时间的延长L*、a*和b*值都呈下降的趋势,在贮藏2 d 后,与CK 组相比,GABA 处理组的下降幅度更小,GABA 处理组的L*、a*、b*值均显著高于CK 组,说明GABA 处理保持更好的色泽,这一结果与图1 结果基本一致。
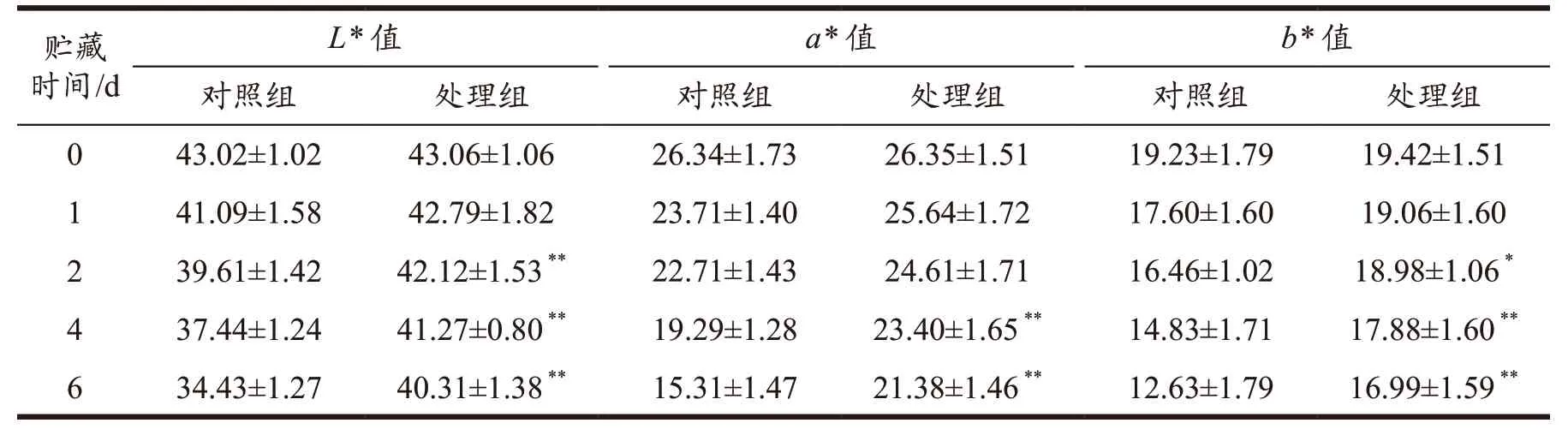
表1 GABA处理对荔枝果皮的L*、a*、b*值的影响Table 1 Effects of GABA treatment on L*, a* and b* values of litchi pericarp

图1 GABA 处理对荔枝果皮外观色泽的影响Fig.1 Effects of GABA treatment on appearance and color of litchi pericarp
GABA 处理对荔枝果皮的褐变指数及好果率的影响结果见图2。随着贮藏时间延长荔枝果皮褐变指数上升(图2a),好果率下降(图2b),6 d 时GABA 组褐变指数(2.80)显著低于CK 组(3.60),GABA 组保持36.67%好果率,而CK 组好果率为0。在外源GABA 处理梨和鲜切苹果中也观察到类似的结果[10,17],GABA 处理的梨果皮褐变度低于对照组24%,GABA 处理的鲜切苹果具有最高的L*值。由此可见,GABA 在延缓荔枝果皮褐变和保持贮藏品质上同样具有积极的作用。

图2 GABA 处理对荔枝果皮的褐变指数(a)及好果率(b)的影响Fig.2 Effect of GABA treatment on Browning index (a) and good fruit rate (b) of litchi pericarp
2.2 GABA处理对荔枝果皮失重率的影响
果实失重率与果实水分含量、营养成分等降解流失相关,失重率的变化可以反映出果实的生理代谢损耗情况,降低失重率是保持荔枝含水量及果实品质的关键,同时也是延缓荔枝果皮褐变的关键[2]。因此对荔枝失重率的监控有助于了解GABA 延缓果皮褐变的进程。如图3 所示,随着贮藏时间的延长,果实失重率上升,6 d 时GABA 组失重率(3.82%)显著低于CK 组(5.76%)。这可能是外源GABA 处理能够增强果实的抗逆境能力,保持果实中的水分含量,从而有效降低果实失重率[8,18]。在对西葫芦研究中发现外源GABA 处理可有效减缓西葫芦贮藏后期质量损失,帮助其长期应对冷藏环境[19]。以上结果说明,GABA 处理能够有效维持荔枝果实质量,有利于延缓荔枝果皮褐变。

图3 GABA 处理对荔枝果实失重率的影响Fig.3 Effect of GABA treatment on weight loss rate of litchi
2.3 GABA处理对荔枝果皮丙二醛(MDA)含量的影响
MDA 是膜脂过氧化的主要产物之一,有研究报道称荔枝果皮MDA 含量与衰老及褐变有关,抑制MDA 的积累有助于保持荔枝果实品质,减少MDA对荔枝的伤害[20]。已有研究证明,GABA 能够抑制脂质过氧化过程中MDA 形成[21]。在外源GABA 处理黄瓜及小麦的研究中发现[22,23],经GABA 处理的黄瓜和小麦中MDA 含量比对照组低约35%。本研究测定荔枝果皮MDA 含量如图4 所示,随着贮藏时间的增加,荔枝果皮中MDA 不断积累,GABA 处理显著(P<0.01)抑制果皮MDA 的积累,在贮藏6 d后GABA 组果皮MDA 含量比CK 组低44.13%,这一结果与前人的研究结果较为一致[22,23],说明GABA在延缓荔枝果皮MDA 积累中起到重要作用。

图4 GABA 处理对荔枝果皮中MDA 含量的影响Fig.4 Effect of GABA treatment on the content of malondialdehyde in litchi pericarp
2.4 GABA处理对荔枝果皮总酚、类黄酮、花色苷及DPPH的影响
荔枝果皮富含酚类、黄酮类及花色苷等非酶抗氧化类物质,其含量直接与荔枝果皮的抗氧化活性相关,可直接反映果皮抗逆境能力,同时作为植物次生代谢产物,这些物质又直接与果蔬的色泽、品质、抗逆性及组织褐变等密切相关[24,25]。随着贮藏时间的延长,荔枝果皮中总酚、类黄酮含量和DPPH 自由基清除率都呈现先上升后下降的趋势,如图5a~d 所示。
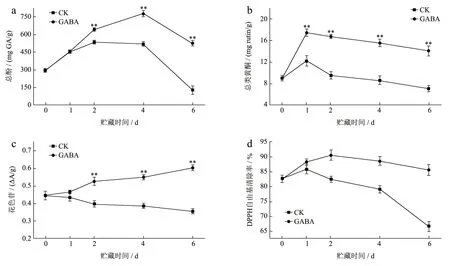
图5 GABA 处理对荔枝果皮中总酚(a)、黄酮(b)、花色苷(c)及DPPH(d)的影响Fig.5 Effect of GABA treatment on total phenols (a), flavonoids (b), anthocyanins (c) and DPPH (d) in litchi pericarp
在蓝莓 的研究中发现GABA 处理后的果实在贮藏8 d 后,总酚含量和黄酮类物质含量分别是对照组的1.31 倍和1.18 倍[26],这一结果与本研究在荔枝中观察到的结果相似。荔枝在贮藏前期存在一个酚类物质积累的过程(图5a、b),CK组在2 d 时达到峰值(534.01 mg GA/g),GABA组则在4 d 时达到峰值(776.38 mg GA/g),GABA 组中类黄酮在贮藏1 d 后显著积累至最高值(17.37 mg rutin/g)之后一直下降,在GABA 处理6 d 后,荔枝果皮总酚(525.93 mg GA/g)和类黄酮(14.06 mg rutin/g)含量分别是CK 组的4.2 倍和1.99 倍。在GABA 处理樱桃中也观察到相似总酚和黄酮积累的规律[27]。此外,在贮藏6 d 后观察到总酚含量的下降,可能是贮藏后期因为细胞膜完整性破坏,酚类和黄酮类物质大量流出细胞发生酶促褐变反应,导致酚类物质大量降解[27]。如图5c、d所示,对比CK 组,GABA 组花色苷含量在整个贮藏期一直上升,并在6 d 达到最高值(0.54 Δ A/g),GABA 处理的荔枝果皮DPPH 自由基清除率在整个贮藏期间均保持在80%以上,在2~4 d 显著高于CK 组(P<0.01)。Aghdam 等[27]认为,GABA 处理可能通过引发苯丙氨酸途径,增加酚类,黄酮类和花青素的积累并维持较高的DPPH 自由基清除率,从而延缓了樱桃果实的褐变和保持了果实品质。综上结果说明,GABA 处理促进荔枝果皮酚类、黄酮类、花色苷物质的积累,保持荔枝果皮具有较高的DPPH 自由基清除率。
2.5 GABA处理对荔枝果皮PPO、POD、PAL和LAC酶活的影响
如图6a、b 所示,GABA 处理显著延缓了荔枝PPO 和POD 酶活力的增加,在6 d 时,CK 组的PPO 和POD 酶活分别为GABA 组的1.27 倍和1.48倍。这表明,GABA 处理能有效降低荔枝PPO 和POD 酶活。类似地,有研究证实外源褪黑素通过降低荔枝果皮中PPO 和POD 酶活力,维持高水平的总酚,黄酮和花色苷含量来延缓褐变[3]。在GABA的应用中同样也有报道,GABA 通过抑制芒果中PPO 酶活力,提高采后芒果品质[28]。
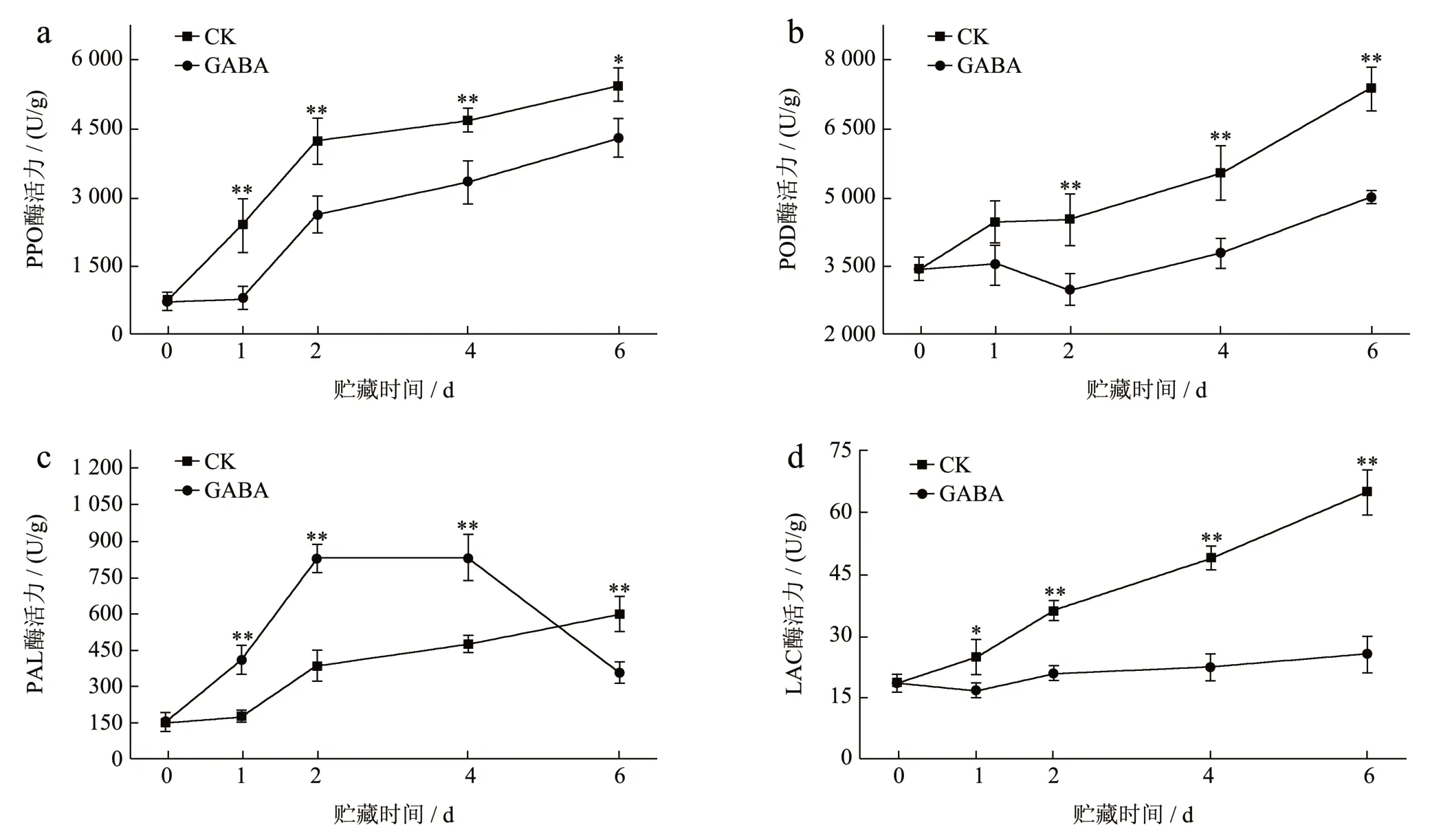
图6 GABA 处理对荔枝果皮中PPO (a)、POD(b)、PAL(c)、LAC(d)酶活的影响Fig.6 Effect of GABA treatment on PPO (a), POD (b), PAL (c), LAC (d) enzyme activity in litchi pericarp
Aghdam 等[29]报道GABA 诱导激活PAL 酶活力,促进苯丙烷途径合成次生代谢物质抵抗衰老及褐变。图6c 所示,荔枝果皮中PAL 酶活力随着贮藏时间而上升,GABA 处理组的PAL 活性在贮藏前中期(1~4 d)显著高于CK 组,在6 d 低于CK 组。推测可能是在贮藏后期酚类等次生代谢物质含量较高反馈抑制了PAL 酶活力。结果表明GABA 处理在贮藏前期通过激活PAL 酶活力,从而增加酚类等物质的积累和DPPH 清除能力[27](见图5)。
研究报道LAC 参与荔枝果皮花色苷降解,促进褐变物质积累,加速荔枝褐变,抑制LAC 酶活性可以有效防止荔枝果皮失红[14]。如图6d 所示,CK组的LAC 酶活力在整个贮藏期间一直上升并在6 d达到GABA 组的2.54 倍,而经GABA 处理后的荔枝果皮中观察到LAC 酶活力在贮藏期间被显著抑制,LAC 酶活力较为稳定,未发生明显的上升或下降。这一结果与Fang 等[16]的研究结果相似,LAC酶的激活是引起荔枝果皮褐变的主要原因,通过抑制LAC 酶活力可有效防止褐变发生。因此可以推测,GABA 在荔枝果皮的花色苷代谢上可能起到重要作用,通过抑制LAC 酶活进而影响花色苷代谢可能是延缓荔枝果皮褐变的途径。
2.6 相关性分析
为了建立GABA 处理后荔枝果皮酚类物质变化与褐变性状之间的关系,进行了相关性分析。如图7a 所示,果皮褐变指数(BI)与失重率(WL)呈现正相关,而好果率(GFR)和颜色值L*、a*、b*呈现负相关,以此将荔枝的正相关生理指标分为褐变(Browning),负相关生理指标分为抗褐变(Anti-browning)指标。比较CK 组中的实验数据,对酚类物质相关指标(PAL、LAC、POD、MDA、PPO、Total Phenols、Total Flavonoids、Total Anthocyanin、DPPH)与Browning 及Anti-browning进行相关性分析,可将酚类物质代谢相关指标分为三个聚类(图7b 中的1、2、3)。
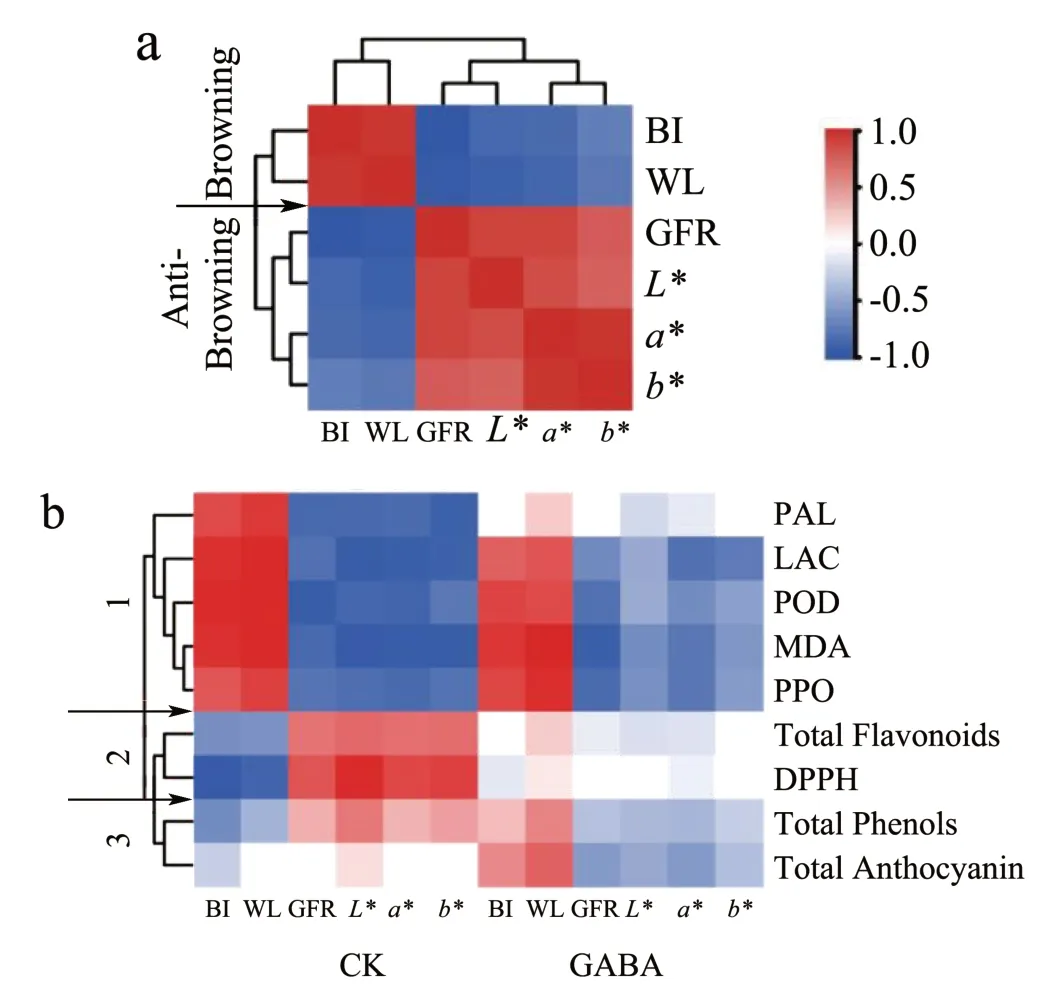
图7 GABA 处理后荔枝果皮褐变和酚类物质相关性质的相关性分析Fig.7 Correlation analysis betweenlitchi peel browning and traits related to phenolic after GABA treatment
CK 组中,图7b 聚类1 与Browning 呈正相关,与Anti-browning 呈负相关,这一结果与Sun 等[4]对荔枝果实发育过程中果皮褐变的研究结果一致。随着贮藏时间延长,MDA 积累,激活PPO、POD、PAL 及LAC 酶活,促进酶促褐变的发生。GABA处理后减弱了聚类1 与Browning 及Anti-browning的相关性,说明GABA 处理通过聚类1 指标延缓褐变可能是起到一个作用。图7b 聚类2 和3 所示,CK 组与Browning 呈现显著负相关,与Antibrowning 显著正相关,GABA 处理后,聚类2 无显著相关性,聚类3 结果则与CK 组相反,说明GABA 处理显著影响了聚类2 和3,总酚,黄酮,花色苷含量及DPPH 清除率在延缓褐变的过程中可能是起到关键作用。
综上,GABA 处理通过显著诱导总酚、黄酮、花色苷合成,抑制酶促褐变反应,减少MDA 物质积累,保留较高的酚类物质水平和DPPH 自由基清除率,从而实现延缓果皮褐变。
3 结论
研究结果发现外源GABA 处理可以维持荔枝贮藏质量和果实色泽,抑制荔枝果皮中MDA 含量的积累,并且通过激活PAL 酶活力,抑制PPO,POD和LAC 酶活力,减少过氧化反应的发生,贮藏6 d时GABA 处理的荔枝果皮具有较高的总酚、黄酮和花色苷物质积累,DPPH 自由基清除能力提高。LAC 酶及花色苷的代谢可能起到关键作用。对于GABA 延缓荔枝果皮褐变的生理生化机制、GABA对漆酶和花色苷代谢的具体作用机制以及不同GABA 浓度和处理时间等因素对荔枝果皮褐变的影响,还有待进一步探讨。
