大豆分离蛋白制备过程中热处理及干燥方式对其热聚集行为和凝胶性能的影响
2024-04-03谭文浩郭健杨晓泉
谭文浩,郭健,杨晓泉
(华南理工大学食品科学与工程学院,广东广州 510640)
随着绿色、可持续的发展理念和追求健康的生活理念深入民心,植物基食品近年在国内外掀起热潮。全球食品工业尝试以不同来源食物蛋白质替代动物蛋白生产各式食品,以期为未来社会发展寻求稳定的蛋白质供应来源[1]。不同豆类植物、昆虫和藻类来源蛋白质以其生产效率高、具备特殊的保健和功能特性等特点受到各大食品生产商和研究人员的关注[2]。然而,产量大、成本低及氨基酸组成合理的大豆蛋白仍是当前食品工业应用最广泛的植物蛋白[3]。大豆蛋白的可消化必需氨基酸评分(Digestible Indispensable Amino Acid Score,DIAAS)为0.90 分,是最接近动物蛋白评分的植物蛋白[4];多年前的研究已表明,长期食用大豆蛋白有助于降低患冠心病、糖尿病、心脑血管病等疾病的风险[5]。可见,大豆蛋白是传统动物蛋白的优质替代品。
大豆分离蛋白(Soy Protein Isolates,SPI)是最常见的一种商业化大豆蛋白产品,大多通过热处理使产品符合有关微生物安全指标的要求,商业化大豆分离蛋白在制备过程中除了“碱溶酸沉”还需经历高温热处理和短时高温的喷雾干燥[6]。而大豆蛋白质是一类对温度极为敏感的生物大分子物质,制备过程中,前述两项有关热处理均超过了大豆蛋白的变性温度,蛋白质不可避免地发生去折叠、疏水基团暴露和聚集[7],实际获得的是大豆蛋白聚集体的产物,而与天然蛋白质相比,蛋白聚集体空间构象的柔性随之下降,能产生相互作用的侧链基团也被包裹于聚集体内部,聚集体之间发生桥连并形成三维网络结构及其在界面组装的能力也明显下降。因此,商品SPI 普遍存在溶解性及成胶、乳化和起泡等功能特性不佳等问题[8],更多是作为蛋白质填充物在不同食品中添加使用。
对于SPI 品质的改良,研究者采用不同的物理或化学方法对SPI 成品进行处理,通过降低蛋白聚集体的粒径或增加其亲水基团数量尝试对其进行改性[9-12]。对于实际生产而言,这意味着在生产线前仍需添置相应的设备、增加工序对大豆蛋白原料进行处理,繁琐的操作并不是生产者的首选。随着当前植物基食品的兴起,植物基蛋白奶、肉类替代物等植物基食品要求大豆蛋白产品具有良好水化性质[13](溶解性和乳化性等)和凝胶性质[14](凝胶强度和持水性等)。对现行工艺进行重新的剖析理解,考察不同操作步骤对SPI 产品功能特性的影响,寻找相应工艺的解决方案,最终制备获得新一代SPI,使其满足当前植物基食品对植物蛋白配料的要求,显然更符合当前生产者的期望。
本研究以低温脱脂大豆粕为原料,对经过“碱溶酸沉”分离获得的大豆蛋白进行热处理及喷雾干燥或冷冻干燥制备获得SPI,比较不同样品的热聚集行为及所成凝胶的机械性能,以此厘清制备过程中热处理和喷雾干燥处理对所得SPI 产品热致凝胶性能的影响,为选择更优的工艺操作提高SPI 品质、制备获得符合当前植物基食品要求的大豆蛋白配料提供理论基础。
1 材料与方法
1.1 材料与试剂
低温脱脂大豆粕,由山东御馨生物科技有限公司提供;其它化学试剂均为分析纯,实验用水为去离子水 (15.0 MΩ cm)。
1.2 主要设备与仪器
CR 22 G 高速离心机,日本日立公司;B-290 小型喷雾干燥塔,瑞士步琦公司;Alpha 1-4 冷冻干燥系统,德国CHRIST 公司;K9840 凯氏定氮仪,济南海能仪器股份有限公司;Q-100 差示扫描量热仪(Differential Scanning Calorimeter,DSC),美国TA公司;Zetasizer Nano ZS 纳米粒度仪,英国马尔文公司;MARS 60 哈克旋转流变仪,美国赛默飞公司;5943万能材料试验仪,美国英斯特朗公司;NM20-040H-I核磁共振成像仪,上海纽迈电子科技有限公司。
1.3 实验方法
1.3.1 SPI的制备
低温脱脂大豆粕经粉碎后以1:10 的料液比与去离子水混合均匀,用2 mol/L 氢氧化钠溶液调节pH值至8.0,室温下以200 r/min 搅拌2 h 后用四层60 目纱布滤去豆渣,再使用高速离心机离心(8 000 r/min,20 min,25 ℃),去除沉淀取上清液,用2 mol/L 盐酸调节pH 值至4.5 后,静置10 min 后离心(8 000 r/min,20 min,25 ℃),收集大豆蛋白沉淀。
取此沉淀以1:5 的质量比重新悬浮于去离子水中,并调节pH 值至7.0,获得大豆蛋白分散液。将此分散液置于100 ℃沸水浴中30 min,然后迅速冷却至室温,以此模拟对大豆蛋白进行热处理。采用小型喷雾干燥塔对此经过热处理的大豆蛋白分散液进行喷雾干燥,进口温度:180 ℃,出口温度:70 ℃,进料速度:2 L/h,收集所得粉体,将该样品命名为HSP-SPI。另外,采用小型冷冻干燥系统对经过热处理的大豆蛋白分散液进行冷冻干燥,系统真空度为35 kPa,冷阱温度为-55 ℃,获得样品记为HFD-SPI。
此外,未经热处理的大豆蛋白分散液,经上述条件进行喷雾干燥所得样品记为SP-SPI,经上述条件进行冷冻干燥获得样品记为FD-SPI。
1.3.2 SPI基本理化性质的表征
参考凯氏定氮法[15]测定制备所得SPI 的蛋白质含量。称取一定量蛋白粉末于消化管中,添加适量五水合硫酸铜和硫酸钾作催化剂,加入浓硫酸后进行消化,采用定氮仪对消化液进行蒸馏、吸收、洗涤,以硫酸标准溶液进行滴定,根据滴定结果计算蛋白含量。
SPI 中主要蛋白组分的热变性温度及焓值采用DSC 进行测定。称取3.0 mg 的蛋白粉末置于铝制坩埚,加入去离子水配制质量分数为20%的蛋白质分散体系,将坩埚压制密封并储存过夜,使蛋白充分水化。将坩埚置于DSC 样品腔中进行分析,待样品在25 ℃稳定1 min后以5 ℃/min速度升温至120 ℃,监测此过程中样品热量的变化。使用TA Universal Analysis 软件分析不同蛋白组分的变性温度(Tpeak)和变性焓值(ΔH)。
蛋白质溶解度采用Lowry 法[16]进行测定。将SPI配制质量分数为1.0%的大豆分离蛋白分散液,室温下搅拌2 h使蛋白充分水化,分别调节pH值至3.0、 4.0、5.0、6.0、7.0、8.0。对各分散液进行离心(10 000 r/min,20 min,25 ℃),以福林-酚试剂测定离心前后蛋白分散液的蛋白含量。SPI 的溶解度根据公式(1),即离心前后分散液中蛋白含量的比值计算获得。
式中:
Sp——SPI 的溶解度,%;
A1——离心后蛋白分散液在500 nm 波长处的吸收值;
A2——离心前分散液在500 nm 波长处的吸收值。
SPI 分散液的ζ-电位采用纳米粒度仪利用动态光散射技术进行测定。配制质量分数为0.5%的SPI分散液,在室温下搅拌2 h,分别调节pH 值至2.0、3.0、4.0、5.0、6.0、7.0、8.0。将其注入样品池,于25 ℃下进行测定。
1.3.3 SPI分散液中蛋白质体积分数的测定
配制质量分数分别为0.5%、1.0%、1.5%、2.0%、2.5%和3.0%的SPI 分散液,调节pH 值至7.0,将其置于100 ℃沸水浴中进行30 min 热处理,迅速冷却至室温。采用内径为0.57 mm 的乌氏粘度计测定SPI 分散液在热处理前后的动力粘度(ν),并通过Lee 公式[17]计算该体系中蛋白质所占的体积分数(φ)、蛋白分散相密度(ρp)及内部蛋白含量(Cp,m/m)。
式中:
ν——运动粘度,Pa·s;
K——粘度计常数,m2/s2;
t——试液流出时间,s。
式中:
η——蛋白分散液运动粘度,Pa·s;
ηs——分散介质运动粘度,Pa·s;
ρ——蛋白分散液密度,kg/m3;
φ——蛋白质所占的体积分数,%。
式中:
ρp——蛋白相密度,kg/m3;
ρs——水相密度,kg/m3。
式中:
Cp,m/m——内部蛋白含量,%。
Cm/v——蛋白分散液的蛋白含量,%。
1.3.4 SPI分散液剪切黏度的测定
采用哈克旋转流变仪测定经过热处理(100 ℃,30 min)的质量分数为10%的SPI 分散液的剪切黏度。选用直径35 mm 的平板探头,设置板间间隙为1 mm,记录蛋白分散液在25 ℃、剪切速率为0.1~100 s-1条件下的黏度变化。
1.3.5 SPI热致凝胶的制备、机械性能及持水性分析
配制质量分数为14%、16%和18%的大豆蛋白分散液,调节pH 值至7.0,将其置于100 ℃沸水浴中加热30 min,迅速冷却至室温形成凝胶。将凝胶切成长15 mm、宽15 mm、高10 mm 的长方体。采用万能材料试验仪对凝胶的机械性能进行分析。选用直径为25 mm 的圆盘探头对样品进行单向压缩,探头下压速度为0.2 mm/s,触发力为0.1 g。根据公式(7)和公式(8)计算压缩过程中凝胶样品的Hencky 应变(eh)和Hencky 应力(σt)的变化,并绘制应力-应变曲线。
式中:
h0——测试凝胶样品的原始高度,mm;
A0——测试凝胶样品的横截面积,m2;
ht——凝胶样品测试时随时间t时的高度,mm;
Ft——凝胶样品测试时随时间t时的载荷,N。
凝胶样品的断裂应变(ef)和断裂应力(σf)分别为样品应力-应变曲线的最高点处对应的应变和应力。样品的杨氏模量(Young,s Modulus)为样品应力-应变曲线的斜率(应变小于5%)。
采用Shin 等[18]报道方法对凝胶样品进行两次压缩,测试条件如下:压缩形变程度为40%,探头压缩及返回速度均为1 mm/s,触发力为1.0 g,对凝胶的回复性(Resilience)进行计算。
上述制得凝胶样品中的水分状态采用核磁共振成像仪进行观察。主磁场强度为0.5 T,其对应共振频率SF 为20 MHz,样品室的温度为(32.00±0.01)℃,采用CPMG(Carr Purcell Meiboom Gill)脉冲序列测定样品的横向弛豫时间(T2)。CPMG 序列采用参数为:采样点数TD240018,回波个数NECH4000,回波时间TE 0.30 ms,采样率SW 200 kHz,重复采样时间间隔5 000 ms,重复采样次数8。选用反演软件进行连续谱迭代分析拟合得到各样品的波谱图,运算参数为:开始时间0.01 ms,截止时间10 000 ms,参与反演点数200。
1.3.6 数据分析
所有样品测定均独立进行三次重复试验,通过PASW Statistics 18对数据进行方差分析(ANOVA),采用Duncan 检验对多组样本间进行显著性分析,P<0.05 表示差异显著,数据以“平均值±标准差”方式表示。
2 结果与分析
2.1 不同热处理和干燥方式制得SPI的基本理化性质
为了探究高温加热和喷雾干燥两项热处理操作对所得蛋白制品凝胶性能的影响,本研究采用喷雾干燥获得SD-SPI(不经沸水浴处理)和HSD-SPI(经沸水浴处理),以及采用冷冻干燥获得FD-SPI(不经沸水浴处理)和HFD-SPI(经沸水浴处理)。四种SPI 制备过程包含的热处理操作及其蛋白含量如表1 所示。各样品的蛋白含量为81.57%~83.08%,四者之间并没有显著差异(P<0.05)。这表明,不同的热处理或干燥方式并不会显著影响所得蛋白制品的蛋白含量。本研究为了简化操作流程在“碱溶酸沉”后没有对收集的蛋白沉淀进行酸水洗涤,部分水溶性物质可能仍然保留在蛋白分散液中。因此,最终经不同干燥方式制得蛋白制品的蛋白含量均低于90%。

表1 四种SPI样品制备过程包含的热处理操作及其蛋白含量Table 1 The heat treatments conducted during preparation and protein contents of the four SPI obtained in this work
蛋白配料在食品中的应用兼顾不同的pH 值范围。ζ-电位反映了体系中蛋白分子表面所带电荷,与其稳定性及聚集倾向有关。为此,本研究考察了经不同处理获得SPI 在不同pH 值条件下的ζ-电位,其结果如图1a 所示。各样品在pH 值 4.0~5.0 范围下的ζ-电位绝对值接近0,表明其内含蛋白质的等电点在此范围,这说明不同的热处理并没有改变大豆蛋白的等电点。而在远离此等电点的pH 范围,体系的ζ- 电位还是有所区别的。与HSD-SPI 和HFD-SPI 相比,相同pH 条件下,SD-SPI 和FD-SPI具有更高的电位绝对值,在pH 值7.0 时,SD-SPI(-26.6 mV)和FD-SPI(-34.5 mV)明显高于HSDSPI(-11.1 mV)和HFD-SPI(-15.9 mV)。这表明,水浴热处理明显减少了大豆蛋白的表面荷电量,削弱了抑制蛋白聚集的分子间静电斥力[19]。

图1 四种大豆蛋白样品在不同pH 条件下的ζ-电位(a)和溶解度(b)Fig.1 ζ-potential (a) and solubility (b) of the soy protein products prepared in this work under various pH conditions
蛋白质在水相体系中的溶解度是食用蛋白质在食品工业中应用最重要的功能特性之一,与蛋白的凝胶、乳化和起泡等功能特性密切相关;具备良好溶解性的蛋白质往往具有良好的功能特性[20]。将本研究制得四种SPI 分散于去离子水中获得蛋白分散液,将其pH值调节至3.0~8.0,其溶解度如图1b所示。与以往大多与大豆蛋白相关的报道相一致[21],各样品的溶解性均具有pH 依赖性,呈典型的U 型趋势:各样品在pH 值4.0~5.0 范围,也就是接近大豆蛋白等电点的条件下(图1a),其溶解度最低(约10%);在远离大豆蛋白等电点的区域(pH 值3.0和pH 值6.0~8.0),其溶解度较高。制备过程中是否经历水浴热处理则显著影响了SPI 在此pH 值范围下的溶解度。以pH 值3.0 和7.0 条件下溶解度进行对比,HSD-SPI(31.9%、35.2%)和HFD-SPI(34.6%、42.0%)均低于42%,而SD-SPI(79.1%、79.9%)和FD-SPI(72.8%、69.8%)均高于69%。经过水浴热处理的前两者大多情况下的溶解性低于未经水浴热处理后两者的50%。可见,水浴热处理明显降低了所得SPI 样品的溶解度。就不同的干燥方式进行比较,SD-SPI 与FD-SPI 溶解度曲线较接近,HSD-SPI 与HFD-SPI 溶解度曲线较接近(图1b)。这表明,干燥方式并不会显著改变SPI 样品溶解度,这与以往相关的报道相一致[22]。
2.2 不同热处理和干燥方式对制备所得SPI热变性温度和热焓值的影响
本研究对经充分水化、质量分数为20%的蛋白分散体系进行DSC 分析,从热力学的角度考察不同热处理对SPI 结构的影响,结果如图2 所示。在升温过程中,SD-SPI 和FD-SPI 均出现了两个吸热峰。前者的双峰分别出现在78.07 ℃和98.15 ℃;后者则出现在78.41 ℃和97.59 ℃。对照过往文献报道[23],这两个吸热峰的出现分别是大豆蛋白两个主要的组分β-伴大豆球蛋白(β-conglycinin,7S 蛋白)和大豆球蛋白(Glycinin,11S 蛋白)在升温过程中高级结构去折叠所致。FD-SPI 在制备过程中没有进行水浴加热,也没有采用喷雾干燥处理,大豆蛋白尽可能维持其原有的结构。因此,该样品中的7S 和11S 组分都出现了典型的吸热峰。SD-SPI样品两个吸热峰对应的温度及焓值均非常接近FDSPI;这表明,短时热处理的喷雾干燥并没有破坏大豆蛋白主要组分原有的结构。经历了水浴热处理的HSD-SPI 和HFD-SPI 的DSC 分析图中只出现了基线,并没有出现7S 和11S 组分对应的吸热峰。这说明,水浴热处理使得大豆蛋白主要组分的高级结构去折叠;当将其样品进行DSC 分析时,其中的蛋白质已不具备原有的高级结构。图2 的DSC 分析结果显示,当SD-SPI 和FD-SPI 分散于水相体系,对其进行热处理时,其中的大豆蛋白仍然可以经历高级结构去折叠,继而发生聚集的过程[7]。由于在制备过程中蛋白质的高级结构已被破坏,HSD-SPI 和HFD-SPI中的大豆蛋白实际上处于去折叠的状态,当其分散液被加热时,已不再呈现出的蛋白变性、去折叠和聚集的典型行为[7]。

图2 四种大豆蛋白样品DSC 分析图Fig.2 DSC analysis of the soy protein products prepared in this work
2.3 不同热处理和干燥方式对制备所得SPI热聚集行为的影响
热处理是食品加工和食物制作中最常用的操作。蛋白质高级结构在此过程中势必受到影响,继续发生去折叠、随之聚集,最终形成不同的结构。当蛋白质在热处理时以相对有序的方式发生聚集,并形成规则的结构甚至三维凝胶网络,可以为食品体系带来良好的咀嚼感或口感体验[24]。本研究将制备所得的SPI 配制成不同质量分数的分散液(pH值7.0),对其进行热处理(100 ℃,30 min),采用乌氏黏度计对蛋白分散液的黏度进行测定;将这些体系中的蛋白质看作悬浮颗粒,并利用Lee 公式计算这些体系中蛋白所占的体积分数、容积度(Voluminosity)、颗粒内部蛋白含量和相密度,以流变学的角度考察这些样品所含蛋白质的热聚集行为,结果如图3 所示。

图3 不同质量分数(0.5%~3.0%)大豆蛋白分散液(pH 值7.0)经过热处理后(100 ℃,30 min)的蛋白体积分数(a)、容积度(b)、内部蛋白含量(c)和相密度(d)Fig.3 Protein volume fraction (a), voluminosity (b), internal protein content (c), and phase density (d) of the soy protein dispersions (pH value 7.0) with various solid contents (0.5%~3.0%) after heat treatment (100 ℃,30 min)
从图3a 可知,蛋白质在各体系中所占体积分数均随质量分数增加(0.5%~3.0%)而增加。进行热处理前,蛋白质在SD-SPI 和FD-SPI 体系中,约从10%增加至30%。进行热处理后,蛋白质在这两个体系中的体积分数约从5%增加至20%。另一方面,蛋白质在HSD-SPI 和HFD-SPI 体系中所占体积分数在加热前后均从10%增加40%,热处理并没有显著改变悬浮颗粒所占体积分数。各大豆蛋白样品分散液在加热前后的参数变化也呈相同的趋势(图3b、3c 和3d)。也就是SD-SPI 和FD-SPI 中蛋白质的容积度、颗粒内部蛋白含量及相密度在热处理后均出现了明显的变化。而HSD-SPI 和HFD-SPI中蛋白质各参数在热处理前后的差异并不显著。这一结果与DSC 分析的结果是一致的。
SD-SPI 和FD-SPI 中的蛋白质所占体积分数在经历热处理后出现明显下降可能是这两个样品中的蛋白质在升温时发生高级结构去折叠(图2)、随之发生聚集所导致的。与天然蛋白相比,热诱导形成聚集体的结构更紧密(容积度下降,图3b),蛋白质倾向分布于颗粒的内部(颗粒内部蛋白含量增加,图3c)。这表明,这两个样品中的蛋白质在热处理时可以发生聚集,并组装形成具有一定结构的聚集体。HSD-SPI 和HFD-SPI 是经过水浴热处理制得的SPI,其中的蛋白质更多以去折叠聚集体的形式存在;这些聚集体的形成已经消耗了大量可以提供疏水作用、氢键等相互作用的侧链基团位点[25]。这两个样品的参数在加热前后没有发生明显改变,说明这两个样品中的大部分蛋白质在此过程中没有发生进一步的聚集,其聚集体的结构没有发生明显改变。热处理未能破坏维持聚集体稳定的次级键,因而聚集体之间缺乏进一步聚集的作用位点[7]。以上结果表明,SPI 制备过程中的水浴热处理可以显著改变所得蛋白制品的热聚集行为;而干燥方式,尤其是短时热处理的喷雾干燥,则不会对所得产品的聚集能力带来显著的影响。
2.4 不同热处理和干燥方式对制备所得SPI热致成胶性能的影响
把水相体系中蛋白质质量分数提高至一定的范围,对其进行热处理,随着其结构展开、聚集,蛋白质分子的数量足以通过二硫键、疏水作用和氢键等形成三维网络结构,将水束缚于其中,蛋白基凝胶便得以形成[26,27]。在此过程中,参与形成凝胶网络的蛋白分子数量、驱动蛋白聚集分子间相互作用的强度及数量均是所得蛋白凝胶机械性能的影响因素。蛋白分子间可以产生相互作用的位点越多,越有利于形成具有更高强度的凝胶结构。本研究在上一部分展示了不同样品低质量分数(<3.0%)分散液中大豆蛋白的热聚集行为。由于其蛋白含量较低,蛋白只能形成聚集体,而不能形成凝胶网络。为了考察不同样品热致成胶性能,本研究需配制质量分数超过10%的分散体系,在其可以成胶的质量分数范围对其进行热处理(100 ℃,30 min),待其冷却后,测定所得凝胶的机械性能。
图4 显示的是本研究制备所得质量分数为10%蛋白分散液(pH 值7.0)的剪切黏度。结果表明,HSD-SPI 和HFD-SPI 分散液的黏度均呈典型的剪切变稀趋势,两者之间并没有显著差异。SD-SPI 和FD-SPI 分散液的黏度在该测试所选的剪切速率范围内(0.1~100 s-1)的下降幅度并不显著。值得注意的是,在剪切速率较低时(0.1 s-1),SD-SPI 和FD-SPI 样品的黏度比HSD-SPI 和HFD-SPI 样品低了4 个数量级。这说明,后两者的黏度显著高于前两者。两种组合之间黏度的差异再一次表明,经过水浴热处理制得HSD-SPI 和HFD-SPI 中的大豆蛋白可能是以聚集体的形式存在,而SD-SPI 和FDSPI 中可能更多的是未发生明显聚集、具有原有结构的大豆蛋白。
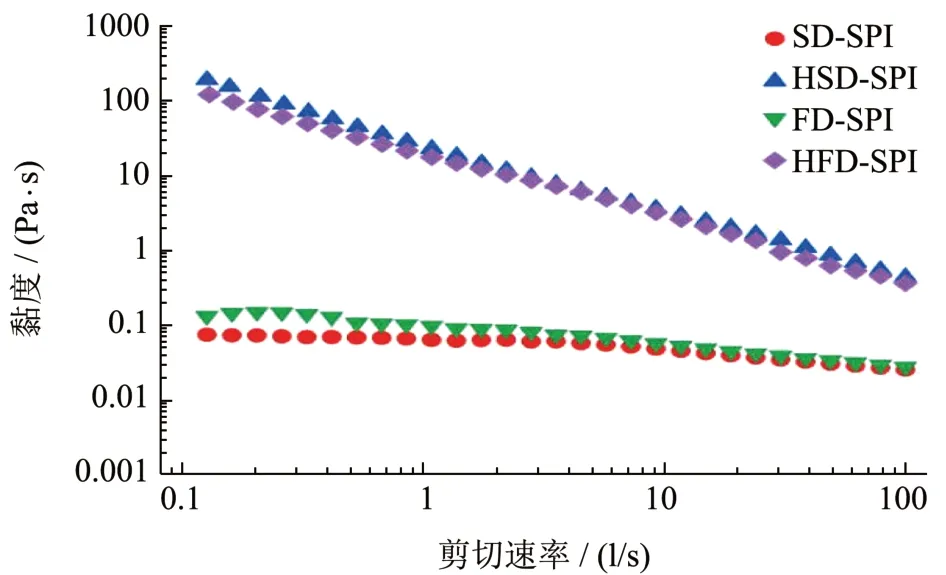
图4 四种大豆蛋白样品分散液(质量分数为10%)的剪切黏度Fig.4 Shearing viscosity of soy protein dispersions(solid content: 10%)
为了使不同SPI 制得凝胶之间机械性能的差异更明显,本研究将各SPI 配制成质量分数为14%、16%和18%的分散液(pH 值7.0),对其进行热处理,制得凝胶机械性能如图5 所示。杨氏模量描述的是固体材料抵抗形变能力的物理量,在本研究中与凝胶的刚性(Stiffness)有关。图5a 的结果显示,各样品制得凝胶的杨氏模量均随质量分数增加而增加。SD-SPI 和FD-SPI 的杨氏模量分别从2.30 kPa和2.03 kPa 增加至3.87 kPa 和8.35 kPa;而HSDSPI 和HFD-SPI 则分别从5.97 kPa 和3.73 kPa 增加至9.95 kPa 和15.27 kPa。这表明,已经过水浴热处理制得SPI 可以获得具有更高硬度的热致凝胶。
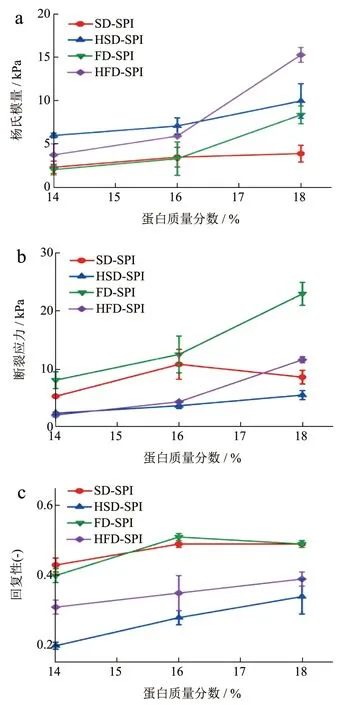
图5 四种SPI 不同质量分数(14%~18%)分散液经热处理制得凝胶的机械性能Fig.5 Mechanical properties of soy protein gels induced by heat treatment with various solid contents (14%~18%)
凝胶样品被压缩至断裂时对应的应力和应变与其韧性有关,凝胶在更大的应力和应变发生断裂表明其韧性更强。如图5b 和5c 所示,三个质量分数制得SD-SPI 凝胶的断裂应力分别为5.30、10.80 和8.59 kPa, 各FD-SPI 凝胶为8.09、12.50 和22.91 kPa;对应HSD-SPI 凝胶的断裂应力为2.39、3.69和5.52 kPa,HFD-SPI 凝胶的断裂应力为2.08、4.36和11.59 kPa。显然,以质量分数为14%和16%分散液制得SD-SPI 和FD-SPI 凝胶的韧性明显高于由HSD-SPI 和HFD-SPI 蛋白制得的凝胶样品。凝胶的回复性数据与其弹性有关,如图5d 所示。随着质量分数增加,SD-SPI 和FD-SPI 分别从0.43 和0.40增加至0.49 和0.49;对应的HSD-SPI 和HFD-SPI则分别从0.20 和0.31 增加至0.34 和0.39。与断裂应变和应力结果变化趋势相一致,前两者制得凝胶可以展示出更高的弹性,而由后两者制得凝胶的弹性较低。
对于一般蛋白基凝胶而言,其刚性和韧性的表现往往与蛋白质网络组装形成方式有关,是凝胶口感形成的两个不同的发展方向。前述结果表明,经过水浴热处理制得HSD-SPI 和HFD-SPI 具有更低的蛋白溶解度(图1),其中蛋白质多以聚集体形式存在(图2),其分散液具有更高的黏度(图4);当体系中蛋白质含量提高,这些聚集体在热处理过程中可能通过进一步缠绕形成凝胶网络,可以形成刚性较高、韧性和弹性较差的凝胶(图5)。未经水浴热处理制得SD-SPI 和FD-SPI 具有良好的水溶性(图1),其中蛋白质大多得以保留原有结构,其分散液黏度较低;这些蛋白质在热处理中经历了高级结构去折叠、聚集等过程,蛋白分子之间可以产生数量更多的相互作用位点(图2 和图3),形成相对有序的凝胶网络,从而赋予凝胶更强的韧性和弹性(图5),但所得凝胶的刚性弱于HSD-SPI 和HFDSPI 凝胶。可见,在SPI 制备过程中水浴热处理对制得SPI 的热聚集行为具有显著的影响,使其形成具有不同机械性能的凝胶。
就经过不同干燥方式获得SPI 进行比较,各样品的溶解度、高级结构、聚集行为及所成凝胶的机械性能没有显示出显著的差异。这表明,与冷冻干燥相比,喷雾干燥虽然涉及了对蛋白料液进行短时加热,但该操作未对所得SPI 的理化性质及功能特性带来显著的影响。
以上述质量分数为14%的大豆蛋白热致凝胶进行LF-NMR 分析,对凝胶中水分的状态进行考察,所得图谱如图6 所示。信号峰对应的弛豫时间(T2)与凝胶中水分和蛋白网络结合的紧密程度有关[28]。SD-SPI 和FD-SPI 凝胶在弛豫时间(T2)峰值分别在2.3、15.7 和126.0 ms 和1.48、18.0 和135.1 ms处出现了3 个明显的信号峰。其中,第3 个峰均为两个样品的主峰,峰面积分别占了总面积的97.9%和96.3%。这表明,这两凝胶样品的的水分大多处于不易移动的状态[28]。HSD-SPI 和HFD-SPI 凝胶则出现了四个信号峰。其中,相应的主峰分别出现在T2为117.0 ms 和126.0 ms,峰面积分别占比93.9%和94.4%。相对于前述SD-SPI 和FD-SPI 凝胶,这两样品的主峰变宽、峰面积占比减少。此外,两者分别在541.0 ms 和880.0 ms 处出现了第4 个小峰。这表明,HSD-SPI 和HFD-SPI 凝胶网络限制其中水分移动的作用有所减弱。这也反映了由于以蛋白聚集体缠绕形成凝胶网络与水分子相互作用亲水基团位点减少,其持水性有所下降[29]。而SD-SPI 和FDSPI 两者在热处理过程中以相对有序的方式发生聚集,凝胶网络的形成和其与水分子的相互作用相对更平衡,因而所成凝胶具有更好的持水性。

图6 四种SPI 样品分散液(质量分数为14%)经热处理制得凝胶的弛豫时间(T2)图谱Fig.6 Relaxation times (T2) of soy protein gels induced by heat treatment with fixed solid contents (14%)
3 结论
本研究对经SPI 制备常规采用的“碱溶酸沉”法收集获得大豆蛋白进行热处理,并采用喷雾干燥制备获得SPI,将其配制成不同质量分数的分散液,对其进行热处理,观察其聚集行为,并对其所成凝胶的机械性能和持水性,以此考察大豆蛋白分离制备过程中热处理和喷雾干燥对所得产品热致成胶性能的影响。结果表明,经过热处理制得的SPI 多以聚集体的形式存在,其溶解性显著低于未经过热处理制得的SPI;这些聚集体再次经历热处理时,并没有展现出进一步聚集并形成有序结构的趋势;其所成凝胶的硬度显著高于没有经过热处理制得的SPI 样品制备的凝胶,但其韧性和弹性则显著低于后者。相对于经过冷冻干燥制得的大豆蛋白,经喷雾干燥制得样品在溶解性、高级结构、聚集行为和凝胶性能等方面没有呈现出显著差异。可见,SPI制备过程中对大豆蛋白进行升温热处理是影响所得蛋白产品溶解性、聚集行为和凝胶性能的关键步骤。针对热处理对蛋白产品性质的负面影响,寻找替代的工艺方法,使所得产品既符合相关法规的要求,也能提高其品质和功能特性,最终拓展大豆蛋白产品在食品工业尤其是植物基食品中的应用。
