猪圆环病毒3型Cap蛋白单克隆抗体的制备及阻断ELISA检测方法的建立
2024-04-02张宝戈黄雅琴蔡金双朱晨光李玉峰
张宝戈,黄雅琴,蔡金双,朱晨光,李玉峰
(南京农业大学动物医学院,农业农村部动物细菌学重点实验室,南京 210095)
猪圆环病毒(porcine circovirus,PCV)是一种环状、单股负链DNA病毒,属于圆环病毒科圆环病毒属[1]。2016 年,Palinski等[2]在美国通过宏基因组分析,从患有 PNDS 的病死母猪和流产胎儿中首次发现 PCV3。其后,美国、中国、巴西、意大利、韩国、泰国、西班牙、丹麦、德国、瑞典和波兰等许多国家都出现了大量关于检测出 PCV3 的报道,表明该病毒已快速在全球范围内传播[3-5]。2017 年3月,广东省报道了我国首例 PCV3 感染病例,此后,在我国多个省份均有关于PCV3的报道[6-8]。除了在猪体中检测到PCV3外,在犬科动物和其他哺乳动物中也鉴定到PCV3的存在[9]。Cui等[10]提出PCV3起源于蝙蝠,鸟类是蝙蝠圆环病毒传播给猪的重要中间宿主,这种传播方式增加了跨物种传播的风险,影响到公共卫生安全。
PCV3的基因组总长为2 000 bp,包含三个主要开放阅读框(open reading frames,ORF),分别为ORF1、ORF2和ORF3。对不同国家PCV3分离株的基因序列分析显示,全基因组序列和衣壳蛋白(capsid protein,Cap蛋白)的核苷酸相似性分别为97.6%~99.8%和97.5%~100%,表明PCV3的序列高度保守[11]。进一步分析Cap蛋白的氨基酸序列可知,全球流行的PCV3毒株主要分为PCV3a、PCV3b和PCV3c三种亚型[5,11-12],其中PCV3a的流行率正在不断上升[13]。PCV3基因组中ORF2基因编码的Cap蛋白N端与其它圆环病毒一样,富含高度碱性的精氨酸残基,是猪圆环病毒的主要结构蛋白,能引发特异性免疫反应。因此,Cap蛋白是研发检测方法的首要候选因子。当前检测PCV3常用的方法主要包括PCR与ELISA,进一步使用IHC、原位杂交以及病理观察等加以佐证。已报道文献中ELISA方法以间接ELISA方法为主,但是该方法特异性较差,容易发生交叉反应。
本研究将PCV3的Cap蛋白基因进行原核表达,成功制备得到1株具有良好阻断效果的2E6单克隆抗体。在此基础上,建立了一种阻断ELISA方法,该方法具有较高重复性和特异性,为PCV3检测提供了一种有效的技术手段。
1 材料与方法
1.1 材料
SUMO-Cap重组质粒、PCV3-Cap真核质粒、PCV2-VLP以及PCV3杆状病毒液由本实验室制备与保存,猪圆环病毒3型(PCV3)、猪圆环病毒2型(PCV2)、猪伪狂犬病病毒(PRV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪瘟病毒(CSFV)等阳性血清以及猪阴性对照血清由本实验室保存。BALB/c小鼠和ICR小鼠订购于上海西普尔-必凯实验动物有限公司,羊抗鼠IgG-HRP购自Cell Signaling Technology,TMB显色液购自上海碧云天生物技术有限公司。
1.2 SUMO-Cap重组蛋白的表达与纯化
将SUMO-Cap重组质粒转化到Rosetta感受态细胞中,挑取单菌落摇菌至OD600nm值为0.4~0.6后,加入终浓度为1 mmol·L-1的IPTG进行诱导。16 ℃,150 r·min-1摇菌24 h后,收集菌体超声破碎并进行SDS-PAGE鉴定,确定蛋白表达在沉淀后用尿素透析法纯化,并将纯化后的蛋白进行Western blot鉴定。鉴定成功后,测定蛋白浓度,保存于-80 ℃。
1.3 单克隆抗体的制备、纯化与鉴定
用纯化后的SUMO-Cap重组蛋白100 μg·只-1免疫6~8周龄雌性BALB/c小鼠,3次免疫后再进行一次冲击免疫。取免疫后的小鼠脾细胞与骨髓瘤细胞SP2/0融合,进行3次亚克隆,采用间接ELISA方法进行筛选,获得阳性杂交瘤细胞株,将细胞扩大培养并制备腹水,将采集后的腹水送至南京钟鼎生物技术有限公司进行纯化与HRP酶标。用pCold-SUMO空载作为阴性对照,PCV2-VLP作为无关蛋白对照,进行Western blot鉴定。将PCV3-Cap真核质粒转染PK-15细胞,用制备的单抗作为一抗,进行间接免疫荧光(IFA)检测,以此来鉴定单抗的特异性。
1.4 阻断ELISA方法的建立与最佳反应条件的优化
根据方阵滴定法,以2、1.5、1.0、0.5、0.25 μg·mL-1蛋白浓度100 μL·孔-1进行抗原包被;抗原包被条件分为37 ℃ 2 h、4 ℃ 12 h以及37 ℃ 2 h转至4 ℃ 12 h三种方法;PBST洗3次,封闭液选择1%BSA、2%BSA、5%脱脂乳、2%明胶,200 μL·孔-1在37 ℃下进行封闭,封闭时间设置为1、2和3 h;PBST洗3次,阳性血清和阴性血清按照1∶1、1∶5、1∶10、1∶50进行稀释,100 μL·孔-1加入后,在37 ℃下作用时间分为0.5、1、1.5、2、2.5 h;PBST洗3次,酶标单抗按照1∶2 000、1∶2 500、1∶3 000、1∶3 500进行稀释,100 μL·孔-1加入后,在37 ℃下作用时间分为0.5、1、1.5、2 h;PBST洗3次,避光加入100 μL·孔-1的TMB,在37 ℃下作用时间分为5、10、15、20、25 min;显色结束后,加入50 μL·孔-1终止液。酶标仪测定OD450值,阻断率(PI)=(阴性血清OD450nm值-被检血清OD450nm值)/阴性血清OD450nm值×100%。
1.5 阻断ELISA方法临界值的确定
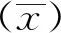
1.6 特异性试验
按照已经优化好条件的阻断ELISA方法检测猪圆环病毒3型(PCV3)、猪圆环病毒2型(PCV2)、伪狂犬病病毒(PRV)、猪繁殖与呼吸综合征病毒(PRRSV)和猪瘟病毒(CSFV)阳性血清,重复3次取平均值后计算PI,以此评判该方法的特异性。
1.7 敏感性试验
将3份PCV3阳性血清进行连续倍比稀释,用建立的阻断ELISA方法进行检测,以此评判该方法的敏感性。
1.8 重复性试验
使用同一批次包被的酶标板检测3份PCV3阳性血清,重复3次,计算批内变异系数。包被3批不同批次的酶标板,检测3份阳性血清,重复3次取平均值,计算批间变异系数。综合上述结果,评判该方法的重复性。
1.9 符合率试验
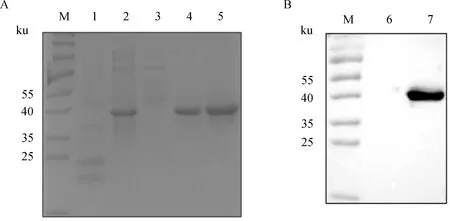
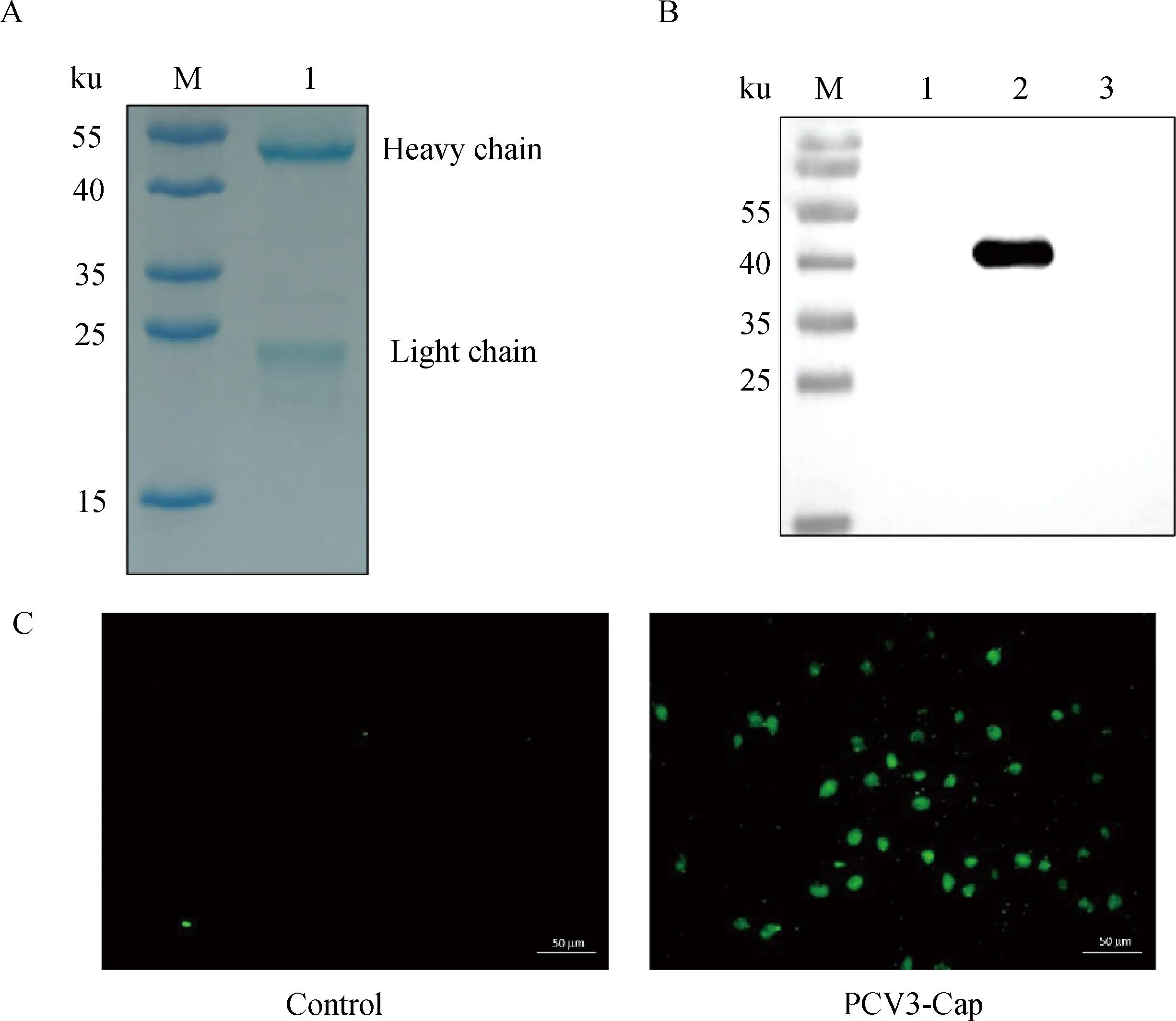
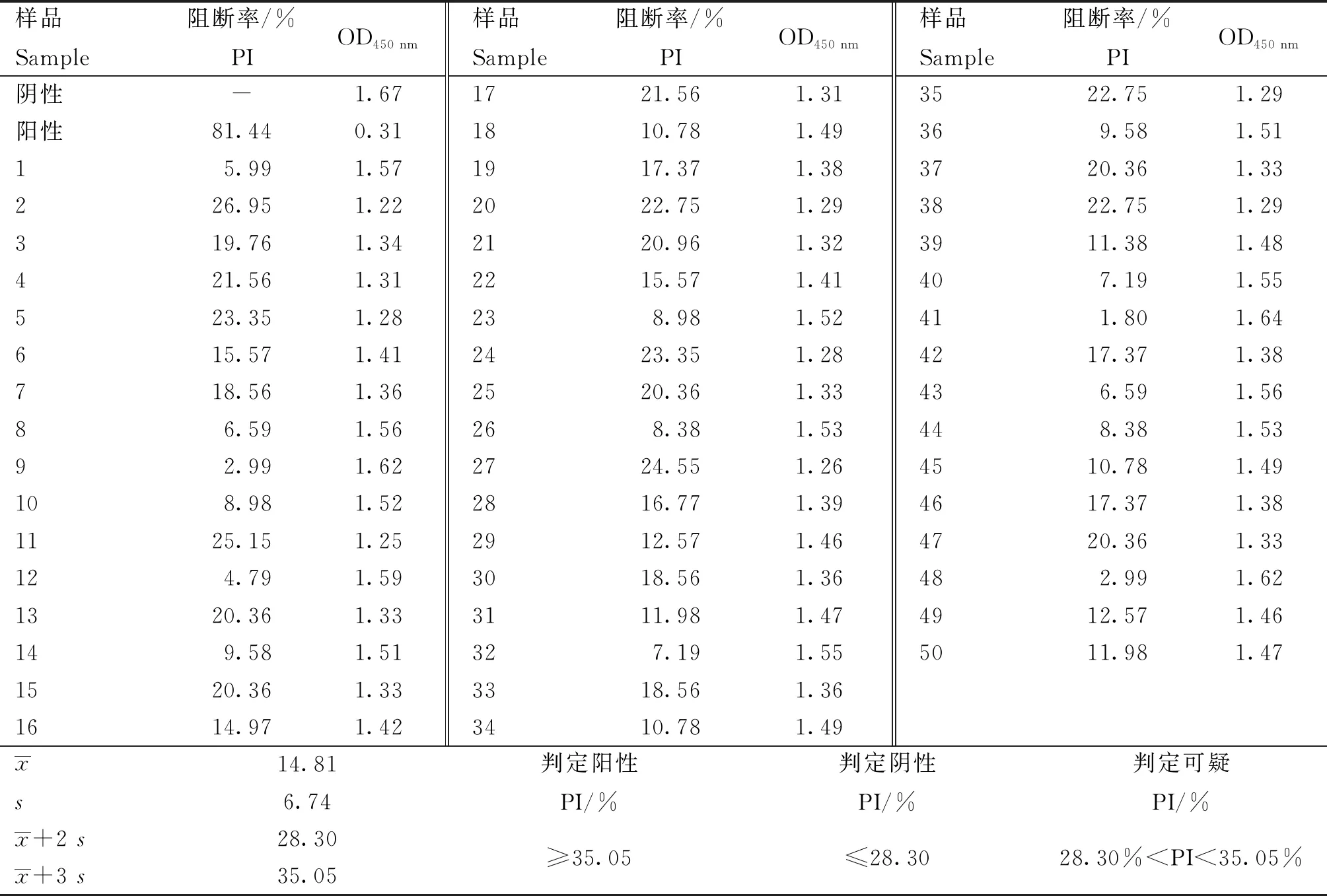
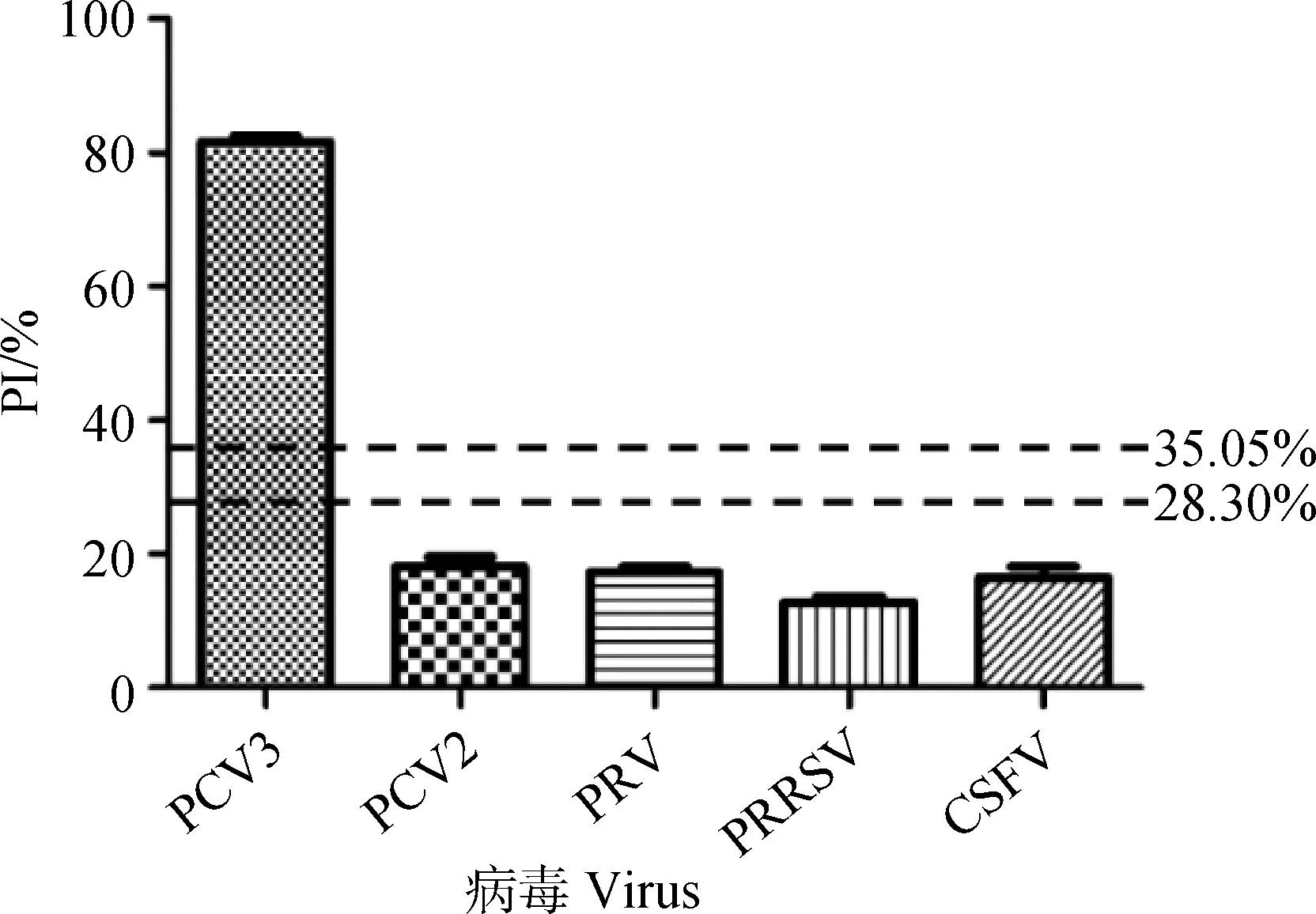
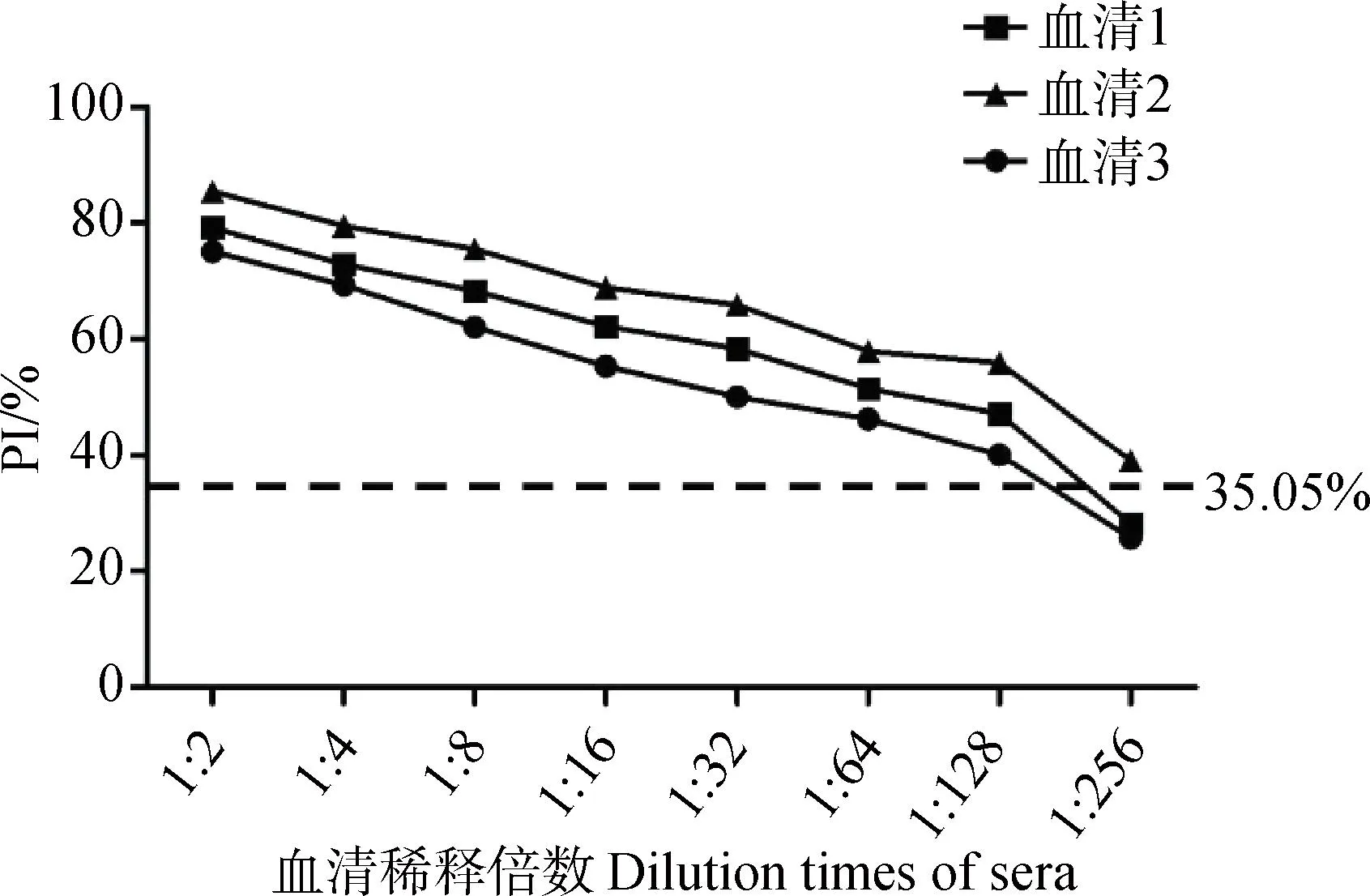
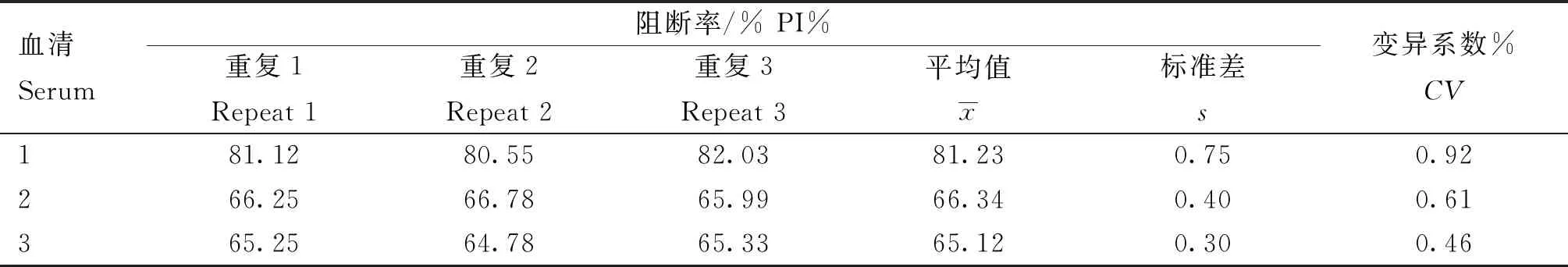
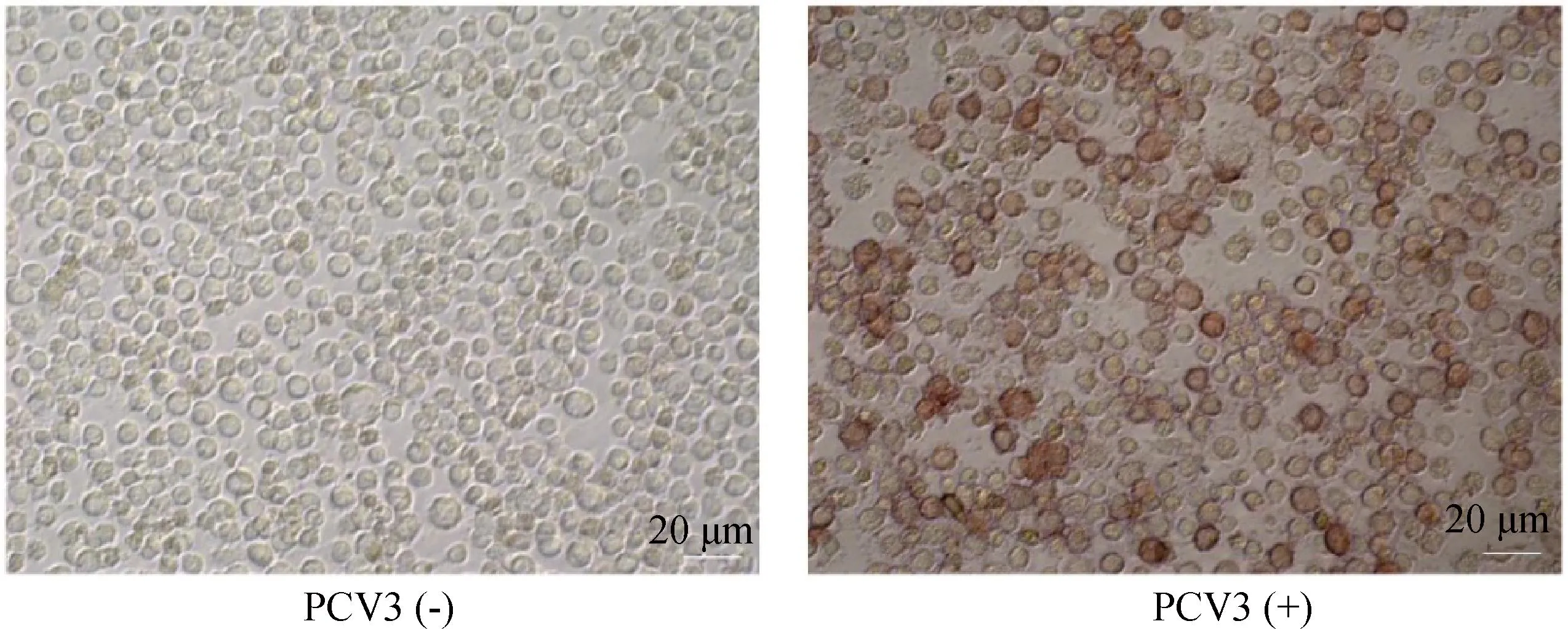
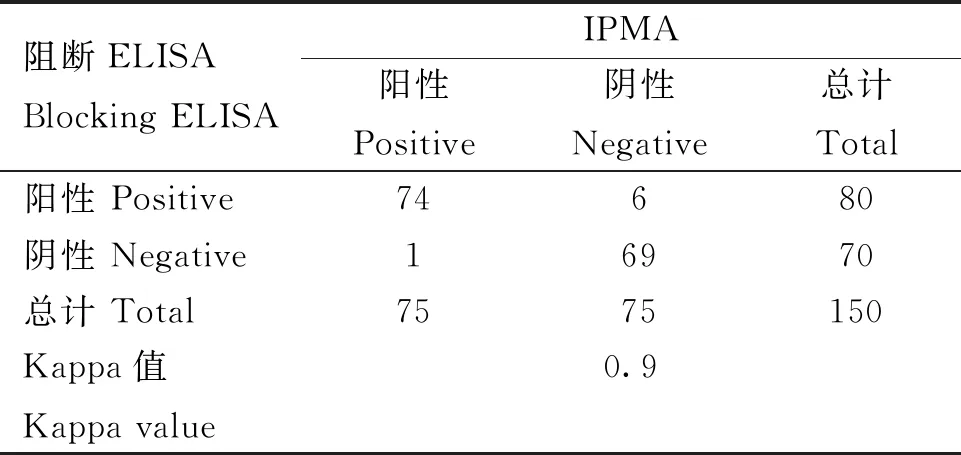
用本研究建立的阻断ELISA方法与IPMA方法相对比,检测150份猪血清样品,根据公式计算Kappa值。当0 SDS-PAGE结果显示,SUMO-Cap重组蛋白主要存在于包涵体中,经包涵体纯化后可得到纯度较高的蛋白,相对分子质量大小约为40 ku(图1A),与预期结果一致。Western blot结果表明,纯化后的重组蛋白可与PCV3猪源阳性血清发生特异性反应(图1B)。 M. 180 ku 蛋白相对分子质量标准; 1. 诱导后pCold-SUMO空载对照;2. 诱导后SUMO-Cap全菌对照;3. 超声破碎上清;4. 超声破碎沉淀;5. 纯化后SUMO-Cap重组蛋白;6. pCold-SUMO空载;7. 纯化后SUMO-Cap重组蛋白 M. 180 ku protein marker; 1. pCold-SUMO empty vector control after induction; 2. SUMO-Cap whole bacteria after induction; 3. Supernatant of sonication.; 4. Precipitation Supernatant of sonication; 5. Purified SUMO-Cap recombinant protein; 6. Production for pCold-SUMO empty vector; 7. Purified SUMO-Cap recombinant protein 多次亚克隆筛选后得到杂交瘤细胞株2E6,制备腹水使用ProteinA/G的方法纯化获得抗体(图2A)。Western blot结果表明,得到的单克隆抗体可与SUMO-Cap重组蛋白发生特异性反应(图2B)。IFA结果显示,2E6单克隆抗体与PCV3具有良好的反应性(图2C)。 A.抗体纯化效果(M. 180 ku蛋白质相对分子质量标准;1. 纯化后的2E6单抗);B.抗体Western blot鉴定(M.180 ku蛋白质相对分子质量标准;1. pCold-SUMO空载;2. 纯化后SUMO-Cap重组蛋白;3. PCV2-VLP);C.2E6单抗IFA鉴定(400×)A.Purification of mAb (M. 180 ku protein marker; 1. Purified 2E6 mAb); B. Identification of mAb by Western blot (M.180 ku protein marker; 1. pCold-SUMO empty vector; 2. Purified SUMO-Cap recombinant protein; 3. PCV2-VLP); C. Identification of monoclonal antibody to 2E6 by IFA (400×) 通过不断优化阻断ELISA的反应条件,确定了最佳条件如下:抗原包被浓度为0.5 μg·mL-1,包被条件为37 ℃ 2 h转至4 ℃ 12 h;最佳封闭剂为5%脱脂乳,封闭条件为37 ℃ 3 h;血清稀释度为1∶1,反应条件为37 ℃ 2.5 h;酶标单抗最佳稀释度为1∶3 000,反应条件为37 ℃ 1 h;TMB的最佳反应条件为37 ℃ 15 min。 表1 阻断ELISA临界值的确定 使用本试验中建立好的阻断ELISA方法检测PCV3、PCV2、PRV、PRRSV和CSFV抗体阳性血清,结果如图3所示,PCV3阳性血清的PI值为83.12%,其他病原的阳性血清PI值均小于28.30%,由此说明该方法的特异性较好。 图3 阻断ELISA特异性检验Fig.3 Results of the specificity test for blocking ELISA 将3份PCV3阳性血清进行倍比稀释,按照已经优化好的阻断ELISA方法进行检测,结果如图4所示,检测效价可达到1∶128。 图4 阻断ELISA敏感性检验Fig.4 Results of the sensitivity test for blocking ELISA 使用建立好的阻断ELISA方法检测3份PCV3阳性血清,进行批内和批间重复,结果如表2、3所示,批内变异系数为0.46%~0.92%,批间变异系数为1.29%~4.11%,两者的变异系数均小于10%,说明该方法具有良好的重复性。 表2 阻断ELISA的批内重复试验结果 表3 阻断ELISA的批间重复试验结果 2.8.1 IPMA法检测PCV3阳性血清 将PCV3杆状病毒液感染Sf9细胞48 h后,待检临床猪血清作为一抗,二抗使用HRP标记的羊抗猪酶标二抗,用AEC法显色。如图5所示,不显色说明血清为阴性,显红色说明血清为阳性。 图5 IPMA法检测PCV3血清Fig.5 Detection of PCV3 serum by IPMA method 2.8.2 比对试验 使用本研究中优化后的阻断ELISA方法,与本实验室前期建立的IPMA方法同时检测150份猪血清样品,根据公式计算Kappa值,结果如表4所示,与IPMA方法比对,计算得到的Kappa值为0.9。该阻断ELISA方法与IPMA方法比对后的Kappa值大于0.75,说明该方法具有良好的符合率。 表4 比对试验结果 当猪体感染PCV3后,据文献报道主要损伤的是呼吸与消化系统[7,14]。与此同时,会引起肠道微生物群的动态变化,破坏了菌群的平衡,其次伴随着渗出性皮炎等症状[15-16]。PCV3存在垂直传播,会穿过胎盘屏障并且在胎儿的组织内复制,产生较高的病毒载量,甚至导致怀孕母猪出现死胎与木乃伊胎[17-20]。PCV3持续性病毒血症的出现,增加了再次感染的可能性,虽然病毒可能在猪体内长时间存在,但却不会表现出明显的临床症状[11,21-23]。不同阶段的猪均可以检出PCV3,在木乃伊胎儿中的比例最高,该病毒可能是导致繁殖失败的原因之一[24-25]。研究表明,PCV3可感染多种动物,不只局限于猪[9]。由于该病毒存在众多的中间宿主,此特性也为其在种间传播提供了可能,将对养猪业的健康发展造成了巨大的威胁。 在临床检测中,PCV3会出现病毒血症,部分猪体在咽拭子与肛门拭子中也可检出PCV3阳性[26]。关于PCV3病毒载量的测定,淋巴结中的病毒载量明显高于肺和其他组织[4]。该病毒具有广泛的组织嗜性,使用免疫组织化学法(IHC),可在感染PCV3猪体的肾、肺以及淋巴结中观察到病原的位置[27-28]。当前检测PCV3常用的方法有PCR、ELISA、IHC、原位杂交以及组织病理学观察等[29-30]。 目前,尚无有效预防PCV3感染的相关疫苗以及治疗药物,这为防范PCV3的感染增加了难度[31]。加强猪场的日常管理与环境卫生是预防PCV3的主要手段,做到尽早发现并快速阻止病毒的进一步扩散[32]。因此,实时监测临床中PCV3的流行情况,持续分析相关分子流行病学动态变化是至关重要的。本研究中的重组蛋白有大规模可获得性且操作简便等优点,将重组蛋白免疫BALB/c小鼠制备获得了一株分泌阻断效果良好抗体的杂交瘤细胞株2E6,以此制备腹水得到的单克隆抗体具有构象表位,可识别具有空间结构的PCV3病毒粒子,为后期对PCV3的深入研究提供了有利的条件。此外,市面上并没有特异性较好的商品化阻断ELISA抗体检测试剂盒,本研究中建立的方法特异性较高,与PCV2、PRV、PRRSV、CSFV抗体阳性血清均不发生反应;具有可重复性,批内变异系数为0.46%~0.92%,批间变异系数为1.29%~4.11%,两者的变异系数均小于10%;该方法与IPMA方法比对后的Kappa值均大于0.75,说明该方法具有良好的符合率;能够快速检测出PCV3抗体的存在,可应用于猪场的日常管理中。与此同时,应该尽快开发出针对性强的疫苗,不断提高对PCV3的防控,减少养殖过程中引发的经济损失。 本研究成功筛选到1株具有良好阻断效果的猪圆环病毒3型Cap蛋白单克隆抗体,并在此基础上建立了一种具有较高重复性和特异性的阻断ELISA检测方法,为临床PCV3流行病学调查提供了技术支撑。2 结 果
2.1 目的蛋白的纯化与鉴定
2.2 单克隆抗体的纯化与鉴定
2.3 阻断ELISA最佳反应条件的优化
2.4 临界值的确定
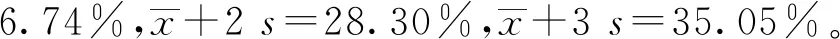
2.5 特异性检验
2.6 敏感性检验
2.7 重复性检验
2.8 符合率检验
3 讨 论
4 结 论
