育雏育成期饲粮添加益生菌对蛋鸡生长性能、血清指标、肠道健康及后续生产性能的影响
2024-04-02齐梦迪张克英王建萍白世平曾秋凤彭焕伟丁雪梅
李 铁,齐梦迪,张克英,王建萍,白世平,曾秋凤,彭焕伟,玄 月,吕 莉,丁雪梅
(四川农业大学动物营养研究所 教育部动物抗病营养重点实验室 动物抗病营养与饲料农业农村部重点实验室动物抗病营养四川省重点实验室,成都 611130)
蛋鸡完整的生命周期包括三个阶段,育雏期、育成期和产蛋期,其中育雏期和育成期是最细致的一个阶段,维持此阶段肠道健康对蛋鸡的生长发育及后续生产具有重要作用。在饲料端“禁抗”的背景下,益生菌在畜牧生产中的应用引起了广泛关注。枯草芽孢杆菌(BS)属于革兰阳性菌,它能够产生内生芽孢,具有优异的抗逆性,能够承受高压、高温并且易于储存,可促进营养物质吸收、增强机体免疫性能及改善肠道环境[1-3]。屎肠球菌(EF)也是一种革兰阳性菌,属乳酸菌类,具有较强的黏附定植能力及耐药性和抗菌性,可促进营养物质消化吸收,改善肠道微生态及提高机体免疫能力[4-5]。两种及以上的复合菌摄入动物体内,可以丰富畜禽肠道菌群多样性,促进肠道健康,不同的益生菌在宿主肠道内定植,可能产生不同益生元及有益物质,进而能提高畜禽生产性能[6]。目前,在肉鸡上已有较多关于益生菌单独或联合添加的研究,但育雏育成期作为蛋鸡肠道微生态环境构建和完善的关键阶段,益生菌的使用对育雏育成期蛋鸡的影响研究较少,且育雏育成期益生菌的使用对后续生产性能的影响也尚不清楚。因此,本试验旨在研究饲粮添加BS和EF对蛋鸡育雏育成期生长性能、血清生化和肠道健康的影响以及育雏育成期饲喂效果对后续生产性能的影响,以期为生产实践提供参考。
1 材料与方法
1.1 试验材料
枯草芽孢杆菌(BS)有效活菌数含量为3×1010CFU·g-1、屎肠球菌(EF)有效活菌数含量为2×109CFU·g-1,均购自潍坊某生物科技有限公司。
1.2 试验设计
采用2×2因子完全随机试验设计,饲粮中BS添加量包括两个水平(0或200 mg·kg-1),EF添加量包括两个水平(0或200 mg·kg-1),共4个处理,每个处理6个重复,每个重复22只鸡,共528只1日龄体重相近的罗曼粉蛋鸡。试验期30周,试验育雏育成期1~20周进行试验处理,产蛋期21~30周所有组饲喂基础饲粮,不进行益生菌处理。
1.3 基础饲粮和饲养管理
试验在四川省雅安市四川农业大学教学科研基地进行。育雏期雏鸡采用三层笼养模式,每两个相邻鸡笼为1个重复,各重复位于不同的笼位,均匀分布于鸡舍,育雏舍鸡笼长宽为80 cm×50 cm,笼高40 cm。育成阶段蛋鸡转移至育成舍,采用两层笼养模式,育成舍鸡笼长宽为90 cm×80 cm,笼高40 cm,每两个相邻鸡笼为1个重复,产蛋期转移至蛋鸡舍,根据蛋鸡舍管理流程进行,饲养期间自由饮水。饲养管理措施依据罗曼粉蛋鸡饲养手册(2018)进行。依据罗曼粉蛋鸡饲养手册(2018)将饲粮划分为5个阶段:育雏阶段(1~8周)饲粮分为幼雏料(1~3周)和中雏料(4~8周);育成期(9~20周)分为育成前期料(9~17周)和开产前料(18~20周)。益生菌直接添加到1~20周基础饲粮中,添加量根据公司推荐剂量添加。本试验采用粉料,具体基础饲粮组成及营养水平见表1。
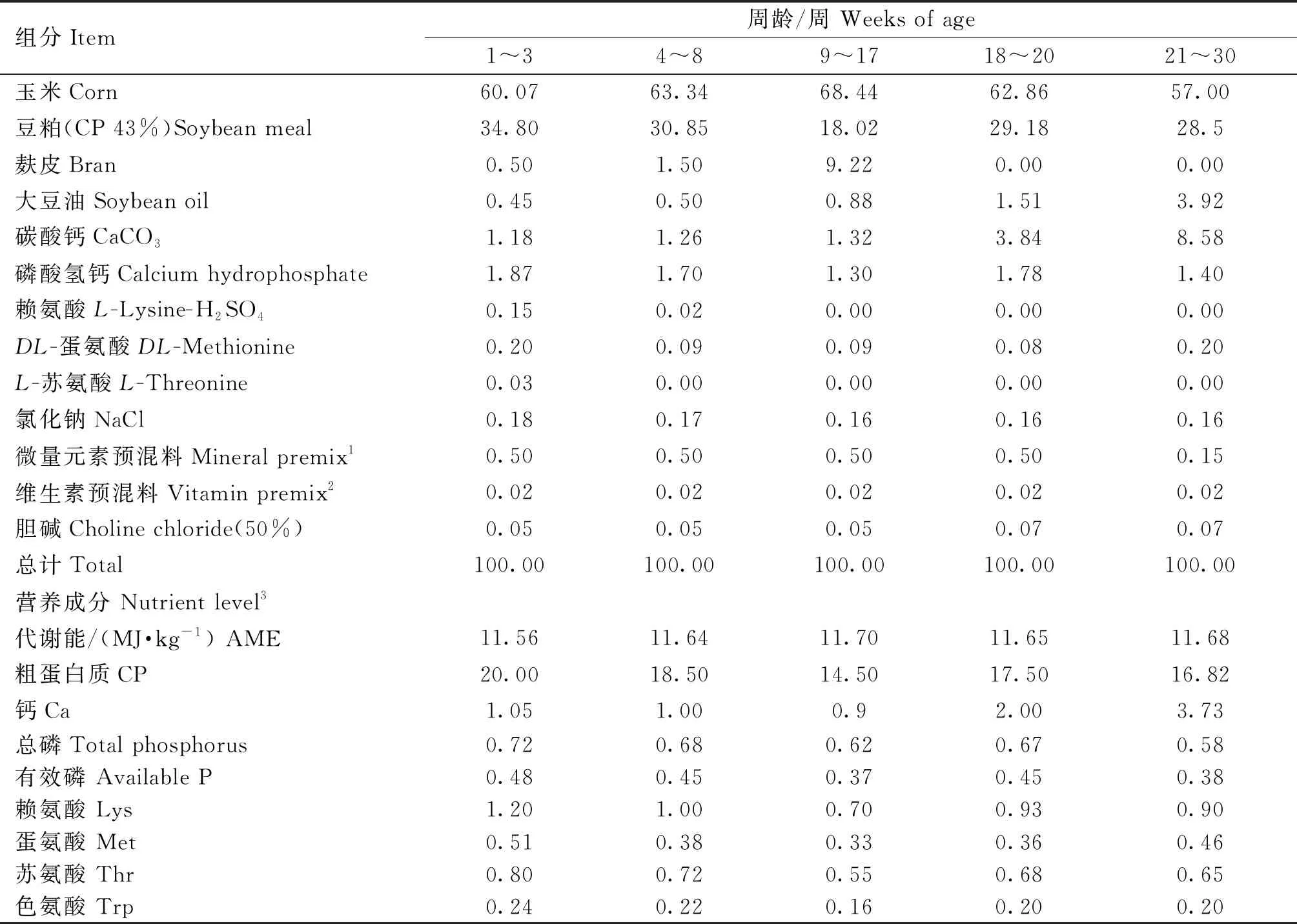
表1 基础饲粮组成及营养水平(风干基础)
1.4 样品采集
1.4.1 血清样品 试验20周结束时,每个重复选取1只接近平均体重的鸡,静脉采血10 mL,分装于不抗凝的采血管中,3 500 r·min-1、15 min分离血清,将上层血清分装入无菌EP管中,-20 ℃保存备测。
1.4.2 肠道样品采集 将采血鸡处死后,立即分离十二指肠、空肠、回肠肠段,十二指肠、空肠、回肠去除内容物称重并测量自然长度。取十二指肠、空肠、回肠中部2 cm,用生理盐水将肠道食糜冲洗干净,置于4%多聚甲醛溶液中,进行肠组织切片制作及观察。随后用载玻片轻轻刮取空肠黏膜,置于EP管中,-80 ℃保存,待测。
1.5 测定指标及方法
1.5.1 生长性能 试验期间,记录鸡只死淘情况并及时称重。试验20周结束时,提前断食8 h,正常供水,以重复为单位称重并记录耗料量,计算1~20周蛋鸡平均体重(BW)、平均体增重(BWG)、平均采食量(AFI)和料重比(F/G)
1.5.2 血清生化指标 使用自动生化分析仪(日立3100)测定蛋鸡20周血清中总蛋白(TP)、白蛋白(ALB)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、总胆固醇(TC)、甘油三酯(TG)含量、碱性磷酸酶(ALP)、谷草转氨酶(AST)和谷丙转氨酶(ALT)的活性。
1.5.3 血清生长相关激素 采用酶免鸡用ELISA试剂盒(由江苏酶免实业有限公司提供)结合酶标分析仪(Rayto RT-6 100)测定蛋鸡20周血清生长激素(GH)、生长激素受体(GHR)、胰岛素样生长因子-Ι(IGH-Ι)的水平。
1.5.4 肠道相对长度及重量 计算蛋鸡20周的十二指肠、空肠、回肠的相对重量和长度。计算公式为:相对重量=绝对重量/活重(g·kg-1);相对长度=绝对长度/活体重(cm·kg-1)。
1.5.5 肠道形态 十二指肠、空肠和回肠切片进行肠组织切片制作及观察(送检四川扬克斯特科技有限公司)。将用10%中性甲醛溶液固定好的肠段用乙醇脱水,二甲苯透明,石蜡包埋进行切片,然后用苏木精-伊红(HE)染色,显微成像系统进行拍照,采用Image Pro Plus 6.0对组织中10个完整绒毛高度(VH)及相对应的10个隐窝深度(CD)进行测量,统计出平均值并计算绒毛高度/隐窝深度(VH/CD)。
1.5.6 空肠黏膜屏障基因表达 测定空肠黏膜屏障ZO-1、Occludin和Claudin-1基因mRNA相对表达量,具体操作步骤及计算方法参照本课题组张琦等[7]的方法。反应程序为:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 34 s,40个循环;95 ℃ 15 s,65 ℃ 1 min,95 ℃ 15 s。目的基因的 mRNA 相对表达量采用2-ΔΔCt计算。引物序列交予成都生工生物工程有限公司合成,引物设计见表2。

表2 相关基因与引物信息
1.5.7 生产性能 在21~30周产蛋期每天16:00拣蛋,记录每个重复的产蛋个数、总蛋重、大小蛋、破蛋数、软蛋数、脏蛋数、合格蛋数[ 除去沙壳蛋、软蛋、破蛋、畸形蛋、脏蛋、大蛋(> 75 g)、 小 蛋(<40 g)]、合格蛋重以及死淘情况,记录每周的耗料量。参照《家禽生产性能名词术语和度量统计方法》(NY/T 823—2004)计算平均日采食量(ADFI)、产蛋率、合格蛋率、平均蛋重和料蛋比。计算公式如下:
产蛋率(%)=(产蛋数/鸡只数)×100;
合格蛋率(%)=(合格蛋数/总产蛋数)×100;
平均蛋重(g)= 总蛋重/产蛋数;
料蛋比= 采食量/总蛋重;
平均日采食量(g·只-1)= 耗料量(g)/
实际饲养日蛋鸡只数的累加只数。
1.6 数据统计
数据采用EXCEL 2010初步整理,随后采用SAS 9.0软件GLM程序进行双因素分析,模型主效应包括枯草芽孢杆菌和屎肠球菌及交互作用,当方差分析显著时,采用Duncan’s方法进行多重比较检验。数据以平均值和SEM进行表示,P<0.05表示差异显著。
2 结 果
2.1 育雏育成期饲粮添加BS和EF对蛋鸡生长性能的影响
由表3可知,添加BS和EF对蛋鸡BW、BWG、AFI、F/G均无显著影响(P>0.05)。BS和EF对蛋鸡F/G存在极显著交互作用,联合添加显著提高了F/G(P<0.01)。
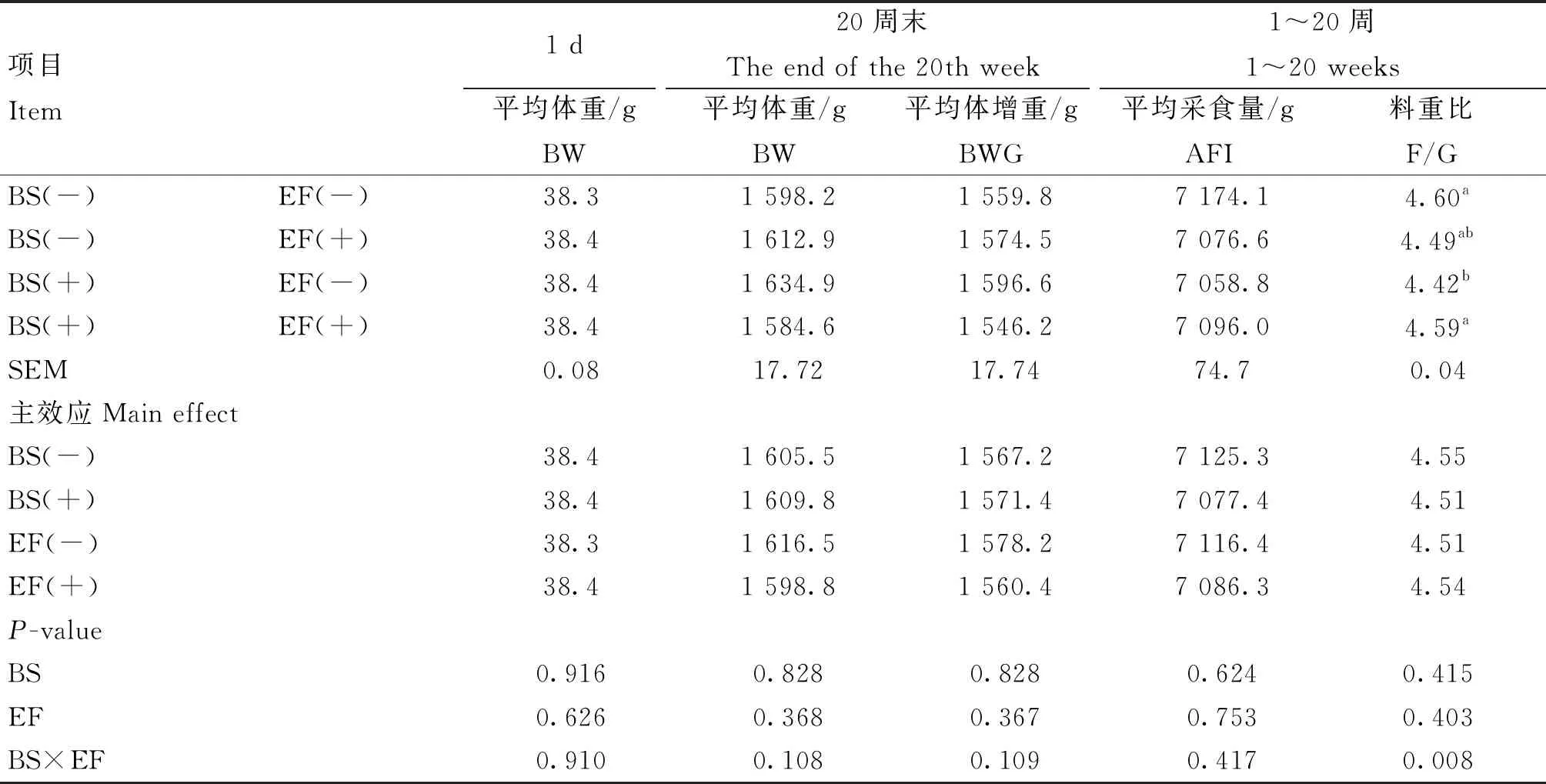
表3 育雏育成期饲粮添加BS和EF对蛋鸡生长性能的影响
2.2 育雏育成期饲粮添加BS和EF对蛋鸡血清生化的影响
由表4可知,添加BS有降低血清ALT含量的趋势(P=0.067);添加EF对蛋鸡血清生化无显著性影响(P>0.05)。根据交互效应结果可知,联合添加显著降低了蛋鸡血清TP、HDL-C、TC的含量(P<0.05)。
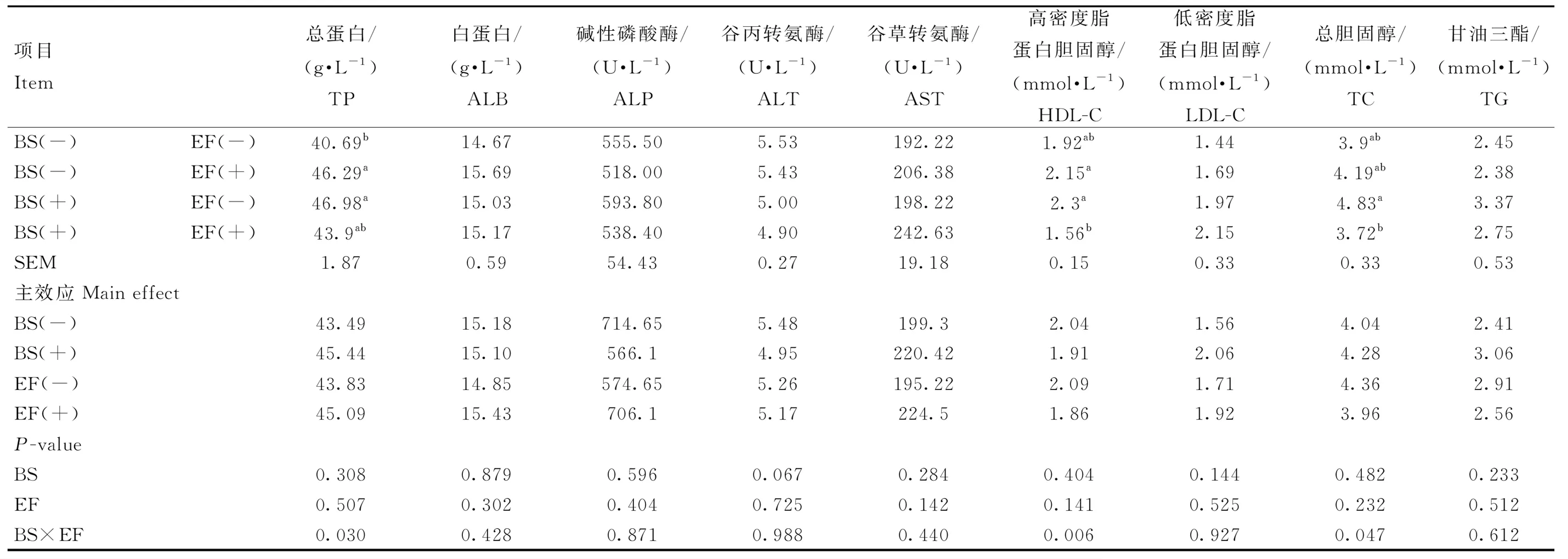
表4 育雏育成期饲粮添加BS和EF对蛋鸡血清生化的影响
2.3 育雏育成期饲粮添加BS和EF对蛋鸡血清生长激素的影响
由表5可知,添加BS对蛋鸡血清GH、GHR和IGF-Ⅰ无显著影响(P>0.05);添加EF有提高血清GH的趋势(P=0.078)。添加BS和EF对蛋鸡生长激素无显著交互作用(P>0.05)。
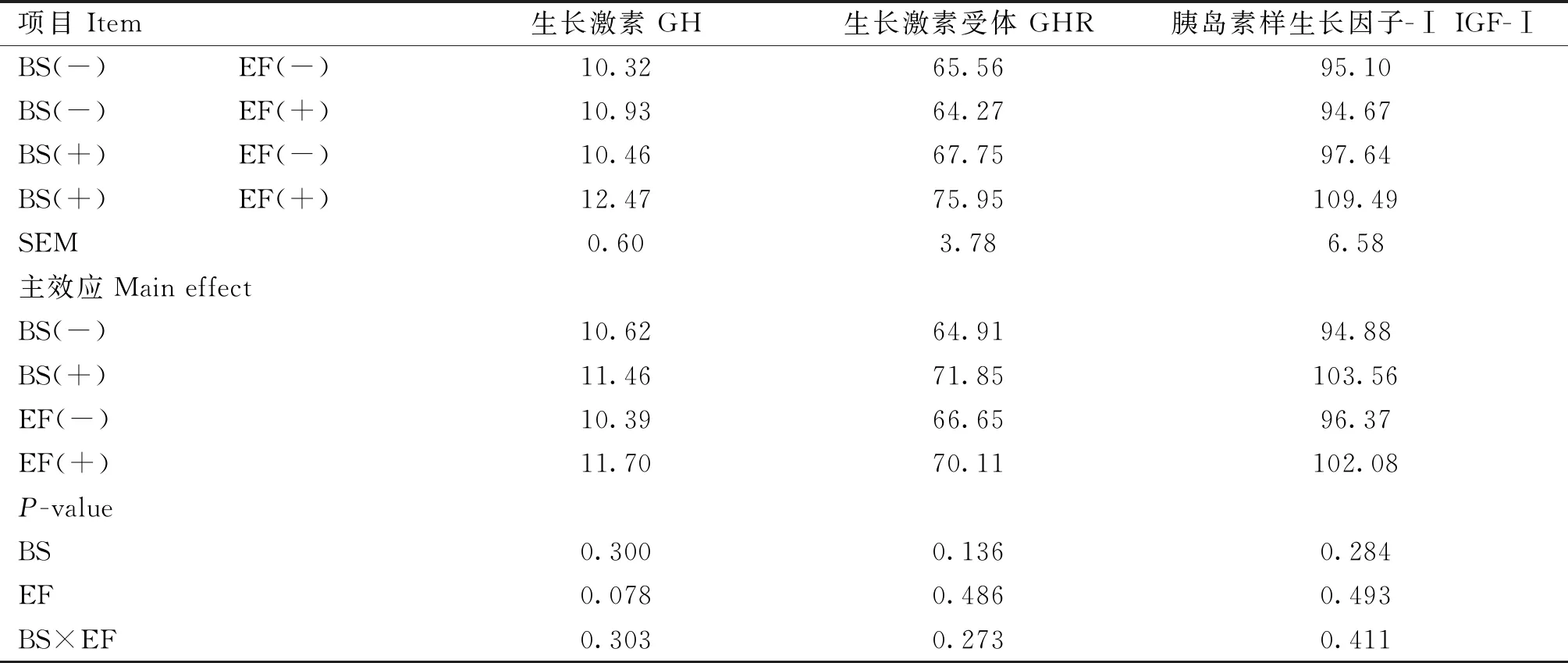
表5 育雏育成期饲粮添加BS和EF对蛋鸡生长激素的影响
2.4 育雏育成期饲粮添加BS和EF对蛋鸡肠道相对长度及重量的影响
由表6可知,添加BS和EF均显著提高了回肠的相对长度(P<0.05)。添加BS和EF对肠道相对长度和重量无显著交互作用(P>0.05)。
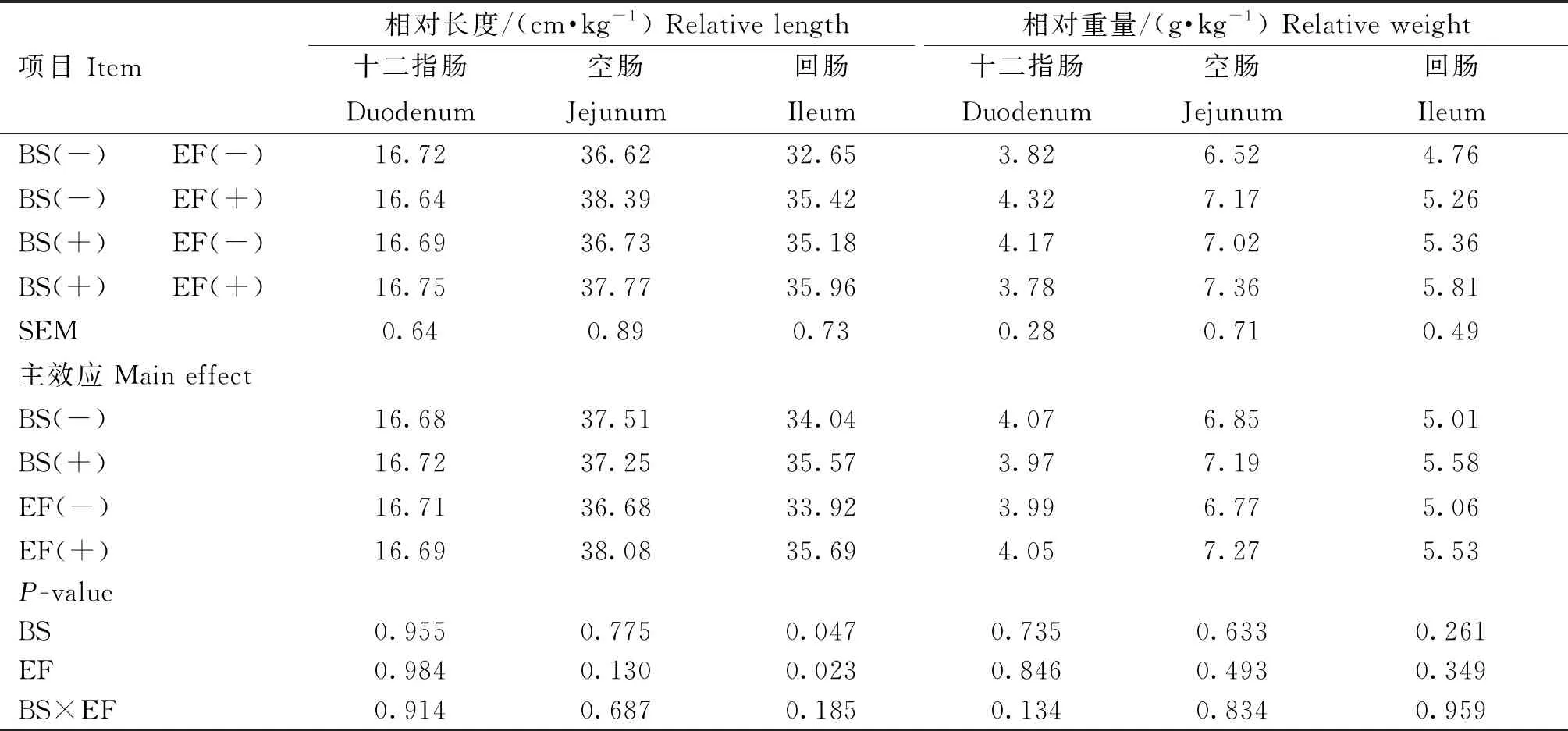
表6 育雏育成期饲粮添加BS和EF对蛋鸡肠道生长发育的影响
2.5 育雏育成期饲粮添加BS和EF对蛋鸡肠道形态的影响
由表7可知,添加BS有提高空肠绒毛高度(P=0.051)和提高隐窝深(P=0.069)的趋势;添加EF显著提高了空肠绒毛高度(P<0.05),有提高空肠CD的趋势(P=0.072)。添加BS和EF对蛋鸡肠道形态无显著交互作用(P>0.05)。
2.6 育雏育成期饲粮添加BS和EF对蛋鸡肠道屏障基因相对表达的影响
由表8可知,添加BS显著提高了空肠黏膜Occludin基因的相对mRNA表达量(P<0.05),有提高Claudin-1基因相对mRNA表达量的趋势(P=0.081);添加EF对空肠黏膜屏障基因相对mRNA表达无显著影响(P>0.05)。添加BS和EF对肠道屏障基因表达无显著交互作用(P>0.05)。
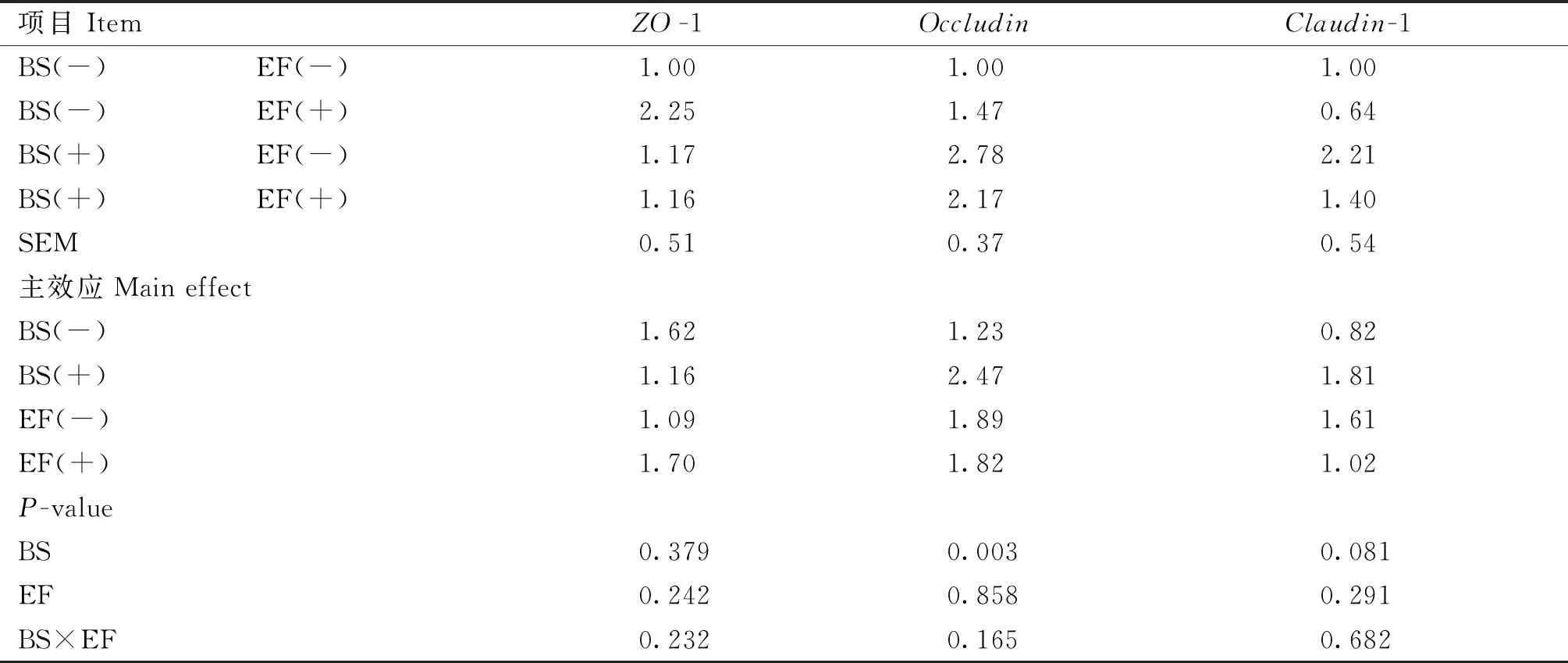
表8 育雏育成期饲粮添加BS和EF对蛋鸡肠道屏障基因表达的影响
2.7 育雏育成期饲粮添加BS和EF对蛋鸡产蛋期生产性能的影响
由表9可知,添加BS有提高21~30周平均蛋重的趋势(P=0.077),而添加EF对蛋鸡生产性能无显著影响(P>0.05)。添加BS和EF对蛋鸡21~30周生产性能无显著交互作用(P>0.05)。
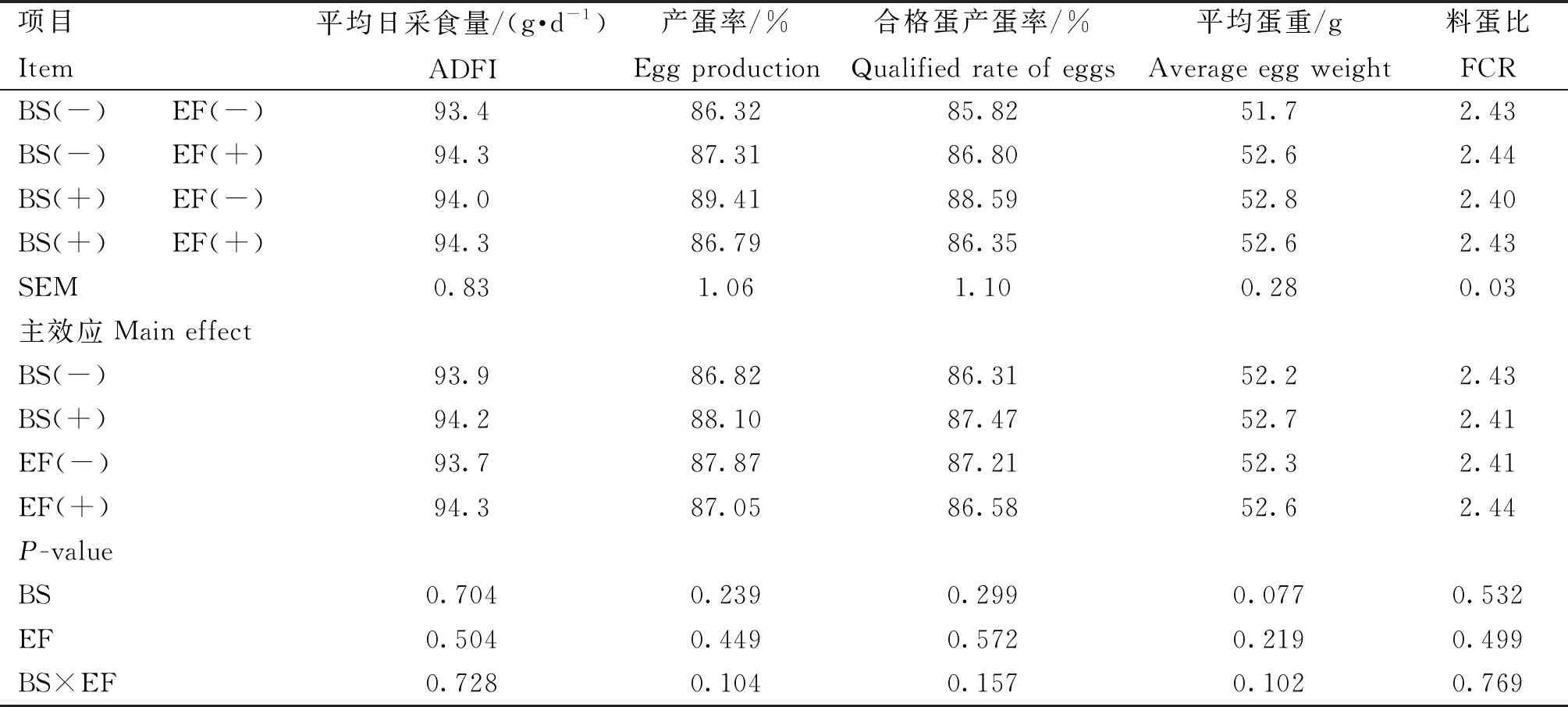
表9 育雏育成期饲粮添加BS和EF对蛋鸡21~30周生产性能的影响
3 讨 论
3.1 育雏育成期饲粮添加BS和EF对蛋鸡生长性能的影响
蛋鸡开产前的体重对蛋鸡产蛋期生产性能的发挥具有重要决定作用,目前益生菌对动物生长性能的影响研究较多,但结果不尽一致。孙玲玲等[8]研究发现,饲粮中添加BS显著提高了五龙鹅雏鹅28 d BWG,降低了F/G;张雪等[9]研究发现,添加BS可显著降低肉鸡21~42 d和1~42 d F/G;袁文菊等[10]研究发现,饲粮中添加BS显著降低了1日龄肉鸡1~21 d和1~35 d的F/G。本研究发现,添加BS对蛋鸡生长性能无显著影响,但与其他组相比,添加BS组有较低的F/G,以及较高的BW和BWG。这与前人研究结果类似,说明BS可以促进的蛋鸡的生长性能,原因可能是BS进入畜禽肠道后,在肠道进行定植,消耗肠道内多余的游离氧,改善肠道微生态,促进肠道有益菌增殖,减少有害菌定植,并且BS本体及其在肠道内的代谢产物可以产生与消化有关的酶类,例如淀粉酶、蛋白酶、脂肪酶等,从而提高饲料转化效率,提高生长性能。BS组在本试验中相较于其他组,具有较高的开产前BW,差异不显著,在开产后同样具有较高的产蛋率,差异不显著。说明开产前BW也会影响蛋鸡开产后产蛋性能。前人关于EF在家禽生长性能的研究上得到了不同的结果,燕磊等[11]研究发现,EF对1~41 d肉鸡BW、ADG、F/G及平均日采食量无显著影响,但都有所提高。韩鹏敏等[12]在乳鸽上的研究发现,EF单独添加可以提高乳鸽12~28 d平均日增重,BS和EF混合添加对平均日增重无显著影响。彭众等[13]发现,与对照组相比,添加EF或抗生素试验组肉鸡ADFI、ADG及FCR均无显著差异。本研究发现饲粮中添加EF对蛋鸡生长性能无显著影响,与前人研究结果类似,EF对畜禽生长性能的影响结果不同可能与试验动物差异、菌株差异以及添加量有关。本研究BS和EF联合使用显著增加了料肉比。李修宇[14]研究发现,在灵山土鸡饲粮中添加2.56×105CFU·kg-1丁梭酸菌,其21 d平均体重相较于添加复合菌(2.56×105CFU·kg-1丁梭酸菌;6.44×106CFU·kg-1枯草芽孢杆菌)和空白对照组,提高了0.4%和0.3%,单独添加的效果好于两种菌联用。同样地,韦区[15]研究发现,在笼养模式下,与复合益生菌组相比,单独添加益生菌提高了50 d三黄鸡末体重2.57%。其原因可能是BS和EF均定植于后肠道,两者联用添加量导致某一段肠道内含有过多的活性菌从而导致肠道菌群结构失衡,并且大量活性菌繁殖,额外消耗了肠道部分营养物质,从而导致仔鸡生长性能较差[16]。
3.2 育雏育成期饲粮添加BS和EF对蛋鸡血清生化的影响
血清生化指标可以反映动物新陈代谢的具体情况。血清中谷草转氨酶(AST)和谷丙转氨酶(ALT)可以反映出肝的损伤情况,当肝受到损伤时,血液中ALT和AST含量会显著升高。本研究发现,饲粮添加BS有降低ALT的趋势。史燕云等[17]在蛋鸡上的研究表明,添加BS显著降低了蛋鸡血清碱性磷酸酶(ALP)和ALT活性。李安东等[18]研究发现,添加BS、丁酸梭菌及其组合与对照组相比可以显著降低血清ALT、AST的含量。本研究与前人结果基本一致,其原因可能是,在本试验中BS可以通过提高血清中TP的浓度,提高机体免疫水平,从而提高肝细胞的解毒功能,对肝组织起到了保护作用[19]。
血浆TG、TC、HDL和LDL的含量可以直观反映出动物机体的脂代谢情况,本研究中,联合添加显著降低了血清TC的水平。Capcarova等[20]指出,在ISA棕鸡饲粮中添加EF显著降低了血清TC含量。Kurtoglu等[21]研究发现,与对照组相比,添加BS显著降低了血清TC和蛋黄TC的水平。本研究与前人研究一致,说明益生菌两者联合具有促进机体脂质代谢的作用,益生菌可能抑制TC合成过程中的关键酶羟甲基戊二酸单酰辅酶A的活性来抑制TC沉积[22]。本研究发现,联合添加益生菌,降低了血清HDL-C的含量。彭众等[13]研究发现,饲粮中添加EF显著提高了肉鸡血清HDL-C,降低了LDL-C。任跃昌等[23]研究发现,添加BS显著降低了蛋鸡血清HDL-C。前人关于益生菌对血清HDL-C的影响得到了不同的结果,造成差异的原因可能与动物品种、微生态制剂及使用量不同有关,这也可能是本研究中两种益生菌联合添加生长性能较差的原因。
血浆TP和ALB的含量能够反映机体对蛋白质的吸收和代谢水平及机体免疫情况。本研究发现,两种益生菌联合添加降低了血清TP的含量,而添加BS和EF对血清TP含量有一定程度提高,差异不显著。丁浩等[24]研究发现,BS可以提高保育猪生长性能,并且显著增加了血浆TP含量。申杰等[25]研究发现,EF可以显著提高42 d肉仔鸡血清TP、ALB和球蛋白含量。叶枝林[26]研究发现,饲粮添加EF著提高了42 d肉鸭血清TP和ALB水平。本研究与前人结果类似,提示饲粮中添加益生菌可以促进机体对蛋白质消化吸收的能力,改善机体营养水平及提高免疫力[27]。而本研究两种益生菌联用降低了血清TP含量,这说明两者联用可能降低机体对蛋白质的吸收情况及代谢水平,这可能也是本试验中两种菌联合添加,其BW、BWG劣于不添加益生菌及两种菌单独添加的原因。
3.3 育雏育成期饲粮添加BS和EF对蛋鸡血清生长激素的影响
动物的生长受生长轴的调控,生长轴包含“下丘脑-垂体-靶器官”,生长激素释放激素、生长激素、类胰岛素生长因子都能影响动物的内分泌系统,从而影响动物生长。在本试验中,饲粮中添加EF有提高血清GH的趋势。王尚荣[28]研究发现,饲粮中添加BS、乳酸杆菌、双歧杆菌、光合菌及复合菌都能显著提高血清生长激素、胰岛素、三碘甲状腺原氨酸(T3)和甲状腺素(T4)的含量。王宝维等[29]研究发现,饲粮添加BS和锌能够协同促进肉鹅15周的生长激素水平。前人结果与本研究基本一致,结合生长性能可以发现,蛋鸡GH的作用较为复杂,动物实际的生长速度和体重发育情况并不与血清GH水平相对应。贺淹才等[30]在泰和鸡上的研究发现,1和35 d泰和鸡血清GH水平显著高于同日龄的白羽肉鸡,但两者的体重差异正好相反。可能原因是由于过高的GH抑制了机体的生长,比如,生长速度缓慢的伴性侏儒鸡血清GH显著高于正常鸡,而这种规律在蛋鸡中也有所发现,赵茹茜等[31]研究发现,生长慢的蛋鸡血清GH含量显著高于生长快的肉鸡。根据本研究不能得出益生菌促进蛋鸡生长是否与血清GH含量有关的结论,益生菌与生长激素及生长性能之间的作用关系仍需进一步探讨。
3.4 育雏育成期饲粮添加BS和EF对蛋鸡肠道健康的影响
家禽对营养物质的消化吸收主要依靠小肠,小肠吸收面积越大对营养物质的利用越有利。小肠长度和体增重之间存在一定联系,本研究发现,添加BS和EF可以显著提高回肠长度。关于益生菌在蛋鸡肠道长度重量方面的研究较少,张爱武等[32]研究发现,与对照组相比,饲粮添加BS有提高鹌鹑回肠和十二指肠长度的趋势。本试验结果与前人研究基本一致,其原因可能是益生菌到达肠道后,消耗肠道多余的氧气,促进有益菌增殖,维持了肠道健康,从而提高了蛋鸡肠道发育。
动物肠道形态的改变会影响对营养物质的消化吸收,从而影响动物表观的生产性能,肠道的消化吸收能力与肠道绒毛高度、隐窝深度和绒隐比有关。本研究发现饲粮中添加BS和EF均提高了空肠VH。钟光等[33]研究发现,饲粮中添加BS能显著降低肉仔鸡空肠CD。李雪媛[34]在0~16周的蛋鸡上研究发现,BS可以显著降低十二指肠CD,且VH/CD有升高趋势,此外0~3周的混合添加对12周的空肠仍具有改善作用。本研究与前人研究基本一致,表明饲粮中添加益生菌对蛋鸡肠道形态具有一定改善作用,这可能是由于益生菌在肠道中的代谢产物短链脂肪酸如:乙酸、丙酸和丁酸等,例如丁酸可以为肠道上皮提供营养,促进肠黏膜细胞分化,改善肠道形态[35]。
紧密连接蛋白的形成对防止细菌和抗原细胞旁扩散具有重要意义,一些重要的上皮细胞紧密连接蛋白,如ZO-1、Occludin和Claudin,有助于维持肠上皮屏障的完整性,对于肠黏膜损伤的修复和肠道健康至关重要[36]。本研究发现添加BS显著提高了空肠黏膜Occludin基因的mRNA相对表达量,有提高Claudin-1基因的mRNA相对表达量的趋势。陈志永等[37]研究发现,BS可以显著提高66 d黄羽肉鸡空肠紧密连接蛋白Nectin-1以及Occludin-7基因的mRNA相对表达量。潘雪[38]研究发现,BS显著提高了35 d肉鸡肠道ZO-1、Occludin基因的mRNA相对表达量。本研究与前人研究一致,说明BS可促进可调节肠道屏障功能,其原因可能是BS代谢产物可以通过激活过氧化物酶体增殖物激活受体来上调紧密连接蛋白表达,从而改善肠道屏障功能,降低肠道通透性,有利于维持肠道健康[39]。本研究中,添加EF对蛋鸡空肠黏膜屏障基因mRNA相对表达量无显著影响。崔百磊等[40]研究发现,EF对21 d仔猪空肠、回肠Occludin和ZO-1基因的mRNA相对表达量均无显著影响。本研究与前人研究结果相似。但董正林[41]研究发现,饲粮添加微囊化粪肠球菌显著增加 21、42 d肉鸡回肠黏膜闭Occludin、Claudin-1 mRNA表达水平。焦宇洲等[42]研究发现,添加不同剂量的EF均对感染球虫病肉鸡肠道ZO-1基因的mRNA相对表达量无显著影响,低剂量对肠道Occludin基因的mRNA相对表达量无影响,但高剂量可以促进Occludin的表达量。造成以上结果差异的原因可能与动物种类、菌株品种及添加剂量有关,两种益生菌联合添加对空肠黏膜屏障基因相对mRNA表达量无显著影响可能与添加剂量过大,活菌数较多,从而影响了肠道微生态平衡有关。
3.5 育雏育成期饲粮添加BS和EF对蛋鸡产蛋期生产性能的影响
在集约化养殖的背景下,产蛋鸡产蛋率下降,蛋品质质量差,一直是蛋鸡养殖业亟待解决的问题,本研究发现,育雏育成期添加BS有提高21~30周平均蛋重的趋势,并且产蛋率相较于不添加益生菌、添加EF组和联合添加组均有所提高,但差异不显著。前人在研究BS对生产性能的影响上均取得了较好的效果,贺军等[43]研究发现,BS对蛋鸡生产性能的影响主要体现在产蛋率上升和平均蛋重增加上,饲粮中添加2×104、4×104、6×104CFU·g-1BS与对照组相比产蛋率分别提高了1.03%、2.42%、2.12%,差异显著;平均蛋重分别提高了1.93、2.75、2.78 g,且差异显著。赵姝娴等[44]研究发现,饲粮添加BS与对照组相比,鸡蛋重量显著提高了1.6~3.8 g,料蛋比显著降低,平均日采食量无显著差异。本研究与前人研究一致,本研究中育雏育成期添加BS对产蛋期生产性能的提高,可能原因是本试验BS育雏育成期添加,其菌体进入胃肠道后,改善了肠道菌群结构,提高了空肠屏障基因Occludin、Claudin-1基因相对mRNA表达量,进而促进了肠道健康,并且育雏期育成期添加BS的效果可以持续到产蛋期,对产蛋期肠道健康产生积极影响,另外本试验BS在育成期结束时具有较高的BW,也可能是产蛋期具有较高生产性能的原因。本研究中添加EF和两种菌联合添加对蛋鸡生产性能无显著影响,可能原因是添加EF和两种菌联合添加对蛋鸡育成期结束BW无显著影响,此外对蛋鸡空肠屏障功能改善较少,对蛋鸡肠道健康无明显促进,进而对蛋鸡生产性能无显著影响,本研究进一步说明开产前体重对蛋鸡生产性能至关重要。
4 结 论
育雏育成期饲粮添加BS(6×106CFU·g-1)可以提高蛋鸡生长性能,改善血清生化指标,促进肠道健康,育雏育成期饲喂效果可以持续到产蛋期并提高产蛋期生产性能,其效果优于EF和两种益生菌联用。
