奶牛生殖道微生物与繁殖及相关疾病的研究进展
2024-04-02沈文娟张馨蕊陶金忠
沈文娟,杨 卓,张馨蕊,付 予,陶金忠
(宁夏大学动物科技学院,银川 750021)
繁殖是物种延续的必要条件。动物的繁殖效率由受胎率、胚胎早期丢失率、流产率和胎儿早产等因素决定,同时受到生殖道特定微生物的影响[1]。近年来关于宿主与微生物关系的研究受到了重点关注。生物有机体体表和体内栖息着种类各异且数量繁多的微生物,其中动物的口腔、肠道、阴道以及皮肤是动物体的四大菌库。当它们处于一定比例时,与宿主形成相互依存和相互制约的平衡体。近年来微生物研究者对生殖道微生物进行了大量研究,取得了丰硕的成果[2-3]。
生殖道微生物主要包括阴道、外宫颈口和子宫定植的微生物群,生殖道内微生物种类繁多,微生物群落的形成和稳定是其与宿主和环境相互适应的长期进化结果,三者之间处于一个协调和平衡的动态关系,且易受宿主激素水平、饲养方式和药物使用等因素的影响[4]。共生的生殖道微生物可能会影响奶牛的繁殖能力,既可以与生殖道上皮细胞组成防御系统,也可通过代谢产物抑制病原菌生长[2]。菌群与环境和宿主间互相保持平衡并维持宿主生殖系统的正常生理功能,生殖道微生态的稳定和平衡关系影响各种生殖疾病的发生、发展和治疗[5]。研究证明,与人类阴道微生物群相比,牛的子宫和阴道微生物群具有更高的多样性[6]。生殖道内菌群的紊乱和失衡易引发阴道炎和子宫内膜炎等生殖道疾病[7]。因生殖道微生物与宿主的健康密切相关,其与宿主的健康和疾病之间的关系已迅速发展成了一个新的科学研究领域,这篇综述将就奶牛生殖道微生物变化规律探讨及其与生殖道疾病之间的关系。
1 奶牛生殖道微生物变化规律
1.1 阴道微生物
健康牛生殖道微生物菌群由需氧、兼性厌氧和专性厌氧微生物组成,但各类型菌群占比不同,对维持宿主阴道菌群定植具有重要作用[8]。Clemmons等[1]指出,奶牛阴道内的许多菌群与肠道细菌重叠,这可能是由于阴道口的空间位置与肛门非常接近,加之,肛门位于阴道口上部,动物排出的粪便经常沾染到外阴,导致大量肠道菌群可通过扩散迁移的方式进入阴道内。健康奶牛阴道中菌群主要包括乳杆菌属(Lactobacillus)、链球菌属(Streptococcus)、葡萄球菌属(Staphylococcus)、肠杆菌属(Enterobacter)和少量真菌[9],其中乳酸菌为主要优势菌,多为兼性厌氧菌,能够分解糖、蛋白质等物质产生乳酸,维持和保护生殖道内的弱酸性环境[10]。李炳志[10]对产后健康奶牛阴道细菌进行分离鉴定发现优势菌为表皮葡萄球菌(Staphylococcusepidermidis)和乳酸杆菌(Lactobacillussp.)。研究证明,乳酸菌是了解阴道状况的关键,卷曲乳酸杆菌(Lactobacilluscrispatus)、惰性乳杆菌(Lactobacillusiners)可以作为区分阴道内菌群由正常到异常状态变化的一个重要标志[11]。
1.2 子宫微生物
传统观念认为健康子宫是无菌的[12],尤其在妊娠阶段,为胚胎发育场所提供必要的无菌环境。然而,已有研究在胎盘不同区域检测到了细菌[13]。Onderdonk等[14]通过PCR在新生儿绒毛膜检测到细菌与支原体存在,并发现葡萄球菌(Staphylococcus)和棒状杆菌属(Corynebacterium)以及与细菌性阴道病相关的物种;Moore等[15]验证了子宫具有微生物组的假设,在母牛子宫内膜、羊水、宫颈腔等各组织中检测出不同比例的微生物菌群,其中厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria)为优势菌。子宫内微生物可能是通过产后初期松弛的阴道和扩张的子宫颈进入,利用子宫内适宜的环境和温度进行繁殖,也可能是子宫复旧完成时内部细菌未被完全清除,而阴道和子宫颈对子宫环境的保护可能有助于减少子宫腔内微生物的多样性[1]。在正常情况下通过自身的防御机能净化子宫,抵御病原微生物定植。奶牛的自然防御机制可以消除许多病原微生物,但消除的效率取决于细菌致病性和机体免疫状态[16]。
2 奶牛不同生理阶段生殖道微生物结构及丰度变化规律
2.1 发情周期奶牛生殖道微生物变化规律
Michael[17]研究灵长类动物提出卵巢分泌的类固醇激素可以影响短链脂肪酸的产生,调节阴道菌群结构。Otero等[18]使用传统培养方法评估了发情周期中奶牛阴道微生物菌群的变化,结果发现卵泡期阴道乳杆菌及肠球菌(Enterococcussp.)的丰度显著高于黄体期,说明乳杆菌和肠球菌在高P4阶段丰度降低。Quereda等[19]对初次配种的奶牛卵泡期和黄体期阴道微生物区系进行了研究也印证了这一点,即卵泡期乳杆菌属的相对丰度高于黄体期,且发现软壁菌门(Tendericutes)、厚壁菌门和拟杆菌门占阴道微生物区系的75%,其次为变形菌门、放线菌门(Actinobacteria)和梭菌门(Fusobacteria)、Epsilonbacteraeota、髌骨菌(Patescibacteria)等。Cowley和Heiss[20]对发情周期不同阶段小鼠阴道菌群的研究发现,卵泡期阴道微生物多样性显著增加,链球菌和乳酸菌(Lacticacidbacteria)丰度升高;刘畅等[21]研究不同生理时期肉牛阴道菌群结构差异发现,卵泡期细菌总数、乳杆菌属丰度显著高于黄体期,与Otero等[18]的报道结果一致,可能是发情周期阶段孕激素(P4)和雌二醇(E2)等激素的周期性变化导致生殖道pH发生变化,进而影响阴道细菌丰度的变化。同时微生物的变化也引起其代谢产物的变化,如在发情期间机体E2升高,阴道乳酸菌等菌类丰度升高,其产生的脂肪酸使pH下降,同时脂肪酸作为诱导剂可促进奶牛发情[17],但具体机理还不清楚。
在发情周期,子宫微生物也发生了一定的变化规律,Ault等[22]研究健康奶牛子宫微生物时发现奶牛在人工授精前2 d细菌多样性显著下降,可能是为妊娠营造适宜环境。随着发情的周期性变化,子宫内细菌群落多样性也呈周期性变化。基于以上研究结果,提示发情周期不同阶段,卵巢类固醇激素的周期性变化,导致阴道菌群存在周期性变化,卵泡期阴道产酸的乳杆菌属丰度增加,阴道呈弱酸性环境,且微生物多样性高于黄体期,而子宫微生物多样性在卵泡期降低。
2.2 妊娠期奶牛生殖道微生物变化规律
妊娠期生殖道环境处于动态变化,菌群结构多变复杂[23]。整个繁殖周期,母体营养、激素、免疫系统和微生物等因素协同作用以维持母体生命活动和妊娠[24]。妊娠期间,P4水平升高[25]、宿主免疫调节能力发生变化[26-27]。Messman等[28]研究显示,不同妊娠状态和雌二醇浓度母牛阴道整体细菌群落特征无显著差异,但在不同妊娠状态下存在物种水平差异,妊娠母牛阴道存在较多的多杀性巴氏杆菌(P.multocida),未妊娠母牛阴道存在丰度较高的未分类巴斯德菌科(Pasteurellaceae)和未分类梭杆菌属(Fusobacterium),这些差异可能改变阴道环境,从而影响生育能力和阴道健康。妊娠期间雌激素水平升高,阴道黏膜增厚,糖原沉积增加,糖原作为乳酸菌生产乳酸的主要碳水化合物,有助于阴道pH的保护[29],乳酸菌占据主要优势,生殖道微生物发生显著变化,整体微生物丰度和多样性降低[23,30]。Genís等[31]在产犊前3周将乳酸菌菌株作为益生菌注入奶牛阴道和子宫中,奶牛分娩后患子宫炎的几率较低,说明产乳酸菌可能对妊娠期奶牛生殖健康和繁殖能力有益。Moore等[15]研究显示,妊娠母牛子宫内丰度最高的为厚壁菌门、拟杆菌门和变形菌门,且妊娠子宫各组织的门水平物种相似;Aagaard等[23]研究报道,健康孕妇妊娠期的物种多样性和丰富度均下降,优势种为乳酸杆菌、梭菌目(Clostridiales)、拟杆菌目(Bacteroidales)和放线菌目(Bacteroidales);Deng等[32]对TAI后不同妊娠阶段奶牛阴道微生物测序分析,显示不同妊娠阶段阴道微生物群落多样性存在显著差异,妊娠中期和后期微生物多样性降低。子宫细菌群落的发育组成影响繁殖能力,表明生殖道微生物群落多样性与系统发育关系的变化可能与妊娠的建立存在密切相关性。综上,妊娠后的阴道微生物区系相较于未妊娠具有更高的稳定性,奶牛在妊娠期子宫微生物丰度和多样性降低,繁殖前细菌丰度的差异可能会影响生殖道环境,潜在的影响繁殖。
3 产后奶牛生殖道微生物变化规律
3.1 产后阴道微生物结构组成
产后阴道菌群的构建是一个动态演变的过程,随产后时间的延长,阴道菌群的复杂度在不断增加(表1)。不同品种、健康状况和生理阶段的牛其阴道微生物组成差异显著,Nesengani等[33]比较发现,荷斯坦奶牛生殖道中放线杆菌属相对丰度显著高于海福特牛,费克蓝姆氏菌属(Facklamia)和睡眠嗜组织菌属(Histotrophil)在海福特牛生殖道中的相对丰度则高于荷斯坦奶牛,而牛生殖道菌群结构变化的潜在机制以及与生殖的关系有待进一步研究。
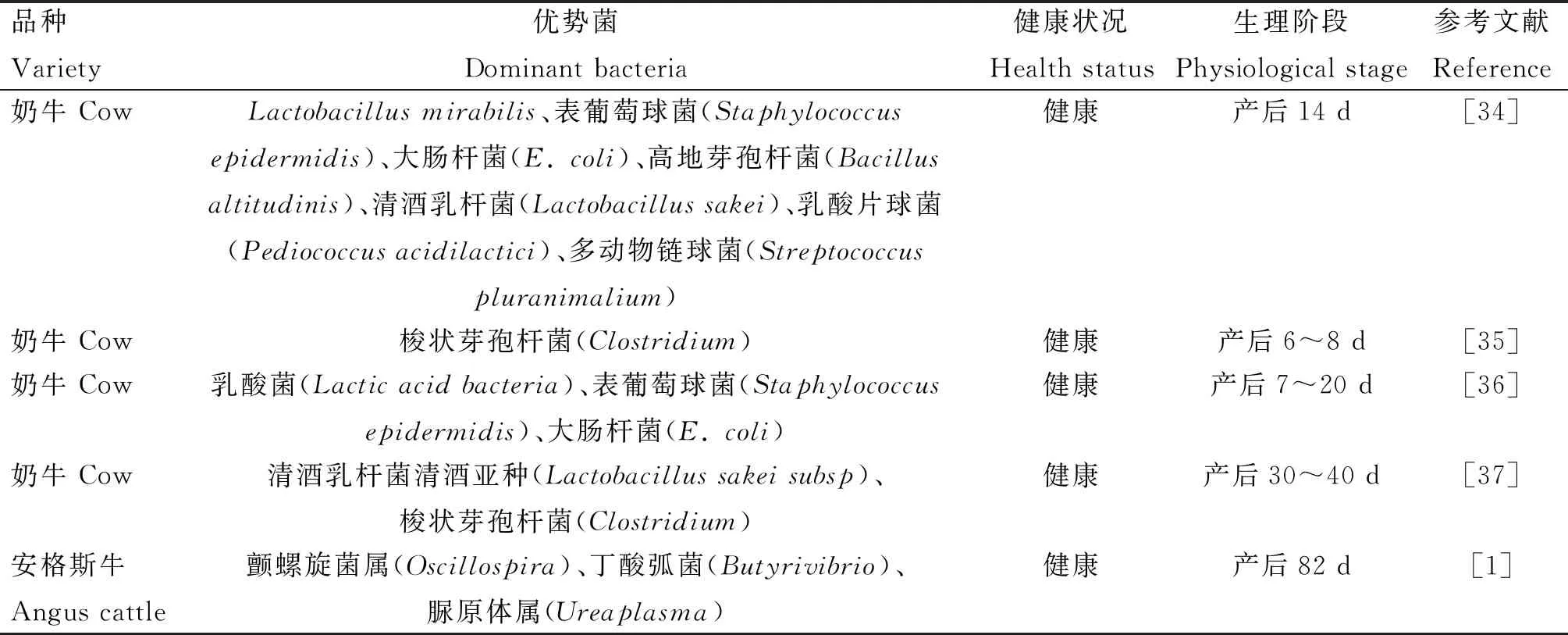
表1 奶牛生殖道微生物优势菌
3.2 产后正常子宫微生物结构及丰度变化
产后子宫内细菌群落随时间高度动态变化。王国卿[38]认为,产后第7天牛子宫内总细菌丰度达到最高,此后逐渐减少,产后第36~46 天完成子宫复旧,子宫中细菌数降到最低(最低稀释度1×10-7,最低稀释度的菌落数小于30个)。产后子宫环境逐渐改变有利于厌氧菌如拟杆菌门和梭杆菌门的生长,这种变化可能是由于胎盘的血流停止,子宫中剩余血液、羊水和尿囊液等组成的恶露以及分娩结束后子宫形成的低氧环境为厌氧菌的生长创造理想条件[39]。通过对奶牛产后1~32 d进行跟踪采样,发现子宫内以大肠杆菌、链球菌、变形杆菌和梭状芽胞杆菌为主[40],但也有研究报道在产后奶牛子宫中分离到了葡萄球菌、棒状杆菌和假单胞杆菌(Pseudomonas)等[9],这些报道的结果不同可能与环境、饲养管理及个体差异有关。产后早期由于分娩时生殖道受环境或助产的污染,导致子宫内大肠杆菌、拟杆菌、表皮葡萄球菌检出率增加,到第7天左右达到最高;之后随着产后时间的延长,恶露排出、生殖道机能以及自身免疫系统的恢复,这些环境病原菌逐渐下降。人类研究表明,大多数女性分娩后生殖道菌群平衡出现紊乱,乳酸杆菌多样性减少,厌氧菌如嗜胨菌属(Peptoniphilus)、普氏菌属(Prevotella)和厌氧球菌属(Anaerococcus)增加[41]。生殖道细菌多样性失衡会影响后续妊娠的建立和维持,尤其乳酸菌的丰度降低与疾病和生殖能力下降相关[42]。总之,奶牛产后早期子宫中微生物数量先升高,其中厌氧菌及条件病原菌比例增加,乳酸菌数量减少;之后逐渐转变为产后晚期微生物数量减少,厌氧菌及条件病原菌比例下降,乳酸菌数量增加。
4 生殖道感染微生物菌群特征及疾病
4.1 奶牛阴道菌群失衡
生殖道微生物群落能够影响生殖道健康,但生殖道内的菌群同时受到生殖道环境的影响。当受到内源性或外源性因素影响时菌群结构剧烈变化,阴道内微生物失衡,由正常生理性状态转变为病理性状态[22]。研究发现,患细菌性生殖道疾病的奶牛阴道微生物群落菌群多样性比健康奶牛更加丰富[43],其中厚壁菌门、拟杆菌门、放线菌门和梭杆菌门丰度显著增加,并存在一些以往未发现的低丰度菌群,因此生殖道内微生物紊乱是阴道炎症的关键因素。
奶牛阴道中定植的大肠杆菌、葡萄球菌、加德纳氏菌等可能是作为条件性致病菌,当机体免疫机能低下时条件病原菌大量繁殖引起阴道炎,并伴有乳杆菌减少的菌群紊乱[44]。凌宗欣[45]对女性生殖道微生物的研究发现,生殖道感染是由乳杆菌为主的阴道正常菌群转换为兼性厌氧菌为主的如加德纳菌属(Gardnerella)、奇异菌属(Atopobium)、普氏菌属等致病性微生物菌群。乳酸菌是健康奶牛的生殖道优势菌,不孕症奶牛生殖道乳酸菌丰度显著降低,金黄色葡萄球菌(Staphylococcusaureus)成为优势菌群[42,46],提示阴道菌群的结构失衡可能与子宫内膜炎的发生有关。Peng等[47]报道了产后第10天健康奶牛和子宫炎奶牛阴道优势菌群为拟杆菌门、厚壁菌门和梭杆菌门,第40天主要菌群为拟杆菌门、厚壁菌门、软壁菌门和变形菌门,且子宫炎奶牛梭杆菌门丰度显著高于健康奶牛;Wang等[34]发现,健康和子宫炎奶牛阴道中均含有肠球菌属(Enterococcus)、乳酸菌属和小球菌属(Micrococcus)的杆菌群,子宫炎奶牛阴道菌群丰度显著增加,且以大肠杆菌为主。因此,患有细菌性阴道炎奶牛的阴道中未分离出特定病原菌,只是某些条件性致病菌如大肠杆菌、金黄色葡萄球菌等丰度发生了变化[48],说明生殖道微生物菌群紊乱是造成炎症的关键因素[49]。综上所述,奶牛阴道感染后菌群结构比健康奶牛更为复杂,且无特定病原菌,阴道内病原微生物的大量定植及结构失衡是造成奶牛阴道疾病的关键因素。
4.2 子宫感染微生物菌群变化规律与疾病
奶牛分娩后因助产不当、胎衣不下、免疫机能低下、环境条件差及生殖道中病原微生物过度生长等因素导致子宫感染,引发奶牛子宫炎和子宫内膜炎。子宫炎是子宫壁的一种深度炎症,通常发生在产后21 d内,子宫内膜炎和亚临床子宫内膜炎发生在产后21 d或以上[50],可引起子宫组织和子宫内膜结构破坏[51],奶牛产后子宫感染常造成不发情、不排卵和黄体期延长,导致配种受胎率降低,严重者因繁殖能力丧失而淘汰,造成养殖业巨大的经济损失[52]。当奶牛产后造成感染,而恶露有利于微生物繁殖,且产后奶牛大多处于免疫抑制,在众多因素的作用下引起细菌性子宫内膜炎等繁殖性疾病[53]。基于16S rRNA扩增子测序的研究表明,与健康奶牛子宫微生物群结构相比,子宫炎奶牛子宫细菌群落物种多样性更丰富,结构组成不均衡,子宫微生物群更加复杂[43,54]。
Chen等[55]发现,患子宫内膜炎患者生殖道微生物菌群因定植部位不同而不同,阴道以乳酸杆菌为绝对优势菌群,而在宫腔、输卵管中乳酸杆菌丰度下降,假单胞杆菌和鲍氏不动杆菌(Acinetobacterbaumannii)丰度逐渐增加,宫腔菌群的改变引起子宫内膜炎反应机制改变,释放出的炎性物质促进了炎症发生和发展[56]。基于细菌的培养发现,大肠杆菌、化脓隐秘杆菌(Arcanobacteriumpyogenes)、坏死梭杆菌(Fusobacteriumnecrophorum)和产黑素普雷沃氏菌(Prevotellamelaninogenicus)等病原菌在产后过度生长,导致子宫内膜炎或子宫积脓[57]。Takcs等[58]认为,子宫受到污染主要发生在产后10~21 d,以链球菌、大肠杆菌和棒状杆菌最常见;彭宇[59]对产后10、20、30、40天奶牛样本测序发现优势菌群分别为葡萄球菌、产气荚膜梭菌(Clostridiumperfringens)、沙门氏菌(Salmonella)和葡萄球菌。Jeon等[39]研究发现,拟杆菌门在子宫内膜炎奶牛中丰度显著高于健康奶牛,其次为梭杆菌属,其他细菌如螺旋菌、丝状菌(Filamentousbacteria)、卟啉单胞菌属、普雷沃氏菌属(Prevotella)等;刘超逊等[60]发现,引起水牛产后子宫内膜炎的主要致病菌为坏死梭杆菌、卟啉单胞菌属(Porphyromonas)和解肝素拟杆菌(Bacteroidesheparinolyticus)。孙城涛等[61]报道,大肠杆菌同时存在于健康及患病奶牛中,但患病奶牛阴道内大肠杆菌丰度显著高于健康奶牛,且显著高于其他细菌总和,阴道条件性病原微生物的丰度增加和结构失衡可能是奶牛子宫内膜炎的患病原因。子宫疾病可能更依赖于特定细菌的过度生长和免疫系统的反应性,某些致病菌的过度生长可能会导致微生物整体多样性增加,引发子宫感染性疾病[12,39]。子宫正常复旧期间和复旧完成后发情期间的奶牛子宫内细菌与患子宫内膜炎奶牛子宫内细菌种类有相似性。因此,正常情况下子宫内存在的条件致病菌可引起子宫内膜炎。同时,在产后子宫内膜炎中也发现了真菌如白色念珠菌感染[62]。另外,从未配种的青年母牛也会发生由大肠杆菌、假单胞杆菌引起的子宫内膜炎[63]。子宫内膜炎奶牛产后子宫内细菌多样性均呈现先升高后降低的演替规律,子宫内膜炎奶牛阴道内乳酸菌显著减少,大肠杆菌、链球菌等条件致病菌显著增加[53]。综上所述,奶牛产犊后早期健康奶牛和患子宫内膜炎奶牛存在一个共有的子宫微生物群,而后患子宫内膜炎奶牛微生物群迅速变化,导致与炎症相关条件致病菌群大量繁殖,细菌多样性增加,具有明显的时间动态变化。
综上所述,阴道菌群的变化是一个动态过程[64],生殖道微生物与奶牛的发情周期呈现一致性变化规律,妊娠期及产后期生殖道微生物的丰度和多样性也呈规律性变化。生殖道微生物的紊乱导致疾病的发生,也影响奶牛的繁殖效率。鉴于细菌在维持生殖道稳态方面的关键作用,奶牛产后阴道和子宫微生物研究对解决子宫细菌污染、预防和治疗产后子宫内膜炎具有重要意义。奶牛生殖道微生物多样性复杂,且受品种、生理阶段及个体差异的因素影响。
