富马酸与肉桂醛联用调节产肠毒素型大肠杆菌诱导猪肠上皮细胞氧化应激的分子机制
2024-04-02刘禹彤杨冠华李玉鹏乔家运李海花
刘禹彤 杨冠华 张 菊 李玉鹏 乔家运* 李海花
(1.天津师范大学生命科学学院,天津市动物多样性保护与利用重点实验室,天津 300387;2.天津市宝坻区农业综合行政执法支队,天津 301800;3.天津市农业科学院畜牧兽医研究所,天津 300381;4.天津市畜禽分子育种与生物技术重点实验室,天津 300381;5.天津市畜禽健康养殖工程技术中心,天津 300381;6.天津农学院动物科学与动物医学学院,天津市农业动物繁育与健康养殖重点实验室,天津 300384)
氧化应激是指机体氧化和抗氧化系统失衡造成机体损伤的过程,在此过程中产生的大量活性氧(reactive oxygen species,ROS)若不能被机体自身抗氧化系统及时清除,就会造成ROS在细胞内过量积累,导致细胞DNA损伤、线粒体损伤、蛋白质降解和脂质过氧化等[1]。仔猪在生长发育过程中可能会遭受多种因素的应激,如病原微生物感染、断奶[2]、饲养环境改变[3]和运输[4]等,这些应激通常会影响仔猪的肠道健康。肠道是营养物质消化吸收的主要场所,也是仔猪应激反应的主要部位。仔猪肠道健康状况直接影响着养猪业的经济效益,因此,在仔猪生产中,维护肠道健康至关重要。
为提高仔猪肠道健康,近年来一些新型绿色饲料添加剂在生产中被广泛应用,如植物精油和有机酸等。肉桂醛(cinnamic aldehyde,CA)是从肉桂等植物中所提取的一种精油,CA能改变大肠杆菌的细胞膜通透性及细胞壁的状态,导致细胞内容物泄漏,生存力降低[5],其结构中的醛基也能与菌体蛋白质功能基团产生化学反应,抑制代谢过程中相关酶的活性,进而使蛋白完全失活[6];CA与羰基直接相连的α-碳原子上的氢具有较强氧化还原性,可使ROS成为稳定物,从而减少ROS对细胞造成的氧化损伤[7]。富马酸(fumaric acid,FA)又名延胡索酸,是一种常见的有机酸化剂,可调节消化系统的酸碱平衡辅助改善动物消化系统功能并参与生物体内的糖异生过程,也是机体内三羧酸循环的重要中间产物,生能途径较葡萄糖短,可在应激状态下紧急合成ATP,作为抗应激剂迅速为机体供能减少因各种应激反应而造成的动物损伤[8]。研究发现,饲粮添加延胡索酸可以提高热应激肉鸡的体增重及机体抗氧化和免疫能力,同时降低料重比[9]。植物精油和有机酸单独或组合使用可用于改善动物的肠道健康,并且不同类型的植物精油和有机酸复配具有协同效应[10-11]。研究表明,CA与甲酸、乙酸、丙酸联用能够提高仔猪的肠道健康[12],和柠檬酸联用可破坏病原体的细胞结构,和柠檬酸、山梨酸、苹果酸、FA联用可改善断奶仔猪的生长性能,并调节仔猪的菌群群落[13]。然而,CA与FA联用对IPEC-J2细胞的作用尚未见报道。基于CA良好的抑菌和抗氧化作用及FA的抗应激作用,推测CA和FA联用对调节ETEC K88诱导IPEC-J2细胞氧化应激具有有益作用。因此,本研究以猪肠上皮细胞IPEC-J2为模型,探索FA和CA联用对产肠毒素大肠杆菌(ETEC)K88诱导IPEC-J2细胞氧化应激的调节作用,同时以核因子-κB抑制因子激酶(IKK)/核因子-κB抑制因子α(IκBα)/核因子-κB(NF-κB)信号通路为切入点,探索FA和CA联用调节细胞氧化应激的分子机制,为FA和CA在动物生产上的联合应用提供理论依据。
1 材料与方法
1.1 试验细胞和菌株
IPEC-J2细胞购于上海冠导生物工程有限公司。ETEC K88为天津农学院动物科学与动物医学学院实验室保存菌株。细胞培养方法与细菌活化方法参照Qiao等[14]的方法。
1.2 试验试剂
RPMI 1640基础培养基、细胞消化液均购自美国Gibco公司;青链霉素、二甲基亚砜(DMSO)均购自北京索莱宝科技有限公司;细胞增殖-毒性检测试剂盒CCK-8购自东仁化学科技(上海)有限公司;热休克蛋白70(Hsp70)抑制剂VER155008购自Sigma公司;CA和FA由厦门中农科化新材料有限公司提供。
1.3 FA与CA最佳复配浓度及培养时间的筛选
将IPEC-J2细胞接种于96孔板中培养(5×104个/mL),将不同添加浓度的FA和CA添加至细胞培养基中,分别培养12和24 h,然后按照CCK-8试剂盒说明书计算细胞活力,根据细胞活力结果确定FA与CA最佳复配浓度及培养时间。
1.4 FA与CA抑制ETEC K88黏附IPEC-J2细胞能力的测定
将IPEC-J2细胞分别接种于2块24孔板中,待细胞融合至80%,加入最佳复配浓度的FA与CA置细胞培养箱孵育12 h,用ETEC K88(浓度为1×103CFU/mL)感染细胞3、6、12和24 h;感染结束后参照Qiao等[14]的方法测定FA与CA抑制ETEC K88黏附IPEC-J2细胞的能力。
1.5 试验设计
试验分为3组,分别是非处理的对照组、FA与CA调节ETEC K88感染细胞组(FC+ETEC组)和ETEC K88感染细胞组(ETEC组)。细胞贴壁24 h后对照组添加DMSO继续培养24 h;ETEC组用ETEC K88(浓度为1×103CFU/mL)感染细胞3、6、12和24 h;FC+ETEC组加入最佳复配浓度的FA与CA置细胞培养箱孵育12 h,用ETEC K88(浓度为1×103CFU/mL)感染细胞3、6、12和24 h。感染结束后无菌收集细胞和上清进行后续试验。
1.6 测定指标与方法
1.6.1 炎性细胞因子含量检测
采用酶联免疫吸附测定(ELISA)法检测细胞培养上清液中的白细胞介素-8(IL-8)、肿瘤坏死因子-α(TNF-α)、白细胞介素-10(IL-10)和转化生长因子-β(TGF-β)含量,按照ELISA检测试剂盒(购自美国BD公司)操作说明进行检测。
1.6.2 IKK/IκB/NF-κB信号通路相关基因mRNA相对表达量的测定
以磷酸甘油醛脱氢酶(GAPDH)为内参,采用实时荧光定量PCR(RT-qPCR)检测细胞中IKKα、IKKβ、IκBα、NF-κBp65和Hsp70 mRNA相对表达量。相关引物设计、RNA提取及反转录、RT-qPCR反应条件和相对定量法2-△△Ct法的计算参照Qiao等[14]的方法。引物序列信息见表1,Hsp70扩增引物为本试验使用Primer 5.0设计。所用RT-qPCR试剂盒均购自美国GeneCpoeia公司。

表1 RT-qPCR引物序列
1.6.3 细胞中氧化应激蛋白超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)活性以及丙二醛(MDA)含量检测
采用ELISA法检测培养上清液中的SOD、GSH-Px活性和MDA含量,按照ELISA检测试剂盒(购自南京建成生物工程研究所)操作说明进行操作。
1.7 Hsp70在FA与CA调节ETEC K88感染的IPEC-J2 细胞氧化应激中的作用
使用Hsp70抑制剂VER155008(10 μmol/L)或DMSO(10 μmol/L)处理细胞6 h,再用ETEC K88感染IPEC-J2细胞,感染12 h后收集细胞及其培养上清液。试验分为7组,即非处理的对照组(仅添加基础培养基)、DMSO组(仅用DMSO处理细胞)、VER组(仅用Hsp70抑制剂处理细胞)、DMSO+ETEC组(先用DMSO处理细胞,再用ETEC K88感染细胞)、VER+ETEC组(先用Hsp70抑制剂处理细胞,再用ETEC K88感染细胞)、DMSO+FC+ETEC组(先用DMSO处理细胞,再用FA与CA孵育细胞,最后用ETEC K88感染细胞)和VER+FC+ETEC组(先用Hsp70抑制剂处理细胞,再用FA与CA孵育细胞,最后用ETEC K88感染细胞),每组3个重复。按照上述ELISA法检测SOD、GSH-Px活性和MDA含量,采用RT-qPCR检测细胞中IKKα、IKKβ、IκBα和NF-κBp65的mRNA相对表达量。
1.8 数据统计分析
利用Excel 2007对试验数据进行初步处理,采用SPSS 20.0软件进行单因素方差分析(one-way ANOVA),采用LSD法进行多重比较,采用GraphPad Prism 5软件进行图像处理及分析,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 FA与CA最佳复配浓度及培养时间的筛选
细胞活力测定结果如图1所示。FA处理细胞12和24 h时,1.00 mg/mL FA组的细胞活力显著高于其他各组(P<0.05);但2.00 mg/mL FA组的细胞活力显著低于其他各组(P<0.05),说明2.00 mg/mL FA处理对IPEC-J2细胞的生长具有抑制作用。CA处理细胞12和24h时,1.00和2.00 μL/mL CA组的细胞活力显著高于其他各组(P<0.05);但CA处理细胞24 h时,1.00 μL/mL CA组的细胞活力显著高于2.00 μL/mL CA组(P<0.05)。在细胞培养时间上,FA和CA处理的结果都显示12 h时的细胞活力高于24 h时的细胞活力。因此在后续试验中,确定FA添加浓度为1.00 mg/mL,CA添加浓度为1.00 μL/mL,细胞培养时间为12 h。
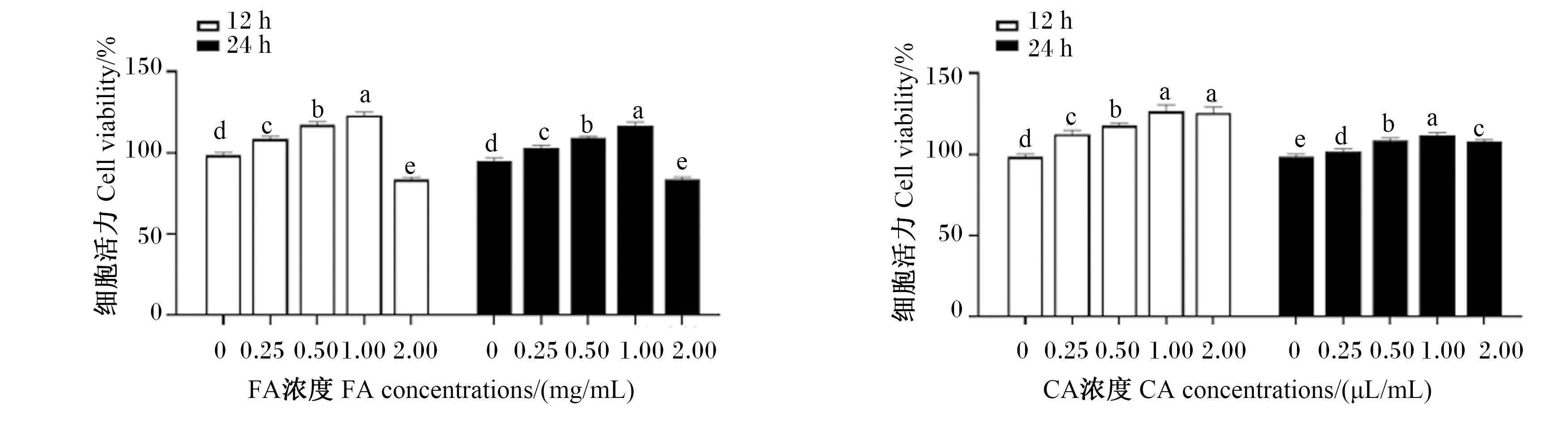
数据柱形标注不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),相同小写字母或无字母表示差异不显著(P>0.05)。下图同。
2.2 FA与CA对ETEC K88黏附IPEC-J2细胞的影响
FA与CA处理细胞3、6、12和24 h对ETEC K88黏附IPEC-J2细胞的影响如图2所示,ETEC K88对经FA与CA预处理后的IPEC-J2细胞黏附率有不同程度的降低,与ETEC组相比,FC+ETEC组的细胞黏附率在3、12和24 h时均显著降低(P<0.05),在6 h时极显著降低(P<0.01)。试验结果表明,FA与CA复配能够有效抑制ETEC K88黏附IPEC-J2细胞,并以ETEC K88感染细胞6 h时其黏附率降低为最多。
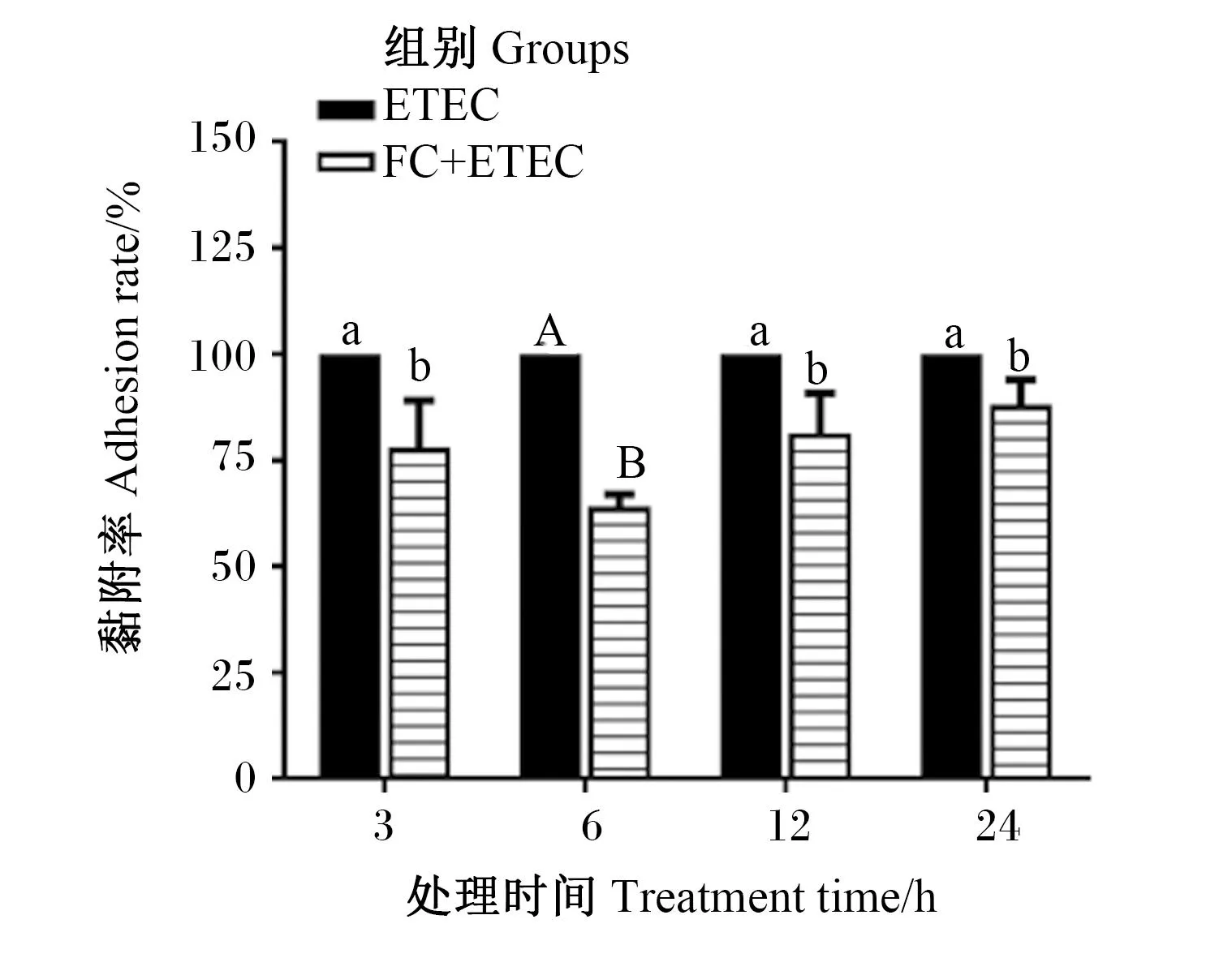
图2 FA与CA对ETEC K88黏附IPEC-J2细胞的影响
2.3 FA与CA对ETEC K88感染IPEC-J2细胞产生炎性细胞因子的影响
如图3所示,与对照组相比,ETEC组IL-8和TNF-α含量极显著提高(P<0.01),IL-10和TGF-β含量极显著降低(P<0.01);与ETEC组相比,FC+ETEC组IL-8和TNF-α含量极显著降低(P<0.01),IL-10和TGF-β含量极显著提高(P<0.01)。结果表明,ETEC K88感染可促进IPEC-J2细胞产生促炎性因子IL-8和TNF-α,在此基础添加FA与CA可有效抑制IPEC-J2细胞产生促炎性因子IL-8和TNF-α并促进IPEC-J2细胞释放抗炎因子IL-10和TGF-β,缓解ETEC K88对IPEC-J2细胞造成的损伤。
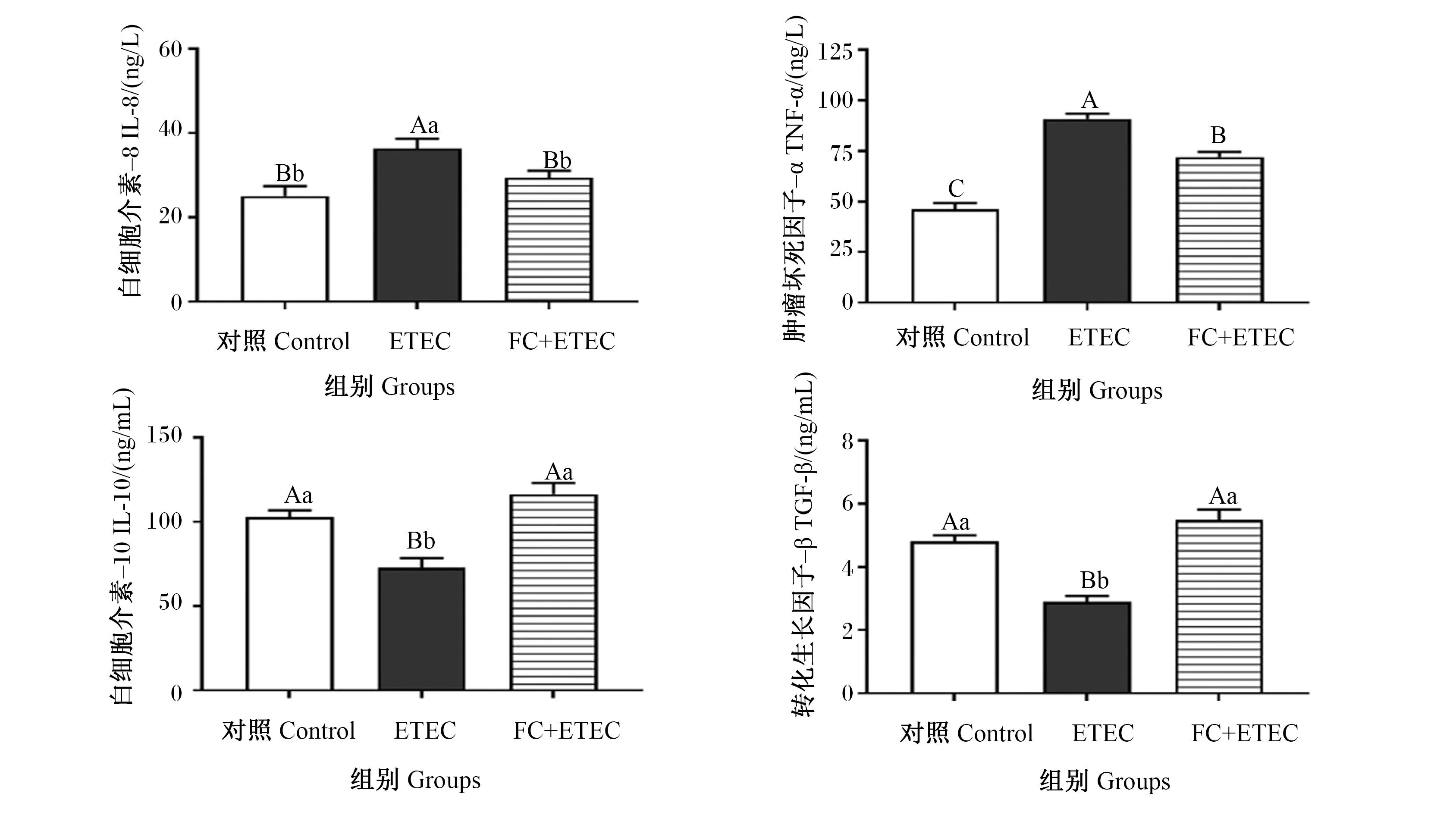
图3 FA与CA对ETEC K88感染IPEC-J2细胞产生炎性细胞因子的影响
2.4 FA与CA对ETEC K88感染IPEC-J2细胞中IKK/IκB/NF-κB信号通路活化的影响
如图4所示,与对照组相比,ETEC组NF-κBp65和IKKβmRNA相对表达量在6、12和24 h时显著或极显著升高(P<0.05或P<0.01),IKKαmRNA相对表达量在3、6、12和24 h时显著或极显著升高(P<0.05或P<0.01),IκBαmRNA相对表达量在6、12和 24 h时极显著降低(P<0.01),Hsp70 mRNA相对表达量在3、6、12和24 h时显著或极显著降低(P<0.05或P<0.01)。

图4 FA与CA对ETEC K88感染IPEC-J2细胞中IKK/IκB/NF-κB信号通路活化的影响
与ETEC组相比,FC+ETEC组NF-κBp65 mRNA相对表达量在6、12和24 h时显著或极显著降低(P<0.05或P<0.01),IKKαmRNA相对表达量在3、6、12和24 h时显著或极显著降低(P<0.05或P<0.01),IKKβmRNA相对表达量均无显著变化(P>0.05),IκBαmRNA相对表达量在6、12和24 h时均极显著升高(P<0.01),Hsp70 mRNA相对表达量在3、6、12和24 h时显著或极显著升高(P<0.05或P<0.01)。
结果表明,ETEC K88能引起IPEC-J2细胞IκBα和Hsp70 mRNA相对表达量降低,以及引起NF-κBp65、IKKα和IKKβmRNA相对表达量升高;添加FA与CA可上调ETEC K88感染细胞中Hsp70 mRNA相对表达量,降低NF-κBp65和IKKαmRNA相对表达量并稳定IκBαmRNA相对表达量。
2.5 FA与CA对ETEC K88感染IPEC-J2细胞中氧化应激蛋白SOD、GSH-Px活性和MDA含量的影响
如图5所示,与对照组相比,ETEC组的MDA含量极显著升高(P<0.01),SOD和GSH-Px活性均极显著降低(P<0.01);与ETEC组相比,FC+ETEC组的MDA含量极显著降低(P<0.01),SOD和GSH-Px活性均显著升高(P<0.05)。试验结果表明,ETEC K88能引起IPEC-J2细胞MDA含量升高,以及SOD和GSH-Px活性下降,添加FA与CA可逆转ETEC K88感染IPEC-J2细胞引起的MDA含量升高,以及SOD和GSH-Px活性降低。

图5 FA与CA对ETEC K88感染IPEC-J2细胞中氧化应激蛋白SOD、GSH-Px活性和MDA含量的影响
2.6 Hsp70在FA与CA调节ETEC K88感染的IPEC-J2细胞氧化应激中的作用
ETEC K88处理细胞后采用Hsp70抑制剂处理细胞,以确定Hsp70在FA与CA缓解ETEC K88诱导IPEC-J2氧化应激中的作用,结果如图6所示。与对照组相比,VER组的IKKαmRNA相对表达量显著升高(P<0.05),IκBαmRNA相对表达量、SOD和GSH-Px活性呈现显著降低(P<0.05);DMSO+ETEC组的IKKα、IKKβ、NF-κBp65 mRNA相对表达量和MDA含量显著升高(P<0.05),IκBαmRNA相对表达量、SOD和GSH-Px活性显著降低(P<0.05)。与DMSO+ETEC组相比,VER+ETEC组的MDA含量显著升高(P<0.05),IKKα、IKKβ、NF-κBp65 mRNA相对表达量以及GSH-Px活性均无显著差异(P>0.05),同时IκBαmRNA相对表达量和SOD活性显著降低(P<0.05)。与DMSO+ETEC组相比,DMSO+FC+ETEC组的IKKα、IKKβ、NF-κBp65 mRNA相对表达量及MDA含量均显著降低(P<0.05),IκBαmRNA相对表达量及SOD和GSH-Px活性均显著升高(P<0.05)。与VER+ETEC组相比,VER+FC+ETEC组的IKKα、IKKβ、NF-κBp65 mRNA相对表达量显著降低(P<0.05),IκBαmRNA相对表达量及SOD和GSH-Px活性均显著升高(P<0.05)。

图6 Hsp70在FA与CA调节ETEC K88感染的IPEC-J2细胞氧化应激中的作用
3 讨 论
在仔猪的生长发育过程中,饲养管理水平、病理和环境等因素均能诱导仔猪发生氧化应激,氧化应激的发生会引起断奶仔猪肝脏抗氧化酶活性降低和羟自由基抑制能力下降,造成肠道和肝脏的病理性损伤,严重阻碍养猪业的发展。为防止氧化应激对机体造成的影响,机体具有一套完整的抗氧化系统。SOD、GSH-Px和过氧化氢酶(CAT)是抗氧化系统中的重要组分,是机体抵御氧化应激的第一道防线,可消除超氧化物和羟基自由基。SOD可以歧化超氧化物加氧生成过氧化氢,保护细胞免受超氧化物介导的细胞毒性[17];谷胱甘肽(GSH)是细胞质、细胞核和线粒体中最常见的非酶性抗氧化物,通过GSH-Px清除过氧化氢[18];机体脂质物质发生过氧化反应时会产生醛类物质MDA,该物质可反映机体过氧化程度[19]。SOD、GSH-Px和MDA的水平常被用于评估组织或细胞中的氧化应激水平[20]。
研究表明,补充外源性抗氧化剂能够改善肠道炎症和黏膜损伤,减轻氧化应激[21],利用植物精油和有机酸为主的天然产物是保持仔猪肠道健康的新趋势。FA和CA对动物具有多种有益作用,FA学名反丁烯二酸,它是琥珀酸-丙酸途径的关键中间产物,作为三羧酸循环(TCA)的中间产物,广泛存在于生物组织中,可直接参与机体生理生化反应,应激状态下可用于ATP的紧急生成,与矿物质元素生成络合物从而提高矿物质元素的吸收率[22]。据报道,早期断奶仔猪消化系统和免疫器官发育不完善,消化道中酶和胃酸的分泌量不足,胃蛋白酶的活性低使蛋白质消化率降低,导致仔猪消化不良和大肠杆菌病的发生[23],FA可通过降低胃内pH增强胃内多种消化酶活性,提高仔猪对饲粮蛋白质的利用率,抑制有害菌的生长,促进有益菌的生长,使胃肠道菌群维持平衡[22]。CA是一种植物提取物,可通过改变有害菌细胞膜或细胞壁的状态来抑菌,也可通过改变机体的氧化还原状态来调控机体的健康,具有抑菌、抗炎等多种生物学活性[24]。研究发现,在大鼠肠道黏膜液、浆膜液和肠道组织匀浆液中加入CA,肉桂酸的产量及产生速率快速增加,表明CA可以在小肠细胞中可转化为肉桂酸发挥作用[25]。有研究表明,CA可提高CAT活性和SOD并消除过量的ROS,降低MDA含量[26],还可激活抗氧化防御系统,降低大鼠肝脏TNF-α和MDA含量,提高GSH-Px和CAT活性,抑制促炎性细胞因子的产生[27]。在饲粮中添加CA可降低肉兔十二指肠和空肠MDA含量,提高空肠GSH-Px活性,降低肠道氧化应激,改善小肠黏膜形态结构,且将CA和凝结芽孢杆菌组合添加改善效果更优[28]。本研究以IPEC-J2细胞为模型,探索CA和FA联用对ETEC K88诱导IPEC-J2细胞氧化应激的调节作用。研究发现,FA与CA预处理可显著降低ETEC K88感染的IPEC-J2细胞MDA含量,提高SOD和GSH-Px活性,表明FA与CA联用可有效缓解IPEC-J2细胞氧化应激。
NF-κB是一种蛋白质复合物,广泛存在于真核细胞内,参与动物和人体多种生物学过程,例如,调节多种细胞因子、生化因子及酶等基因表达,在应激反应、免疫应答和细胞凋亡等过程中发挥重要作用[29]。NF-κB信号通路主要由NF-κB、IκB、IKK 3种信号分子组成,是重要的炎症信号通路[30-32]。NF-κB信号通路胞内信号转导机制已被广泛研究。正常情况下,NF-κB与抑制剂IκB结合而保留在细胞质中[33],当受到细胞外信号刺激,如病原体相关分子模式或细胞因子,IKK首先磷酸化,然后磷酸化的IKK进一步磷酸化IκB,进而IκB与NF-κB分离,导致NF-κB易位到细胞核并触发靶基因转录[34]。p65是NF-κB家族成员之一,其对应的核转位是NF-κB通路被有效激活的关键标志[35]。NF-κB调节免疫介质的表达并驱动单核细胞分化为M1或M2巨噬细胞,M1巨噬细胞主要产生白细胞介素-6(IL-6)、IL-8、TNF-α等促炎细胞因子,激活先天免疫;M2巨噬细胞主要分泌IL-10等抗炎细胞因子,使机体恢复到正常免疫和生理水平[36]。促炎细胞因子与抗炎细胞因子的平衡有助于控制炎症的发展,因此,减少促炎性细胞因子的分泌,提高抗炎性细胞因子的生成可能是调节ETEC K88诱导IPEC-J2细胞氧化应激的有效方法。本试验中观察到,在ETEC K88诱导的IPEC-J2细胞氧化应激模型中,促炎性细胞因子IL-8和TNF-α含量显著提高,抗炎性细胞因子IL-10和TGF-β等含量显著降低,与前人的研究结果[37-38]一致;同时,本试验显示,添加FA与CA可以显著提高抗炎性细胞因子IL-10和TGF-β含量,并显著降低促炎性细胞因子IL-8和TNF-α含量,表明FA与CA对ETEC K88诱导的IPEC-J2细胞的炎症反应有积极的调节作用。
热休克蛋白是一类高度保守的应激蛋白,Hsp70是迄今为止已知的最高度保守的蛋白,在应激条件下(如紫外线辐射、细菌感染或炎症)对细胞具有保护作用,如提高细胞对损伤的耐受和应激能力[39]。近年来,多项研究表明Hsp70与抗氧化应激相关,例如,Mesalam等[40]研究发现,铅中毒可造成小鼠产生氧化应激并诱导Hsp70和炎症标志物的表达,而抗氧化剂硒和维生素E组合对小鼠铅中毒具有协同保护作用。目前,越来越多的研究表明,高水平的Hsp70对细胞具有保护作用,其保护机制与Hsp70直接调控特定的细胞信号通路有关,且可能与调节NF-κB活性有关[41]。Bao等[42]早期研究表明,Hsp70在肝损伤小鼠中分别与IKKα和IκBα相互作用,从而抑制IκB降解和NF-κB活化。Lyu等[43]研究发现,Hsp70上调可显著抑制脂多糖(LPS)诱导的促炎介质TNF-α和IL-6的表达,以及犬巨噬细胞中的NF-κB活化。Bhagat等[44]研究表明,Hsp70通过阻止NF-κB活化来预防急性胰腺炎;Zhou等[45]研究发现,香叶基丙酮可诱导Hsp70表达,并通过抑制NF-κB/还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶(NOX)/ROS信号通路减轻肺纤维化;Li等[46]研究发现,谷氨酰胺通过促进Hsp70的表达缓解多鳞鲃毒液引起的谷氨酰胺代谢紊乱和心肺损伤,并抑制NF-κB p65和p53的活化延缓蛇毒的过程,降低死亡率。然而,Hsp70是否参与调节猪氧化应激仍未见报道。本试验发现,FA与CA能上调ETEC K88造成的Hsp70的mRNA相对表达量的下降,通过消耗IKKα稳定IκBα抑制NF-κB信号通路的激活。另外,本研究通过抑制Hsp70的表达,检测Hsp70对NF-κB信号通路的作用,试验结果表明,DMSO与ETEC K88共同处理和Hsp70抑制剂与ETEC K88共同处理均会激活NF-κB信号通路并降低上清液中抗氧化酶的活性,Hsp70抑制剂单独处理能降低上清液中抗氧化酶的活性,而FA与CA共同处理后上清液中抗氧化酶活性上调且NF-κB信号通路的激活被抑制,FA与CA共同处理与Hsp70在激活NF-κB信号通路方面具有相似的作用。这表明,抑制Hsp70的表达会加重ETEC K88造成的IPEC-J2细胞氧化应激,FA与CA可通过上调Hsp70抑制NF-κB信号通路的激活缓解这种氧化应激。
4 结 论
FA与CA联用可调节炎性细胞因子和氧化应激蛋白平衡,抑制ETEC K88黏附IPEC-J2细胞,可能通过上调Hsp70抑制NF-κB信号通路增强IPEC-J2细胞的抗炎与抗氧化能力,缓解ETEC K88诱导的IPEC-J2细胞氧化应激。
