丁酸钠通过G蛋白偶联受体41介导蛋白激酶B/哺乳动物雷帕霉素靶蛋白信号通路刺激牛乳腺上皮细胞增殖
2024-04-02卜丽君郎姣姣刘亚鹏夏呈强霍文婕
张 静 卜丽君 郎姣姣 刘亚鹏 夏呈强 霍文婕 刘 强
(山西农业大学动物科学学院,太谷 030801)
发展奶业的主要目标是生产更多的优质牛奶,牛乳腺的良好发育和功能分化是实现这一目标的关键[1]。产奶量被广泛认为与乳腺上皮细胞的数量及其分泌功能有关[2]。因此,奶牛乳腺发育调控是提高奶牛泌乳性能的关键。丁酸钠(SB)作为奶牛饲料添加剂,能够提升奶牛泌乳性能[3-4],降低乳房炎的发生率[5],也可以提高牛乳中脂肪的含量[4,6]。已有文献表明,在奶牛饲粮中添加丁酸盐可提高乳脂含量和产量[3-4]及营养物质消化率[7-8],但降低了血液中葡萄糖[9-11]、尿素氮和非酯化脂肪酸含量[10-11]。此外,SB在体外可提高牛乳腺上皮细胞(BMECs)中与泌乳相关基因的表达[12-13]。
迄今为止,关于SB的研究文献多数聚焦于对动物肠道形态、乳品质和抗氧化能力的影响等方面,体外研究主要聚焦于对细胞炎症反应的影响等方面[14-15]。在乳腺组织中,SB通过激活G蛋白偶联受体41(GPR41)介导腺苷5′-单磷酸活化蛋白激酶(AMPK)/哺乳动物雷帕霉素靶蛋白(mTOR)/核糖体蛋白S6激酶(S6K)信号通路,增加了胆固醇调节元件结合蛋白1(SREBP1)的核易位,并通过GPR41/AMPK/沉默信息调节因子2相关酶1(SIRT1)信号通路增加SREBP1的乙酰化,进而促进乳脂合成[13];SB也可通过激活GPR41介导磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)信号通路,改善脂多糖诱导的奶牛乳腺上皮细胞(MAC-T细胞)氧化应激损伤和凋亡[5]。因此,本研究假设SB通过激活GPR41介导Akt/mTOR信号通路,从而调控BMECs增殖和凋亡相关的基因和蛋白的表达,通过体外细胞试验,研究不同浓度SB对BMECs增殖的影响,并探究SB是否通过GPR41介导Akt/mTOR信号通路调控BMECs增殖的作用机制,为生产实践中利用SB营养手段促进奶牛乳腺的发育、提高奶牛泌乳性能提供依据。
1 材料与方法
1.1 试验材料
胶原酶A、SB购自美国Sigma公司。胰蛋白酶、青霉素/链霉素(PSN)、新生胎牛血清(FBS)和DMEM/F12购自美国GIBCO公司。Akt阻断剂(Akt-IN-1)和mTOR阻断剂雷帕霉素(Rap)购自美国MCE公司。GPR41小干扰RNA(siRNA)购自吉玛基因股份有限公司,RNA提取试剂盒购自广州美基生物科技有限公司,cDNA合成购自试剂盒购自宝日医生物技术(北京)有限公司。细胞计数试剂盒(CCK-8)购自日本Dojindo公司。5-乙炔基-2′脱氧尿嘧啶核苷(EdU)体外试剂盒(Cell-LightTM)购于广州瑞博生物科技有限公司。BCA蛋白浓度测定试剂盒购于美国Thermo Scientific公司。试验用的细胞培养瓶、培养板、0.22 μm一次性过滤器购自美国Corning公司,聚偏二氟乙烯(PVDF)蛋白转印膜购于德国Merck Millipore公司,70 μm细胞过滤筛购自美国BD公司。增殖细胞核抗原(PCNA)、Akt和β-肌动蛋白(β-actin)抗体购自美国Cell Signaling Technology公司,磷酸化磷脂酰肌醇-3-激酶(p-PI3K)抗体购自美国Santa Cruz公司。细胞周期蛋白(CCN)A1购自美国Novusbio Biologicals公司。磷脂酰肌醇-3-激酶(PI3K)、磷酸化蛋白激酶B(p-Akt)、磷酸化哺乳动物雷帕霉素靶蛋白(p-mTOR)、mTOR、B细胞淋巴瘤2(BCL2)、B细胞淋巴瘤2相关X蛋白(BAX)、半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)和半胱氨酸天冬氨酸蛋白酶-9(Caspase-9)抗体购自北京博奥森生物技术有限公司。
1.2 试验设计
试验采用单因素设计,将BMECs于37 ℃、5% CO2条件下在细胞培养箱中培养[16],当细胞长到90%时开始传代,传至4代,接种至96孔板,分别更换为添加不同浓度(0、15、30、45、60和75 μmol/L)SB的DMEM/F12(含10% FBS)培养基继续培养3 d,每次平行复孔8个,重复3次。通过CCK-8检测细胞活性,确定最适SB浓度。然后,以对照(Control,0 μmol/L)和最适SB浓度培养BMECs,采用实时荧光定量PCR(qRT-PCR)法和蛋白质印迹法(Western blot)检测BMECs细胞增殖、凋亡以及GPR41和Akt/mTOR信号通路相关基因和蛋白表达的变化,确定SB对BMECs细胞增殖、凋亡的影响及是否可能通过GPR41介导Akt/mTOR信号通路调控。之后,采用AKT-IN-1、Rap和GPR41 siRNA对信号通路进行阻断及受体进行沉默,采用CCK-8检测细胞活性,qRT-PCR和Western blot检测阻断后SB对BMECs细胞增殖、凋亡以及Akt/mTOR信号通路相关基因和蛋白表达的变化,确定SB是否通过GPR41受体调控Akt/mTOR信号通路进而调控对BMECs细胞增殖和凋亡。
1.3 试验方法
1.3.1 BMECs分离与培养
参考孔庆洋[17]的方法,从奶牛场采集3头健康泌乳奶牛[体重(638±14) kg、(45±4)月龄、泌乳(28±2) d]的乳腺组织,进行BMECs的分离培养。简而言之,乳腺先用75%酒精和磷酸盐缓冲液(PBS)(含50 μg/mL庆大霉素和1×PSN)进行冲洗,然后剥开外层乳腺组织,剪取适当的组织块(避开乳导管和血管等部位),放入Hank’s液(含50 μg/mL庆大霉素和1×PSN)中,转运至细胞房;组织块用3×双抗PBS清洗2次,转至超净台;在培养皿中修剪乳腺组织,然后转至另一培养皿中将组织块剪碎;剪碎的组织碎块置于25 cm2卡氏瓶中,加入20 mL消化培养基(DMEM/F12+5% FBS+1 mg/mL胶原酶A+50 μg/mL庆大霉素+1×PSN),在37 ℃条件下于摇床消化;然后以滴管轻轻吹散悬液,用细胞筛(70 μm)过滤至离心管(15 mL),在4 ℃条件下1 000×g离心10 min,弃上清,用PBS(含50 μg/mL庆大霉素和1×PSN)洗3次。用完全培养基(DMEM/F12+10% FBS+1×PSN)重悬细胞,按25 cm2培养瓶中1.5×106个细胞进行接种后,在37 ℃、5% CO2条件下的培养箱中进行培养传代,本次试验所用细胞为第4代细胞。
1.3.2 不同浓度SB溶液的配制
称取5 mg的SB,用超纯水溶解,然后将SB溶液(初始浓度75 μmol/L)加到细胞完全培养基中,通过稀释调整SB浓度分别为15、30、45、60和75 μmol/L,现用现配。
1.3.3 SB对BMECs活性的影响
根据Zhang等[18]的方法,将BMECs接种于96孔板中(1×103个/孔),每孔200 μL,在37 ℃、5% CO2条件下的细胞培养箱中进行培养,细胞贴壁后更换为含不同浓度(0、15、30、45、60和75 μmol/L)SB的DMEM/F-12(含有10%FBS,1×PSN)培养基,在37 ℃、5% CO2条件下继续培养3 d。每次平行复孔8个,重复3次。最后每孔加入10 μL不含FBS的DMEM-F12和CCK-8检测液,继续孵育1 h,最后用酶标仪(Infinite 200 PRO)测定450 nm处吸光度值(OD450 nm)[16]。细胞相对增殖率计算公式如下:
细胞相对增殖率(%)=100×试验组OD450 nm/对照组OD450 nm。
1.3.4 EdU检测细胞增殖
根据Zhang等[18]的方法,将BMECs接种于96孔板中(1×103个/孔),每孔200 μL,每组6个复孔,在37 ℃、5% CO2条件下,分别培养于0和60 μmol/L SB的DMEM/F-12(含有10% FBS,1×PSN)培养基中培养3 d,之后PBS洗2次。50 μmol/L EdU培养基培养3 h,再用PBS洗涤3次,在25 ℃条件下用4%多聚甲醛固定30 min,然后在25 ℃条件下Apollo染色反应液和Hoechst 33342反应液黑暗染色30 min,倒置显微镜获取细胞图像。以EdU阳性核占总核的比例估算BMECs增殖率。
1.3.5 转染GPR41 siRNA
牛GPR41 siRNA序列(正向5′-CCUACAACAUGUCCCACAUTT-3′,反向5′-AUGUGGGACAUGUUGUAGGTT-3′)由吉玛基因公司合成。根据尚智援等[20]方法,在试验前,以GPR41非特异性siRNA作为阴性对照(NC),检测GPR41特异性siRNA的转染效率,发现GPR41非特异性siRNA对GPR41的表达没有影响,而GPR41特异性siRNA能够显著下调GPR41的表达,因此,可以采用GPR41特异性siRNA进行后续细胞转染试验。按照张静等[21]方法,BMECs长到90%时接种于6孔板中(1×105个),当细胞生长至50%左右时进行转染。按照4 μL/孔Lipofectamine 2000加入200 μL/孔Opti-MEM Medium的体系配制Lipid液待用;按照8 μL/孔FAM-siRNA加至200 μL/孔Opti-MEM Medium的体系配制siRNA液待用。将Lipid液和siRNA液混合均匀,室温静置20 min,制成FAM-siRNA-转染试剂混合物。将FAM-siRNA-转染试剂混合液加入含有细胞及培养基的孔中摇晃孔板使其混合,转移至培养箱中培养6 h,更换成完全培养基。隔天再次进行siRNA转染,再加处理物培养2 d。
1.3.6 SB对BMECs增殖和凋亡相关基因表达的影响
将BMECs放置于12孔板(1×104个/孔)中,每组6个重复孔,分别培养于0和60 μmol/L 的SB中3 d。之后按照说明书提取细胞总RNA,再用cDNA合成试剂盒反转录为cDNA,反应条件为:37 ℃,15 min;85 ℃,5 s[19]。内参采用甘油醛-3-磷酸脱氢酶(GAPDH),以qRT-PCR法测定BMECs增殖(CCNA2、CCND1和PCNA)和凋亡基因(BCL2、BAX、Caspase-3和Caspase-9)的表达。PCR反应条件为:95 ℃预变性20 s,1个循环;55 ℃退火20 s,95 ℃延伸15 s,40个循环。引物序列见表1。采用2-ΔΔCt法计算目的基因的mRNA相对表达量。

表1 引物序列
1.3.7 SB对BMECs增殖和凋亡相关蛋白表达的影响
将2×104个/孔BMECs放置于6孔板中,分别培养于0和60 μmol/L的SB中3 d,每剂量3个重复孔。蛋白含量分析使用BCA蛋白测定试剂盒。以β-actin为上样对照,用10%或12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离等量蛋白(20 μg),将分离的蛋白转移到PVDF膜上,在室温下用6%(质量体积比)牛血清白蛋白(BSA)在Tris盐缓冲液(TBS)加吐温-20(TBST)中封闭膜2 h。转移膜与CCNA1(1∶2 000)、PCNA(1∶2 000)、Akt(1∶2 000)、p-Akt(1∶2 000)、mTOR(1∶2 000)、p-mTOR(1∶2 000)、BCL2(1∶2 000)、BAX(1∶2 000)、Caspase-3(1∶2 000)、Caspase-9(1∶2 000)和β-actin(1∶10 000)的一抗用TBST稀释孵育,在4 ℃下孵育过夜。用TBST洗涤5次,洗涤5 min,去除多余的抗体,然后与二抗在25 ℃下孵育2 h。TBST清洗,ChampChemi凝胶成像仪扫描分析,蛋白统计软件(Image J)扫描灰度进行统计[20]。
1.4 数据统计分析
试验数据均采用SigmaPlot 12.5统计分析包进行统计分析,对不同浓度SB的处理效应进行线性和二次曲线分析,对其他数据以t检验进行生物统计。当P<0.01时表示差异极显著,当P<0.05时表示差异显著。文中所有数据制图均采用SigmaPlot 12.5统计软件完成。
2 结 果
2.1 SB对BMECs增殖的影响
如图1所示,CCK8试验结果表明SB对BMECs增殖呈二次曲线变化,与对照组相比,60 μmol/L的SB显著刺激BMECs的增殖(P<0.05;图1-A)。因此,选择60 μmol/L的SB,并在后续试验中使用。同时,EdU检测结果表明,与对照组相比,60 μmol/L的SB极显著提高了BMECs的EdU阳性细胞率(P<0.01;图1-B、图1-C)。与对照组相比,60 μmol/L的SB极显著提高了BMECs增殖相关基因PCNA、CCNA2和CCND1的mRNA相对表达量(P<0.01;图1-D),显著提高了BMECs增殖相关蛋白PCNA和CCNA1的蛋白相对表达量(P<0.05;图1-E、图1-F)。

CCNA2:细胞周期蛋白A2 cyclin A2;CCND1:细胞周期蛋白D1 cyclin D1;CCNA1:细胞周期蛋白A1 cyclin A1;PCNA:增殖细胞核抗原 proliferating cell nuclear antigen;β-actin:β-肌动蛋白;Control:对照;SB:丁酸钠 sodium butyrate。下图同 the same as below。
2.2 SB对BMECs凋亡的影响
由图2可知,与对照组相比,60 μmol/L的SB极显著提高了抑制BMECs凋亡相关基因BCL2的mRNA相对表达量(P<0.01),极显著降低了促进BMECs凋亡相关基因BAX的mRNA相对表达量(P<0.01),显著降低了促进BMECs凋亡相关基因Caspase-3和Caspase-9的mRNA相对表达量(P<0.05),极显著提高了BCL2/BAX比值(P<0.01;图2-A)。同时Western blot分析结果表明,与对照组相比,60 μmol/L的SB显著提高了BCL2的蛋白相对表达量(P<0.05),极显著降低BAX的蛋白相对表达量(P<0.01),显著降低Caspase-3和Caspase-9的蛋白相对表达量(P<0.05),显著提高BCL2/BAX比值(P<0.05;图2-B、图2-C)。
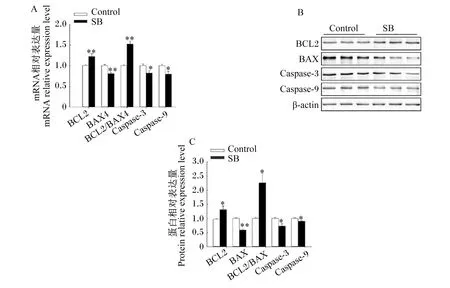
BCL2:B淋巴细胞瘤2 B-cell lymphoma 2;BAX:B淋巴细胞瘤2相关X蛋白 BCL2 associated X protein;Caspase-3:半胱氨酸天冬氨酸蛋白酶-3 cysteine aspartic acid specific protease-3;Caspase-9:半胱氨酸天冬氨酸蛋白酶-9 cysteine aspartic acid specific protease-9。下图同 the same as below。
2.3 SB对BMECs Akt/mTOR信号通路的影响
由图3可知,与对照组相比,60 μmol/L的SB显著提高了p-Akt/Akt比值(P<0.05),极显著提高了p-mTOR/mTOR比值(P<0.01)。

Akt:蛋白激酶B protein kinase B;p-Akt:磷酸化蛋白激酶B phosphorylated protein kinase;mTOR:哺乳动物雷帕霉素靶蛋白 mammalian target of rapamycin;p-mTOR:磷酸化哺乳动物雷帕霉素靶蛋白 phosphorylated mammalian target of rapamycin。下图同 the same as below。
2.4 阻断Akt信号通路对BMECs增殖和凋亡相关基因和蛋白表达的影响
为研究SB是否通过Akt信号通路促进BMECs增殖,我们使用AKT-IN-1进行了阻断试验。结果表明,30 nmol/L的AKT-IN-1对BMECs的增殖无显著影响(P>0.05),且30 nmol/L的AKT-IN-1可以极显著阻断60 μmol/L的SB对BMECs增殖的促进作用(P<0.01)(图4-A)。30 nmol/L的AKT-IN-1显著逆转了60 μmol/L的SB对BMECs增殖相关基因PCNA和CCNA2 mRNA表达的促进作用(P<0.05),极显著逆转了对CCND1 mRNA表达的促进作用(P<0.01),以及显著逆转了抑制BMECs凋亡相关基因BCL2 mRNA表达的促进作用(P<0.05);30 nmol/L的AKT-IN-1显著逆转了60 μmol/L的SB对BMECs凋亡相关基因BAX、Caspase-3和Caspase-9 mRNA表达的抑制作用(P<0.05;图4-B)。同样,30 nmol/L的AKT-IN-1极显著逆转了60 μmol/L的SB对BMECs增殖相关蛋白PCNA和CCNA1表达的促进作用(P<0.01),显著逆转了抑制BMECs凋亡相关蛋白BCL2表达的促进作用(P<0.05),也显著逆转了BCL2/BAX比值的升高(P<0.05);30 nmol/L的AKT-IN-1极显著逆转了60 μmol/L的SB对BMECs凋亡相关蛋白BAX和Caspase-3表达的抑制作用(P<0.01),显著逆转了Caspase-9表达的抑制作用(P<0.05),极显著逆转了BMECs增殖相关通路p-Akt/Akt和p-mTOR/mTOR比值的促进作用(P<0.01;图4-C、图4-D)。
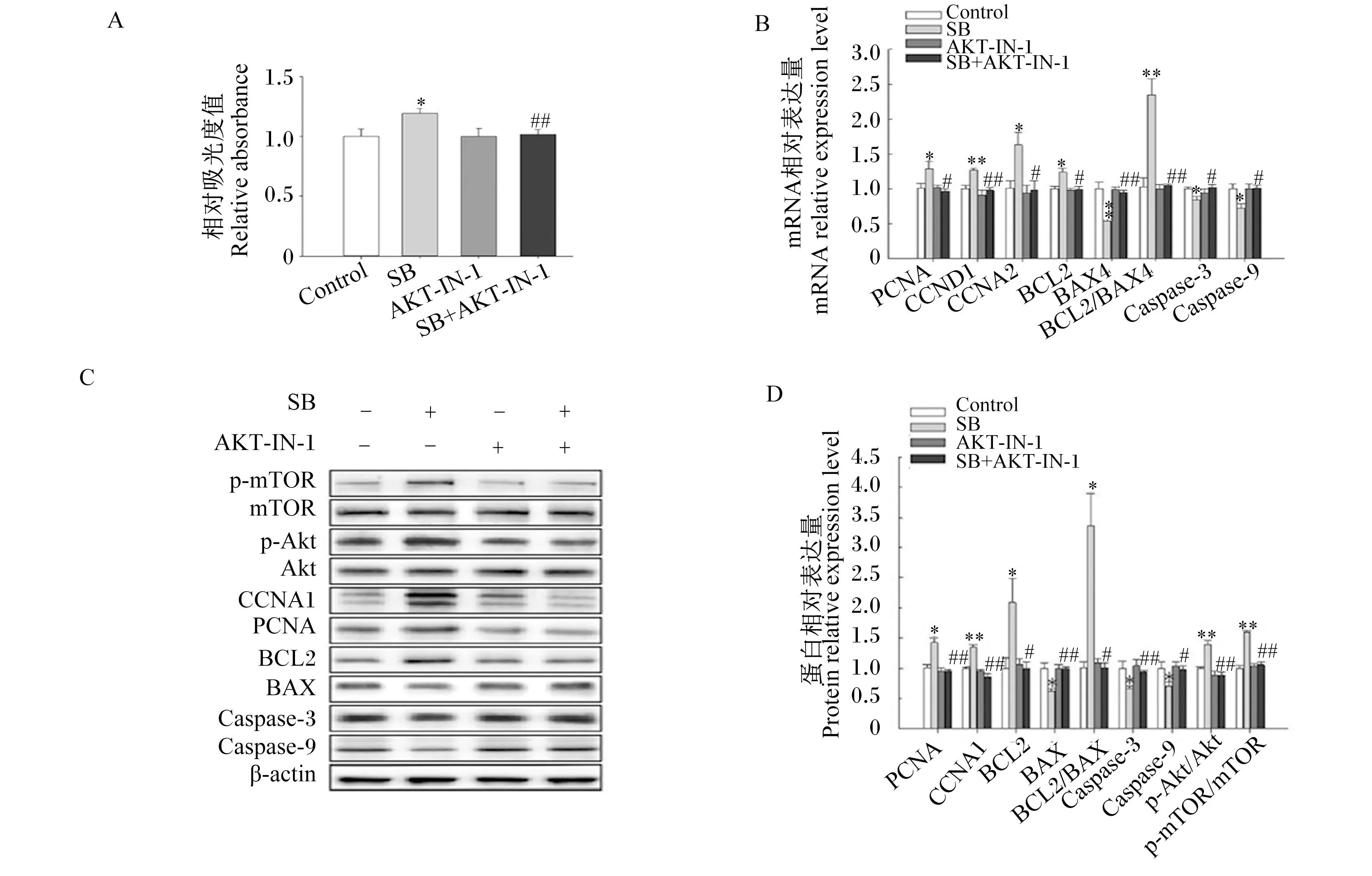
AKT-IN-1:蛋白激酶B阻断剂 protein kinase B blocker。
2.5 阻断mTOR信号通路对BMECs增殖和凋亡相关基因及蛋白表达的影响
为研究SB是否通过mTOR信号通路促进BMECs增殖,我们使用Rap进行了阻断试验。结果表明,50 pmol/L的Rap对BMECs的增殖无显著影响(P>0.05),且Rap可以极显著阻断60 μmol/L的SB对BMECs增殖的促进作用(P<0.01)(图5-A)。50 pmol/L的Rap显著逆转了60 μmol/L的SB对BMECs增殖相关基因PCNAmRNA表达的促进作用(P<0.05),极显著逆转了CCND1和CCNA2 mRNA表达的促进作用(P<0.01),也显著逆转了60 μmol/L的SB对BMECs增殖相关蛋白PCNA和CCNA1表达的促进作用(P<0.05),而且显著逆转了BMECs增殖通路p-mTOR/mTOR比值的促进作用(P<0.05;图5-B、图5-C、图5-D)。值得注意的是,50 pmol/L的Rap抑制mTOR但对BMECs凋亡和SB激活的Akt信号通路相关的mRNA或蛋白表达无显著影响(P>0.05;图5-B、图5-C、图5-D)。

Rap:哺乳动物雷帕霉素靶蛋白阻断剂雷帕霉素;mammalian target of rapamycin blocker rapamycin。
2.6 SB对BMECs中GPR41基因和蛋白表达的影响
与对照组相比,60 μmol/L的SB极显著提高了BMECs中SB受体GPR41的mRNA相对表达量(P<0.01,图6-A),显著提高了BMECs中SB受体GPR41的蛋白相对表达量(P<0.05,图6-B)。
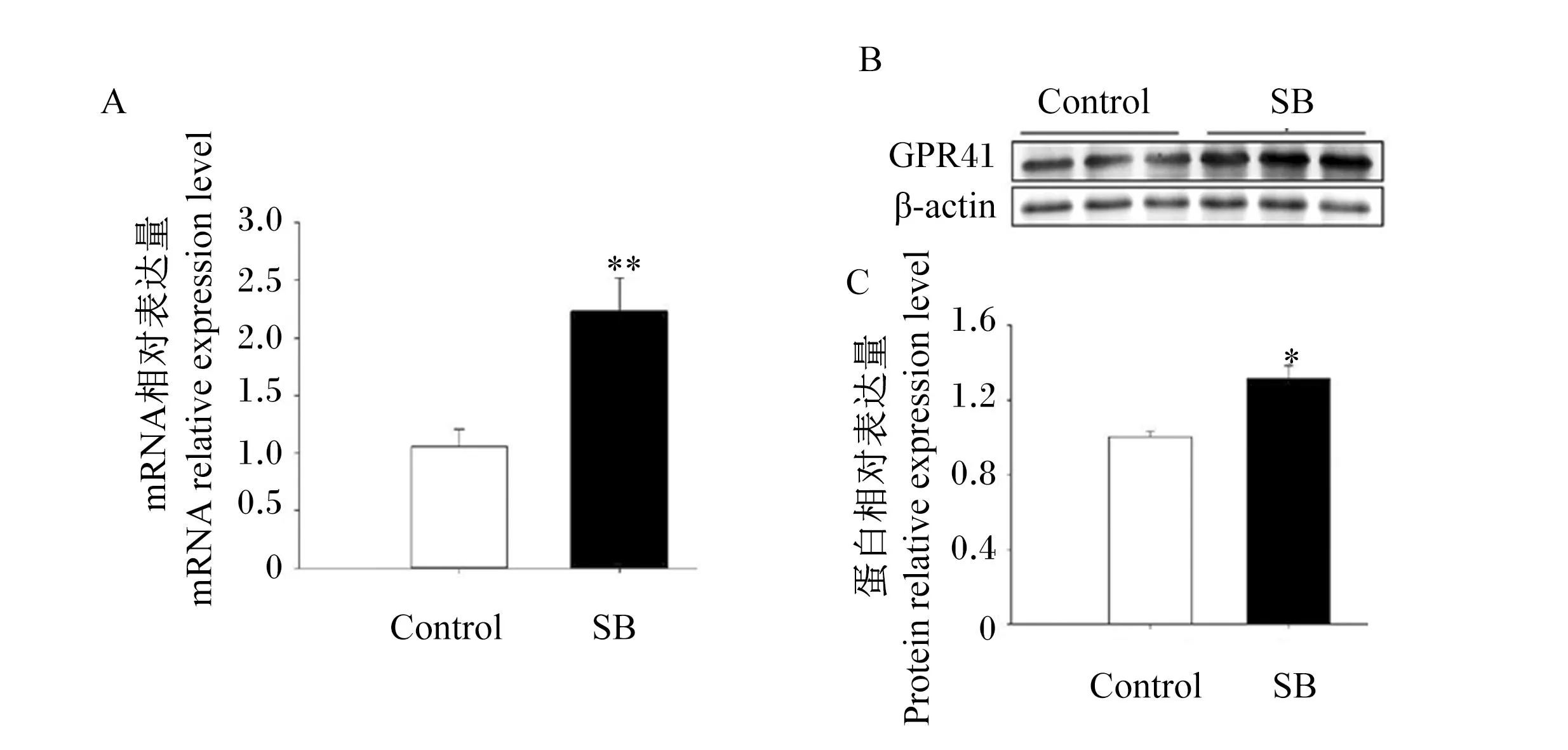
GPR41:G蛋白偶联受体41 G-protein-coupled receptor 41。下图同 the same as below。
2.7 GPR41 siRNA对促进BMECs增殖及相关蛋白表达的影响
为研究SB是否通过GPR41调控BMECs增殖,我们通过GPR41 siRNA进行了沉默试验。GPR41 siRNA对BMECs的增殖无显著影响(P>0.05),且GPR41 siRNA可以极显著沉默60 μmol/L的SB对BMECs增殖的促进作用(P<0.01)(图7-A)。GPR41 siRNA显著逆转了60 μmol/L的SB对BMECs增殖相关基因PCNA和CCND1 mRNA表达的促进作用(P<0.05),极显著逆转了CCNA2 mRNA表达的促进作用(P<0.01),以及显著逆转了抑制BMECs凋亡相关基因BCL2 mRNA表达的促进作用(P<0.05);GPR41 siRNA显著逆转了60 μmol/L的SB对BMECs凋亡相关基因BAX、Caspase-3和Caspase-9的mRNA表达的抑制作用(P<0.05;图7-B)。同样,GPR41 siRNA极显著逆转了60 μmol/L的SB对BMECs增殖相关蛋白PCNA表达的促进作用(P<0.01),显著逆转了CCNA1表达的促进作用(P<0.05),以及极显著逆转了抑制BMECs凋亡相关蛋白BCL2表达的促进作用(P<0.01),也极显著逆转了BCL2/BAX比值的升高(P<0.01);GPR41 siRNA显著逆转了60 μmol/L的SB对BMECs凋亡相关蛋白BAX、Caspase-3和Caspase-9表达的抑制作用(P<0.05);GPR41 siRNA显著逆转了60 μmol/L的SB对BMECs增殖相关通路p-Akt/Akt和p-mTOR/mTOR比值(P<0.05),极显著逆转了对GPR41蛋白表达的促进作用(P<0.01;图7-C、图7-D)。

GPR41 siRNA:G蛋白偶联受体41小干扰RNA G-protein-coupled receptor 41 small interfering RNA。
3 讨 论
在本研究中,SB促进了BMECs的增殖相关mRNA或蛋白的表达,抑制了凋亡相关mRNA或蛋白的表达,这一结果支持了他人研究中SB促进泌乳量提升的结果[3,6]。本研究测定了不同浓度SB对BMECs增殖的影响,添加15~60 μmol/L的SB线性促进了BMECs的增殖,但75 μmol/L的SB却抑制了BMECs的增殖,说明SB促进BMECs增殖呈二次曲线变化,SB适宜浓度为60 μmol/L。
刺激BMECs增殖和抑制细胞凋亡是促进泌乳奶牛持续泌乳的关键控制点[21]。通过检测含有PCNA和CCN的增殖标志物CCNA2和CCND1的mRNA相对表达量,说明SB对BMECs增殖的调控作用。CCND主要调节细胞周期从G1期向S期的转变。CCNA被认为是S期DNA合成起始和终止所必需的[18,22]。CCNA2在所有增殖细胞中普遍表达,在S期和有丝分裂中均发挥作用[23]。此外,PCNA是参与DNA复制和蛋白质修复不可或缺的辅助因子[24]。还有文献报道,PCNA和Cyclin D3均参与乳腺上皮细胞增殖的调控[18,25]。在本研究中,添加60 μmol/L的SB提高了CCNA2、CCND1和PCNA的mRNA相对表达量,以及CCNA1和PCNA的蛋白相对表达量,说明60 μmol/L的SB促进了BMECs的增殖。
细胞凋亡是由BCL2家族蛋白诱导,经过线粒体和死亡受体2条通路,通过高度复杂的信号级联进行的。而且,对于BCL2家族蛋白,主要包括抗凋亡蛋白(如BCL2)和促凋亡蛋白(如BAX),参与凋亡细胞死亡的调节[26]。由于BCL2通过抑制BAX的活性来阻止细胞凋亡,因此高BCL2/BAX比值是细胞凋亡受到抑制的提示。因此,BCL2/BAX比值可以反映细胞凋亡的状态。线粒体和死亡受体途径都汇聚到半胱氨酸天冬氨酸蛋白酶(Caspase)的共同途径上,即Caspase-3和Caspase-9,这2种Caspase均作用于细胞凋亡的执行阶段[27],分别是细胞凋亡时的下游和上游信号传导分子[28]。这些物质的表达变化一定程度上反映了细胞凋亡的情况。为此,降低Caspase-3和Caspase-9的蛋白相对表达量说明抑制了细胞凋亡的发生。在本研究中,添加60 μmol/L的SB提高BCL2 mRNA和蛋白的表达,降低了BAX、Caspase-3和Caspase-9的mRNA和蛋白的表达,显著增加BCL2/BAX和BCL2/BAX比值,说明添加60 μmol/L的SB抑制了BMECs凋亡标志物的表达。因此,上述结果表明60 μmol/L的SB很可能通过刺激增殖标志物的表达和抑制凋亡标志物的表达来促进了BMECs的增殖。
最近,有很多研究表明Akt信号通路在多种细胞的增殖和凋亡中发挥调节作用,例如猪乳腺上皮细胞[18]、乳腺癌细胞[29]和HC11细胞[30]。在本研究中,Akt信号通路在BMECs增殖过程中被60 μmol/L的SB激活。当以AKT-IN-1阻断Akt信号通路后,逆转了60 μmol/L的SB促进的细胞活力,以及增殖标志物(PCNA、CCNA2和CCND1)和凋亡标志物(BCL2、BAX、Caspase-3和Caspase-9)的mRNA和蛋白表达。而且,p-Akt/Akt和p-mTOR/mTOR比值的逆转说明AKT-IN-1可阻断Akt和mTOR的磷酸化过程。结果提示Akt-mTOR信号通路可能参与了SB促进BMECs增殖的作用。
此外,mTOR信号通路也参与调节多种细胞的增殖[31]。在本研究中,当BMECs培养于60 μmol/L的SB中时,mTOR信号通路也被激活。当以Rap阻断mTOR信号通路时,逆转了60 μmol/L的SB促进的细胞活力,并改变了增殖标志物的mRNA和蛋白表达,但未逆转凋亡标志物的mRNA和蛋白表达。而且,p-mTOR/mTOR比值的逆转说明Rap可阻断mTOR的磷酸化过程。这些结果表明mTOR信号通路可能参与了SB调控的促BMECs增殖作用。在本研究中,AKT-IN-1阻断了p-Akt/Akt和p-mTOR/mTOR比值,同时Rap可阻断p-mTOR/mTOR比值;然而,Rap对p-Akt/Akt比值没有阻断作用。因此,补充SB通过调节Akt/mTOR信号通路刺激BMECs增殖。综上所述,这些结果表明SB通过调节Akt/mTOR信号通路刺激BMECs增殖。
研究表明,GPR41主要在脂肪组织中表达,可以被短链脂肪酸激活[32-33],从而调控脂质代谢[34]。还有研究表明,GPR41在BMECs中也可以高表达[35]。SB是GPR41的配体,通过结合并激活GPR41调节细胞凋亡和炎症[5,36]。此外,添加SB可通过PI3K/Akt信号通路减少LPS诱导的MAC-T细胞的凋亡[5]。在本研究中,添加60 μmol/L的SB提高了GPR41的mRNA和蛋白的表达,说明SB能够激活BMECs中GPR41的表达。当以GPR41 siRNA沉默GPR41表达后,逆转了60 μmol/L的SB促进的细胞活力,以及增殖标志物和凋亡标志物的mRNA和蛋白表达。而且,p-Akt/Akt和p-mTOR/mTOR比值的逆转说明GPR41 siRNA可通过干扰GPR41逆转Akt和mTOR的磷酸化过程。这一结果说明SB通过GPR41介导Akt/mTOR信号通路参与了BMECs的增殖调控。
在本研究中,添加60 μmol/L的SB培养泌乳前期奶牛BMECs,通过结合并激活GPR41,进一步介导Akt和mTOR的磷酸化,刺激增殖标志物的基因和蛋白表达,抑制凋亡标志物的基因和蛋白表达,从而促进了BMECs的增殖。但是SB是否会影响围产期和泌乳中后期奶牛BMECs的增殖需要进一步研究,是否会通过影响BMECs的分化刺激乳蛋白的合成也有待进一步研究。
4 结 论
① SB能够促进BMECs增殖,以60 μmol/L添加浓度较为适宜。
② SB通过GPR41介导的Akt/mTOR信号通路促进BMECs增殖。
