左旋肉碱对鳜生长、抗氧化能力及肠道和肝脏功能的改善作用研究
2024-04-02侯静宜许耀升方揽月陈雨霜刘天骥翟旭亮沈子伟李纪中陈拥军李洪琴
侯静宜 许耀升 方揽月 陈雨霜 刘天骥 李 虹 翟旭亮 薛 洋 沈子伟 李纪中 陈拥军 向 枭 李洪琴* 罗 莉*
(1. 西南大学水产学院,淡水鱼类资源与生殖发育教育部重点实验室,重庆 400716;2. 四川新希望六和科技创新有限公司,成都 610000;3. 重庆市水产技术推广总站,重庆 400400;4. 中国水产科学研究院长江水产研究所西南渔业研究中心,重庆 400400;5. 重庆市农业广播电视学校大足区分校,重庆 402360)
鳜(Sinipercachuatsi)是我国特有的淡水名贵鱼类,以其高营养价值备受消费者喜爱[1]。目前,我国鳜产量达40.15万t,产值超200亿元,成为最有潜力的养殖品种之一[2]。饲料化在鳜养殖中具有重要意义,不仅可以提高鳜的生长速度和产量,还能提高养殖效益和资源利用率,推动产业可持续发展。为此,本研究团队展开了用配合饲料与鲜活饵料养殖鳜的比较研究[3-5],发现鳜对蛋白质和脂肪需求很高,饲料中添加较多脂肪可节约蛋白质,减少氮排泄对养殖水体的破坏,却更容易引发脂肪代谢问题,甚至导致脂肪肝等肝胆疾病,影响鳜的健康。
左旋肉碱是一种类氨基酸,具有加速脂肪代谢、降低肝脏脂肪的效用,在配合饲料中添加左旋肉碱成为目前解决脂肪代谢问题的有效措施[6-7]。关于左旋肉碱在鱼类中的研究表明,草鱼(Ctenopharyngodonidella)饲料中添加适量左旋肉碱促进鱼体生长,维护肠道和肝脏健康,促进脂肪降解[8-9]。Mohseni等[10]在饲料中添加左旋肉碱饲喂欧洲鳇(Husohuso),发现左旋肉碱即可提高欧洲鳇生长与饲料转化率,还可提升繁殖成功率。王秋举[11]使用适宜水平左旋肉碱处理胖头鱥(Pimephales)肌肉细胞和草鱼卵巢细胞,发现左旋肉碱对鱼类的抗氧化能力和免疫系统具有促进作用。因此,本研究在鳜饲料中添加不同水平左旋肉碱,评估其对鳜生长性能、体组成、脂质代谢、抗氧化能力、肠道和肝脏功能等的影响,旨在确定鳜配合饲料中左旋肉碱适宜添加水平,为其作为营养性添加剂的科学应用提供理论依据。
1 材料与方法
1.1 试验饲料
试验所需鳜(广清一号翘嘴鳜)购于重庆市潼南名优鱼养殖基地,饲料原料由重庆新希望六和股份有限公司提供,所用左旋肉碱预混剂中左旋肉碱盐酸盐的质量百分比为19.0%~21.0%。根据鳜的营养需求,配制鳜基础饲料,在其基础上分别添加500、1 000、1 500、2 000和2 500 mg/kg的左旋肉碱预混剂(有效含量10%),用膨润土进行调平,配制成6种试验饲料,分别命名为D0、D50、D100、D150、D200和D250,左旋肉碱有效含量分别为0、50、100、150、200、250 mg/kg,试验饲料组成及营养水平见表1。饲料原料粉碎后过40目网筛,用膨化饲料制粒机(DGP40-C,邢台市裕工科技开发有限公司)制成直径2 mm、长度1.5 cm左右的膨化饲料,自然风干后双层塑料袋包装封口,-20 ℃冰箱保存。

表1 试验饲料组成及营养水平(风干基础)
1.2 试验设计及饲养管理
正式试验前,先将购回的鳜种暂养在室内养殖池,饲喂基础饲料1周,体质恢复后选择体质量为(53.98±1.32) g的鳜270尾,随机分成6组,分别饲喂6种试验饲料,每组3个重复,每个重复15尾鳜,饲养于农业农村部长江中上游渔业资源环境观察试验站玻璃养殖缸(长100 cm,宽30 cm,高60 cm)。水源为曝气自来水,每天早、晚各换水80%,水温为23~29 ℃,pH为6.7~7.2,溶解氧含量>7.0 mg/L,氨氮含量<0.5 mg/L,亚硝酸盐含量<0.05 mg/L,光周期(L:D)为12/12。每天投喂2次(09:00、18:00),表观饱食投喂。
1.3 样本采集
试验结束后,进行24 h饥饿处理,每组每个重复中随机选取6尾鳜采用MS-222麻醉,肝素钠润洗1 mL一次性无菌注射器,从每尾鳜尾部静脉采集血后4 500 r/min离心10 min,分装后迅速冷冻,并存放在-80 ℃冰箱备用。同时将鳜放置于冰上解剖,分离肝脏、前肠和背部肌肉并称重,取完整肝脏用滤纸吸干表面水分后称重,冰水浴下制备匀浆后3 000 r/min离心15 min,取上清液,分装后与其他组织一同存放于-80 ℃冰箱备用。每个重复中随机选取3尾鳜,取肝脏、前肠和背部肌肉组织样本,使用4%多聚甲醛溶液进行固定,用于制作组织切片。
1.4 指标测定
生长和形态指标计算公式如下:
增重率(WGR,%)=100×(Wt-W0)/W0;饲料系数(FCR)=F/(Wt-W0);体长/体高=BL/BH;脏体比(VSI,%)=100×Wv/W;肝体比(HSI,%)=100×Wl/W;肥满度(CF,g/cm3)=100×W/BL3。
式中:W0为初始均重(g);Wt为终末均重(g);F为摄食饲料干重(g);W为试验鱼体重(g);Wv为内脏团重(g);Wl为肝脏重(g);BL为鱼体长(cm);BH为鱼体高(cm)。
饲料、肌肉和肝脏常规营养成分测定:水分含量采用105 ℃恒温干燥法(GB/T 6435—2006)测定;粗蛋白质(CP)含量采用凯氏定氮法(GB/T 6432—1994)测定;粗脂肪(EE)含量采用索氏抽提法(GB/T 6433—1994)测定;粗灰分(Ash)含量采用550 ℃马弗炉煅烧法测定。
肠道消化酶活性测定:使用南京建成生物工程研究所生产的试剂盒测定前肠中的胃蛋白酶(M1602A)、胰蛋白酶(A080-2-2)、脂肪酶(A054-1-1)、淀粉酶(C016-1-1)和Na+-K+-ATP酶(A070-2-2)的活性,按照试剂盒说明书进行操作。
血浆中肠黏膜通透性相关指标测定:将已经冷冻的血浆样品在室温下解冻,使用上海优选生物科技有限公司的酶联免疫吸附试验(ELISA)试剂盒,测定血浆二胺氧化酶(DAO)活性、内毒素(LPS)以及D-乳酸(D-LA)含量。
血浆中肝脏功能和免疫相关指标测定:将已经冷冻的血浆样品在室温下解冻,使用南京建成生物工程研究所生产的试剂盒,测定血浆谷丙转氨酶(ALT)(C009-1-1)、谷草转氨酶(AST)(C010-1-1)的活性;使用华研生物科技有限公司生产的ELISA试剂盒,测定血浆免疫球蛋白M(IgM)的含量。
血浆和肝脏中抗氧化指标测定:将已经冷冻的血浆和肝脏匀浆上清液在室温下解冻,使用南京建成生物工程研究所生产的试剂盒,测定血浆和肝脏中总抗氧化能力(T-AOC)(A015-1-2)与丙二醛(MDA)(A003-1-1)含量。
血浆中脂质代谢相关指标测定:使用南京建成生物工程研究所生产的试剂盒测定血浆甘油三酯(TG)(A110-2-1)、总胆固醇(TC)(A111-2-1)、高密度脂蛋白胆固醇(HDL-C)(A112-2-1)、低密度脂蛋白胆固醇(LDL-C)(A113-2-1)含量。
组织切片:肠道、肝脏、肌肉组织的苏木精-伊红染色切片、肝脏油红染色切片由华研生物科技有限公司代制。显微镜下观察切片油红O染色面积、肌纤维直径与密度、肌层厚度、绒毛长度等,经图像分析最终计算数值。
1.5 数据处理
试验数据采用SPSS 26.0软件进行单因素方差分析(one-way ANOVA),然后用Duncan氏多重比较法比较不同组之间的差异显著性,显著性水平为P<0.05。结果数据以平均值±标准差(mean±SD)的形式进行呈现。
2 结 果
2.1 左旋肉碱对鳜生长性能及形体指标的影响
由表2可见,随着饲料中左旋肉碱添加水平的增加,鳜WGR呈先升后降的趋势,在D100组达到最大值,较D0组显著提高21.99% (P<0.05),D250组为最小值,较D0组显著降低22.36% (P<0.05);FCR呈先降后升的趋势,D100组达到最低值,较D0组显著降低16.94% (P<0.05),D250组达到最大值,较D0组显著增加25.81% (P<0.05)。与D0组相比,BL/BH显著增高(P<0.05),但添加组之间差异不显著(P>0.05)。与D0组相比,VSI和HSI均显著降低(P<0.05)。CF仅在D100组显著低于D0组,其他组间差异不显著(P>0.05)。
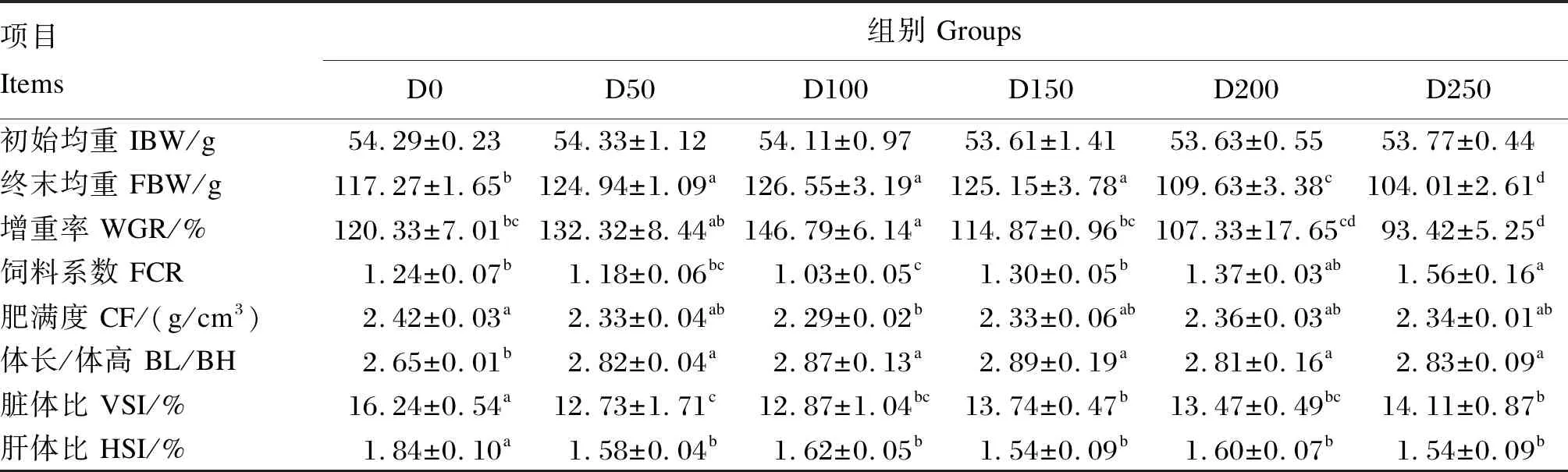
表2 左旋肉碱对鳜生长性能及形体指标的影响
由图1可见,WGR(y1)与左旋肉碱添加水平(x)的二次曲线关系为:y1=-1 553.9x2+250.5x+124.37(R2=0.793 8,P<0.05),FCR(y2)与左旋肉碱添加水平(x)的二次曲线关系为:y2=-15.214x2-2.409 3x+1.232 5(R2=0.863 7,P<0.05)。将其作为效应指标进行拟合,得出鳜饲料中左旋肉碱的适宜添加水平为79.27~80.61 mg/kg。
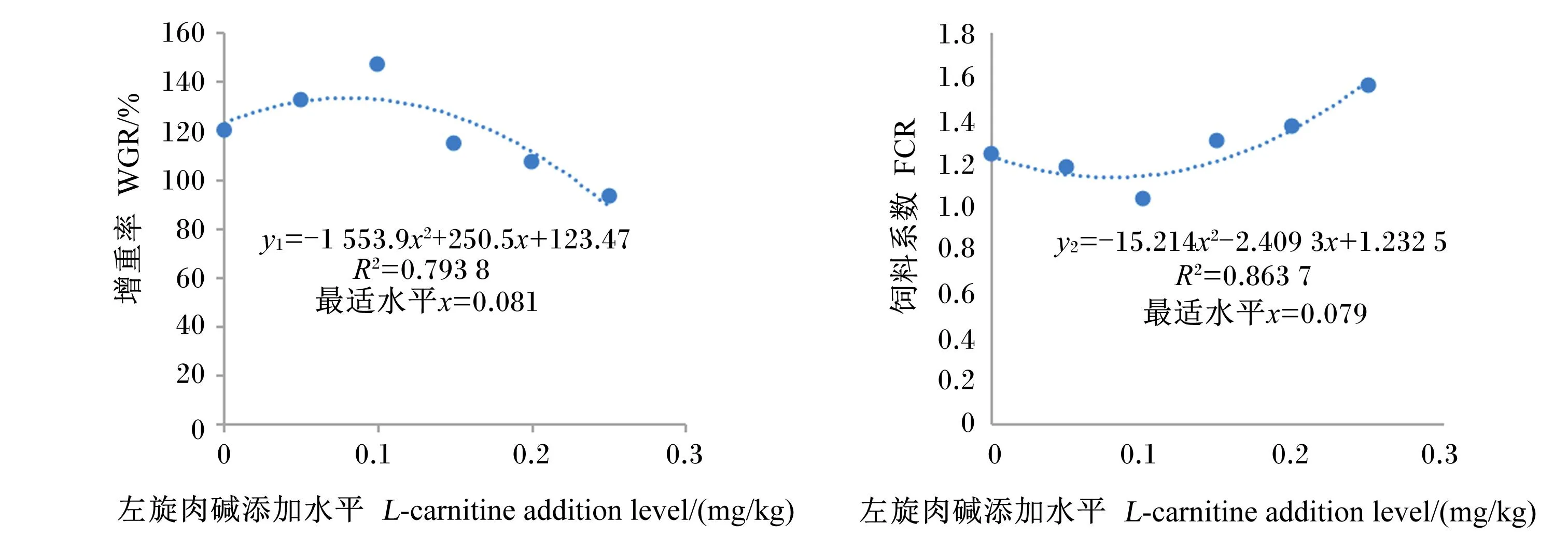
图1 左旋肉碱添加水平与增重率、饲料系数的拟合关系
2.2 左旋肉碱对鳜肝脏、肌肉营养组成的影响
由表3可见,随着饲料中左旋肉碱添加水平的增加,鳜肝脏粗脂肪含量呈先下降后趋于平稳的趋势,D50~D250组较D0组分别显著降低了6.84%、14.18%、15.19%、17.47%和15.44%(P<0.05);肝脏水分含量则无显著变化(P>0.05)。随着饲料中左旋肉碱添加水平的增加,鳜肌肉水分、粗灰分、粗蛋白质、粗脂肪含量变化均不显著(P>0.05)。

表3 左旋肉碱对鳜肝脏与肌肉营养组成的影响
2.3 左旋肉碱对鳜血浆中肝脏功能、脂质代谢相关指标的影响
由表4可见,随着饲料中左旋肉碱添加水平的增加,血浆AST、ALT活性均呈先降后升的趋势,均在D100组达到最低,D250组达到最高,血浆AST活性在D100组较D0组显著降低了45.64%(P<0.05),D250组较D0组显著升高了46.96%(P<0.05);血浆ALT活性在D100组较D0组显著降低了19.44% (P<0.05),D250组较D0组显著升高了22.20%(P<0.05)。血浆TG、TC含量各试验组均较D0组显著降低(P<0.05);血浆HDL-C含量各组间差异不显著(P>0.05),LDL-C含量随着左旋肉碱添加水平上升而降低,D100、D150组差异显著(P<0.05)。
2.4 左旋肉碱对鳜肠道消化酶活性的影响
由表5可见,随着饲料中左旋肉碱添加水平增加,肠道中胃蛋白酶、胰蛋白酶、淀粉酶和Na+-K+-ATP酶活性呈先升后降的趋势。在D100组达到最大值,较D0组分别提升了11.85%、45.85%、34.33%、30.54%(P<0.05),胃蛋白酶、肠道淀粉酶和Na+-K+-ATP酶活性在D250组达到最小值,较D0组分别显著降低了8.95%、16.67%、34.10%(P<0.05)。与D0组相比,试验组脂肪酶活性均显著升高(P<0.05)。

表5 左旋肉碱对鳜肠道消化酶活性的影响
2.5 左旋肉碱对鳜血浆中肠黏膜通透性相关指标的影响
由表6可见,随着饲料中左旋肉碱添加水平的增加,血浆D-LA含量先降后升,D150组达最低值,较D0组显著降低31.08%(P<0.05)。血浆DAO活性先降后升,D100组达最低值,较D0组显著降低21.11%(P<0.05)。此外,与D0组相比,LPS含量各试验组均显著降低(P<0.05)。

表6 左旋肉碱对鳜血浆中肠黏膜通透性相关指标的影响
2.6 左旋肉碱对鳜血浆和肝脏中抗氧化指标及血浆免疫指标的影响
由表7可见,随着饲料中左旋肉碱添加水平的增加,血浆T-AOC呈现先升后降的趋势,在D100组,血浆T-AOC达最大值,相较于D0组显著增加了29.73% (P<0.05);而在D250组,血浆T-AOC达最小值,较D0组显著降低了25.83% (P<0.05)。D100组血浆MDA含量较D0组显著降低了12.79% (P<0.05),而D250组较D0组显著升高了23.27% (P<0.05)。肝脏T-AOC也呈现先升后降的趋势,在D100组达到最高值,较D0组显著增加了9.90% (P<0.05),而D250组较D0组显著降低了8.41% (P<0.05)。肝脏MDA含量在D100组达到最低值,较D0组显著降低了31.25% (P<0.05)。此外,与D0组相比,血浆IgM含量在所有添加左旋肉碱的组中均显著增加(P<0.05),其中D100组达到最高值,较D0组升高了22.18%。
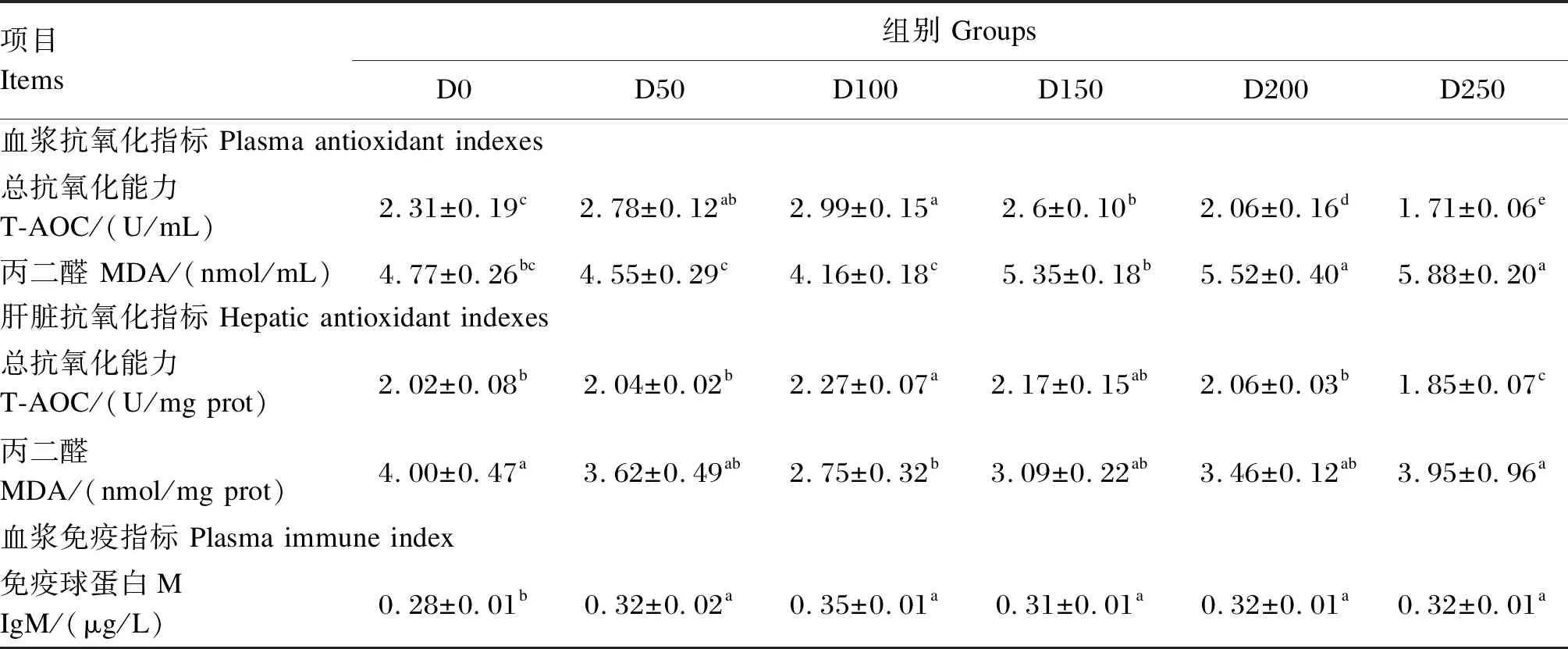
表7 左旋肉碱对鳜血浆和肝脏中抗氧化指标及血浆免疫指标的影响
2.7 左旋肉碱对鳜肠道、肝脏、肌肉的组织结构的影响
由图3、表8可见,与D0组相比,D100组肠道绒毛长度、杯状细胞密度显著升高(P<0.05),分别增长38.05%、29.01%;各组间肌层厚度与绒毛根数变化不显著(P>0.05);D250组与D0组相比各指标差异不显著(P>0.05)。

a:D0组;b: D100组;c:D250组。a: group D0; b: group D100;c: group D250.
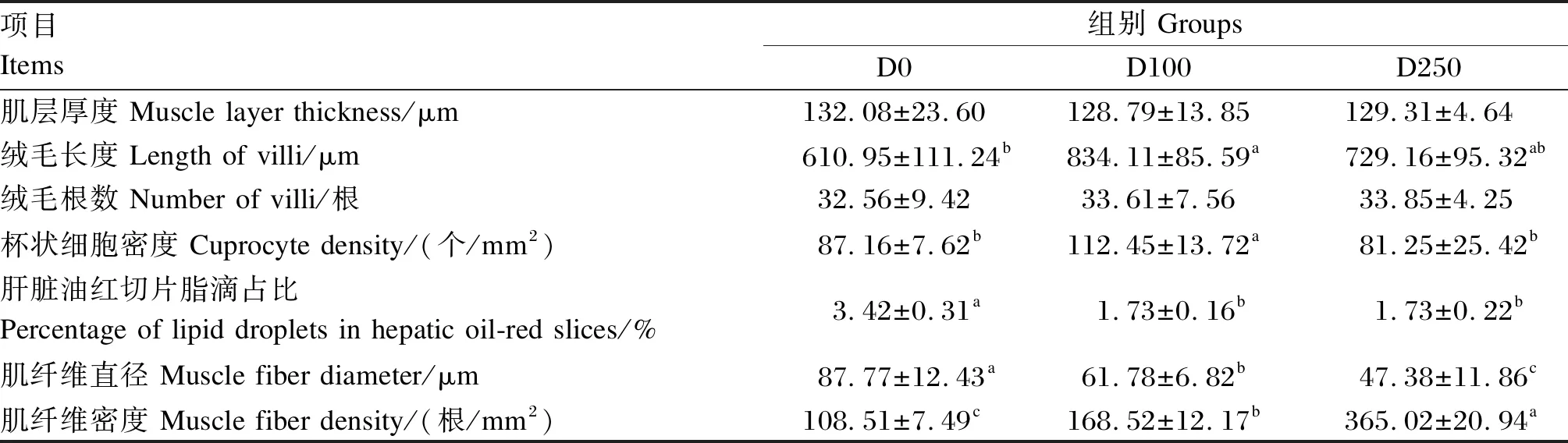
表8 左旋肉碱对鳜肠道、肝脏、肌肉组织结构的影响
由图4、表8可见,D100、D250组较D0组肌肉结构更加紧密。D100、D250组肌纤维直径较D0组显著降低(P<0.05),肌纤维密度显著升高(P<0.05)。

a:D0组;b: D100组;c:D250组。a: group D0; b: group D100; c: group D250.
由图5、表8可见,D100组肝细胞较D0组排列更紧密,细胞肿胀、空泡化现象明显减少; D250组肝细胞排列更稀松、空泡化现象明显增多。D0组肝脏油红切片中脂滴占比3.42%,D100和D250组肝脏油红切片中脂滴占比均为为1.73%,较D0组显著减少(P<0.05)。
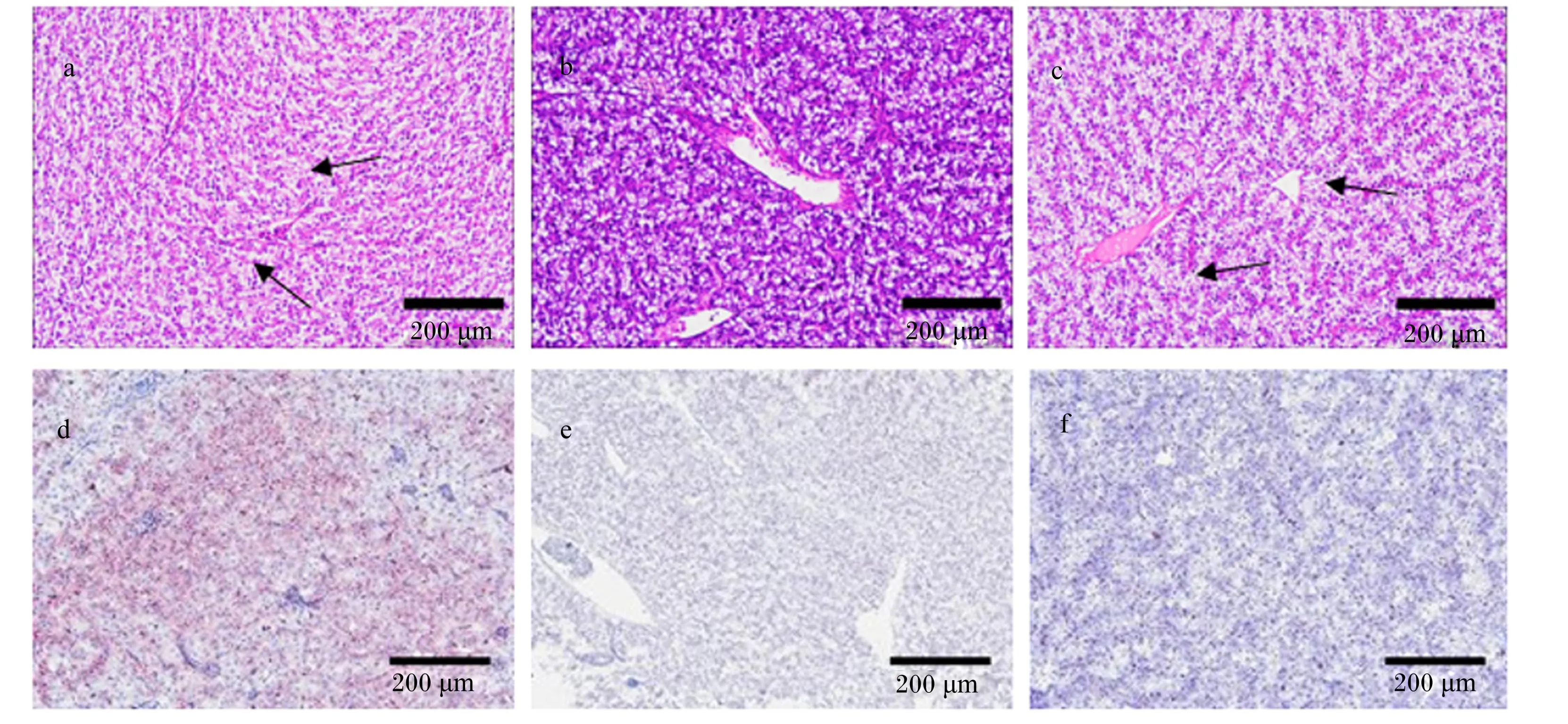
a、b、c为苏木精-伊红染色,d、e、f为油红O染色。肝细胞空泡变性,如箭头所示。a, b and c are hematoxylin-eosin staining, d, e and f are oil red O staining. Hepatocyte vacuolar degeneration were observed,as shown by the arrow.
3 讨 论
3.1 左旋肉碱对鳜生长性能与形态指标的影响
研究证明,左旋肉碱对鲤鱼(Cyprinuscarpio)[12]、草鱼[9]、青鱼(Mylopharyngodonpiceus)[13]、鲫鱼(Carassiusauratus)[14]和吉富罗非鱼(Oreochromisniloticus)[15]、奥尼罗非鱼(Oreochromisaureus)[16]等的生长性具有促进作用。本研究饲料中添加100 mg/kg的左旋肉碱显著促进鳜生长和饲料转化。通过对WGR与左旋肉碱添加水平以及FCR与左旋肉碱添加水平的二次曲线关系进行拟合,确定适宜的左旋肉碱添加水平为79.27~80.61 mg/kg。低于或高于此范围均可能影响鳜的最佳生长,且250 mg/kg左旋肉碱添加后生长和饲料转化均明显抑制。
鱼类形体指标主要用于描述鱼类形态特征、生长发育状态及其物理特性。本研究发现,左旋肉碱添加后鳜的BL/BH均增加,CF均下降,说明左旋肉碱可使鳜体型相对“瘦长”,各添加水平之间无差异。此外,组织学分析发现左旋肉碱使肌纤维更细、排列更紧密,可能由于左旋肉碱在肌肉纤维中常与脂肪酸结合形成肉碱酯酰转移酶,协助将长链脂肪酸转运至线粒体中氧化放能。因此,摄入左旋肉碱帮助鳜更有效地利用脂肪酸,合成更细更紧密的肌肉纤维。
3.2 左旋肉碱对鳜消化功能的促进作用
肠道是动物主要的营养物质消化和吸收器官,肠道黏膜上的绒毛数量和长度可以反映出动物对营养物质的消化吸收能力。有研究分别在猪(Susscrofa)和草鱼饲料中添加100 mg/kg的L-肉碱,使肠道脂肪酶活性显著提升[9],本研究结果与前人研究结果一致。左旋肉碱适量添加(100 mg/kg)后显著提高鳜肠道绒毛发育,有助于促进肠道细胞生长。肠道组织结构消化酶的活性可以反映消化吸收的能力,适量添加左旋肉碱时活性升高,而过量添加则导致活性降低。左旋肉碱对消化酶活性的作用可能与其对脂肪分解的促进作用有关,它的添加减少了机体中脂肪的积累,因而提高了机体对脂肪的需求。过量添加可能导致肠道微生物菌群失衡、干扰肠道细胞的代谢和分泌,使消化酶的活性下降。
综上所述,添加适宜水平的左旋肉碱在提升鳜肠道绒毛生长、消化酶活性方面表现出积极作用,有助于提高鳜消化吸收能力。然而,过量添加左旋肉碱可能导致消化酶活性降低,需要注意避免过度使用。
3.3 左旋肉碱对鳜抗氧化功能改善与免疫能力提升作用
在鳜的消化过程中,难免会有一些食物的残渣和营养物质的残留随排泄物一起排出体外,易滋生细菌;且鳜因背鳍和胸鳍尖锐,争食时易相互摩擦受伤,甚而互咬互食,极易形成皮肤损伤、感染,进而引发闭口、体质下降和其他疾病。如何通过营养调控改善鳜机体抗氧化功能与免疫能力成为饲料优化的关键环节。明建华等[13]指出添加左旋肉碱可提高青鱼的抗氧化能力和免疫力,对草鱼、欧洲鳇的研究也有类似发现[10-11]。前人研究表明,左旋肉碱对酰基辅酶A与辅酶A比例具有调节功能,可减轻氧化应激反应自由基造成的损害,还能激活核转录因子E2相关因子2(Nrf2)与血红素氧合酶-1(HO-1)信号通路,减少心肌细胞的氧化应激和凋亡,减少机体患病可能[17-18]。本试验也证明,左旋肉碱适量添加可提升血浆、肝脏的抗氧化能力和血浆免疫球蛋白含量,其中D100组达到最大值。
肠道黏膜在机体免疫中起着重要作用。随着左旋肉碱添加水平的增加,鳜血浆D-LA含量和DAO活性降低,同时LPS含量也减少。这表明添加适量左旋肉碱可保护肠道黏膜屏障,增强机体免疫能力。
3.4 左旋肉碱对鳜肝脏功能和脂质代谢的影响
肝脏是鱼类中间代谢的主要器官。当肝细胞遭受损伤时,内部的AST和ALT会释放入血液循环,从而导致血浆中的转氨酶活性升高。在本试验中,适量添加左旋肉碱时鳜血浆中AST和ALT活性显著降低。这表示适量添加左旋肉碱能显著减轻肝脏的代谢负担,减少肝细胞损伤,预防脂肪肝病,同时改善鳜肝脏的结构和功能。
小鼠(Musmusculus)[19]、鲈鱼(Lateolabraxjaponicus)[20]、斑点叉尾鮰(Ictaluruspunctatus)[21]、大西洋鲑(Salmosalar)[22]等的研究表明,左旋肉碱可通过调控脂肪酸的线粒体β氧化[23],或通过调节长链脂肪酸β氧化关键酶肉碱棕榈酰转移酶1(CPT1)的表达[24]来促进脂质分解代谢。本试验添加左旋肉碱的各组血浆TG、TC含量均有不同程度降低,LDL-C含量也显著降低,而HDL-C含量差异不显著,说明左旋肉碱可加快血液中的胆固醇转运至外周组织,降低血脂,减少肝脏脂质代谢负担和患病可能。显微结构观察发现,适量左旋肉碱促进肝细胞排列更加紧密,肿胀及空泡现象明显减少,肝脏中脂滴明显减少,脂肪含量降低。这表明其有助于肝细胞功能的修复,降低肝脏损伤风险。此外,随着左旋肉碱的添加水平逐渐增加,肝脏中的粗脂肪含量显著下降,而鳜肌肉脂肪、水分、粗灰分、粗蛋白质含量变化不显著,说明左旋肉碱在减少鳜肝脏脂肪沉积的同时,并不会影响其机体水分、肌肉脂肪和蛋白质含量,与前人研究[6-7]结果一致。
4 结 论
在本试验条件下,左旋肉碱可促进鳜肠道发育,增强消化吸收能力,提高生长速度,同时具有提高免疫力,减少肝脏脂肪沉积,改善肌肉品质的作用。以WGR与FCR为效应指标,鳜饲料中左旋肉碱适宜添加水平为79.27~80.61 mg/kg。
