海藻酶解物对大黄鱼生长和肠道菌群结构的影响
2024-04-02熊宇明董黎黎秦志清江和基黄志坚殷光文林建斌王登峰
张 露 熊宇明 董黎黎 梁 萍 秦志清 王 磊 江和基 黄志坚 殷光文 林建斌* 王登峰*
(1.福建农林大学动物科学学院(蜂学学院),福州 350002;2.福建省淡水水产研究所,福州 350002)
海藻及加工产物添加于畜禽和水产饲料中可以改善养殖动物的生长性能,提高生理活性、抗病力和抗应激能力[1-4]。海藻种类繁多,目前使用的海藻主要包括褐藻门的海带,绿藻门的石莼、浒苔,红藻门的紫菜、江蓠、石花菜等。其中,海带主要是由占干重45%的水溶性线性多糖褐藻酸、3%的海带多糖(可溶性多聚葡萄糖)、5%的硫酸化程度较低且具支链化的褐藻糖胶和10%的蛋白质组成;紫菜中主要为紫菜聚糖等具有支链的硫酸化程度较高的多糖和海藻蛋白,分别占干重的15%和30%;石莼中支链化和硫酸化程度较高的水溶性凝胶多糖约占干重的15%,蛋白质约占8%[5]。海藻中的功能性成分包括褐藻酸(胶)(alginate)、海带多糖(laminarin)、岩藻聚糖(fucoidan)、紫菜聚糖(porphyran)、绿藻多糖(ulvan)、卡拉胶(carrageenan)、多酚物质(polyphenols)及海藻蛋白质降解生成的寡肽等[6]。随着研究的深入,已逐步明确:1)通过海藻中的多样成分可提高肠道菌群的多样性和有益菌的丰度,产生对机体有益的影响(益生元样作用)[5,7];2)肠道特定的菌群可代谢海藻中不易被吸收的糖产生短链脂肪酸(short chain fatty acids,SCFAs)[8],促进CD4+T细胞和固有淋巴样细胞(innate lymphoid cells,ILCs)产生白细胞介素-22(IL-22),保护肠道免受炎症损害[9];3)海藻硫化多糖作用于细胞膜Toll样受体(Toll-like receptors,TLR)、细菌脂多糖的膜受体分化簇14(cluster of differentiation 14,CD14)等激活巨噬细胞,进而调节免疫系统[10];4)海藻中的天然凝胶多糖可以锁定水分增加粪便的体积,并具有益生元样作用的潜力[11-12];5)海藻中蛋白质经消化酶作用生成多肽(短肽),增强肠道菌群多样性和有益菌丰度,从而产生对机体形成有益的影响或直接调节肠上皮细胞分化和影响丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路,增强肠道和机体健康[5,13]。
大黄鱼(Larimichthyscrocea)是我国特有的重要海产之一,是东南沿海的主要经济鱼种,可以进行大规模的网箱养殖,是未来海洋牧业重点发展的方向之一。近两年,我国大黄鱼的产量均超过25万t[14]。大黄鱼是肉食性鱼类,随着养殖规模的不断扩大,养殖密度过高、养殖水域污染和投喂小杂鱼等导致的各种病害问题不断涌现,其中变形假单胞菌导致的内脏白点病、细菌性肠炎病、弧菌病等细菌性疾病较常见[15-16]。肠道是有害细菌入侵的主要途径,肠道菌群是肠道健康的基础,其厌氧发酵碳水化合物产生的SCFAs可调节肠道和宿主健康[4-5]。对大黄鱼肠道菌群的体外研究表明,大黄鱼肠道菌群可以合成SCFAs,添加0.5%复合海藻酶解物可增加丁酸合成量,并提升肠道菌群的α多样性,提高拟杆菌门(Bacteroidota)和分类未定细菌门(unidentified Bacteria)的相对丰度,预测复合海藻酶解物可促进大黄鱼肠道健康,增加存活率和改善生长性能[17]。
为验证海藻酶解物在大黄鱼生产中的应用效果,本试验在大黄鱼内脏白点病逐渐发生、流行的11—12月份使用添加0.5%的不同海藻酶解物(复合海藻酶解物与海带酶解物)饲喂大黄鱼8周,观察添加0.5%的不同海藻酶解物对大黄鱼存活率和生长的影响,并对肠道菌群结构和特定菌群的丰度进行分析,研究不同海藻酶解物对大黄鱼肠道菌群结构组成的影响以及与存活率和生长的相关性,为大黄鱼肠道菌群与健康的相关性研究以及开发海藻酶解物作为大黄鱼饲料添加剂提供技术支持。
1 材料与方法
1.1 试验材料
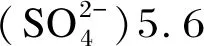
褐藻寡糖为商品化产品,来源于海带,是由α-L-古洛糖醛酸和β-D-甘露糖醛酸组成的直链寡糖,聚合度(degree of polymerization,DP)为2~25的寡糖含量≥90%。
从大黄鱼内脏白点病病例中分离的致病变形假单胞菌Pp-01和Pp-02由福建闽东水产研究所徐春霞老师惠赠。
1.2 试验设计
试验动物为福建宁德市富发水产有限公司提供的当年繁育的体重在(109.3±2.94) g的大黄鱼幼鱼。饲养试验在该公司海水养殖场进行,使用网箱进行饲养。将大黄鱼幼鱼随机分成3组,每组3个网箱(网箱规格1.0 m×1.0 m×2 m),每个网箱35尾。A组饲喂在基础饲料中添加0.5%复合海藻酶解物的试验饲料;D组饲喂在基础饲料中添加0.5%海带酶解物的试验饲料;E组为对照组,饲喂不添加海藻酶解物的基础饲料。大黄鱼基础饲料由41.4%进口红鱼粉、22.0%面粉、15.1%大豆粕、10.0%鸡肉粉、5.0%玉米蛋白粉、2.0%啤酒酵母和4.5%添加剂(多种维生素0.5%,矿物质1.0%,磷酸二氢钙1.5%,诱食剂1.0%,氯化胆碱0.5%)组成。按照配方将饲料原料及海藻酶解物混合均匀后制成浮性颗粒饲料,营养成分测定显示A组、D组和E组饲料水分含量分别为4.7%、4.8%和4.3%,粗蛋白质含量分别为41.5%、41.6%和41.7%,粗脂肪含量分别为8.1%、8.3%和8.0%,粗灰分含量分别为11.6%、11.7%和10.8%。
养殖试验期间每天早、晚各表观饱食投喂1次。试验时间在2022年11—12月,养殖周期共56 d。
1.3 样品采集与指标测定
1.3.1 成活率和平均增重测定
分组后称重记录每个网箱鱼的初始体重,饲喂试验结束后,饥饿24 h,对每个网箱鱼进行计数、称重作为终末体重。按照如下公式计算存活率和平均增重:
存活率(%)=100×终末鱼尾数/初始鱼尾数;平均增重(g)=终末平均体重-初始平均体重。
1.3.2 肠道菌群分析
饲喂试验结束后,饥饿24 h,准备消毒过的解剖盘及解剖器械,从每组的3个重复网箱中每箱随机采集1~2尾鱼,共5尾鱼,用75%酒精擦拭活体大黄鱼体表,无菌剖检,取出消化道,收集每尾鱼的小肠和直肠内容物、混匀,液氮冷冻备用。大黄鱼肠道菌群的16S rDNA扩增子测序分析均委托欧易生物技术(中国上海)有限公司进行,使用NovaSeq PE250方案,经过Reads拼接过滤、扩增子序列变体(ASVs)聚类后进行物种注释及丰度分析、α多样性分析和β多样性分析等。
1.4 变形假单胞菌的生长抑制试验
使用营养肉汤培养基(每升含有蛋白胨10 g、牛肉粉3 g、氯化钠5 g,按照说明书配制后调节至pH至7.2)对变形假单胞菌进行培养,试验组培养基中添加0.5%(m/v)的褐藻寡糖,空白对照组培养基中无添加,变形假单胞菌的接种量为0.7×107CFU/mL,有氧、25 ℃、100 r/min条件下培养。培养至15、20和24 h时采样并使用600 nm波长光进行吸光度测定。
1.5 统计分析
数据以“平均值±标准误”表示,用SPSS 23.0软件进行方差分析和t检验,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 大黄鱼的存活和生长
经过8周的饲喂,A组和D组存活率显著高于E组(P<0.05),A组与D组存活率无统计学差异(P>0.05);A组和D组平均增重显著高于E组(P<0.05),D组终末体重显著高于E组(P<0.05),A组与D组无显著差异(P>0.05),见图1。
a:海藻酶解物对大黄鱼存活的影响;b:海藻酶解物对大黄鱼生长的影响。数据柱或数据点显示为“平均值±标准误”(n=3)。数据柱标注不同小写字母表示差异显著(P<0.05),数据点标注不同大写字母表示差异显著(P<0.05)。
2.2 肠道菌群结构特征
2.2.1 肠道菌群分组差异性分析
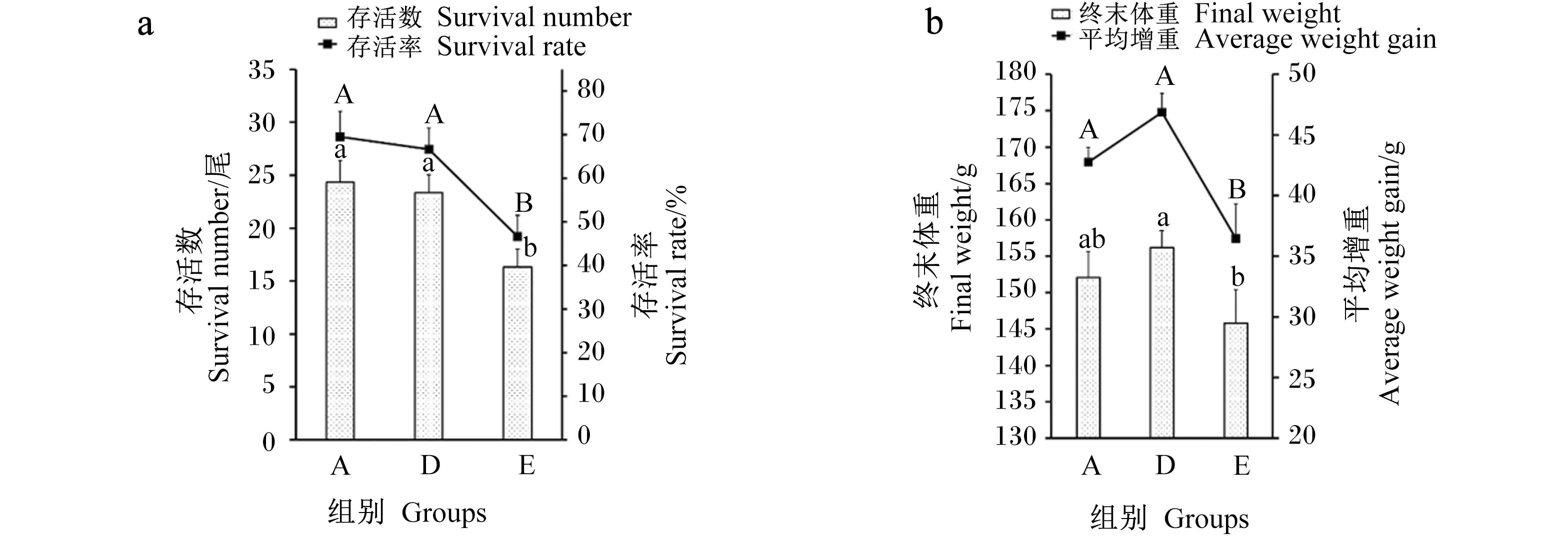
肠道菌群的改变可能是海藻酶解物提高大黄鱼存活和生长的主要原因。使用16S rDNA扩增子测序技术对肠道菌群结构进行研究。首先基于Weighted Unifrac距离进行主坐标分析(principal co-ordinates analysis,PCoA)来反映不同分组的β多样性。PCoA图(图2)显示,A组、D组和E组大黄鱼肠道菌群差异显著[置换多元方差分析(PerMANOVA),P=0.015],表明各组可形成各自特征的菌群。
图中的每个点表示1个样本,同一个组的样本使用同一种颜色表示,颜色区域代表置信区间。
2.2.2 肠道菌群特征和变化
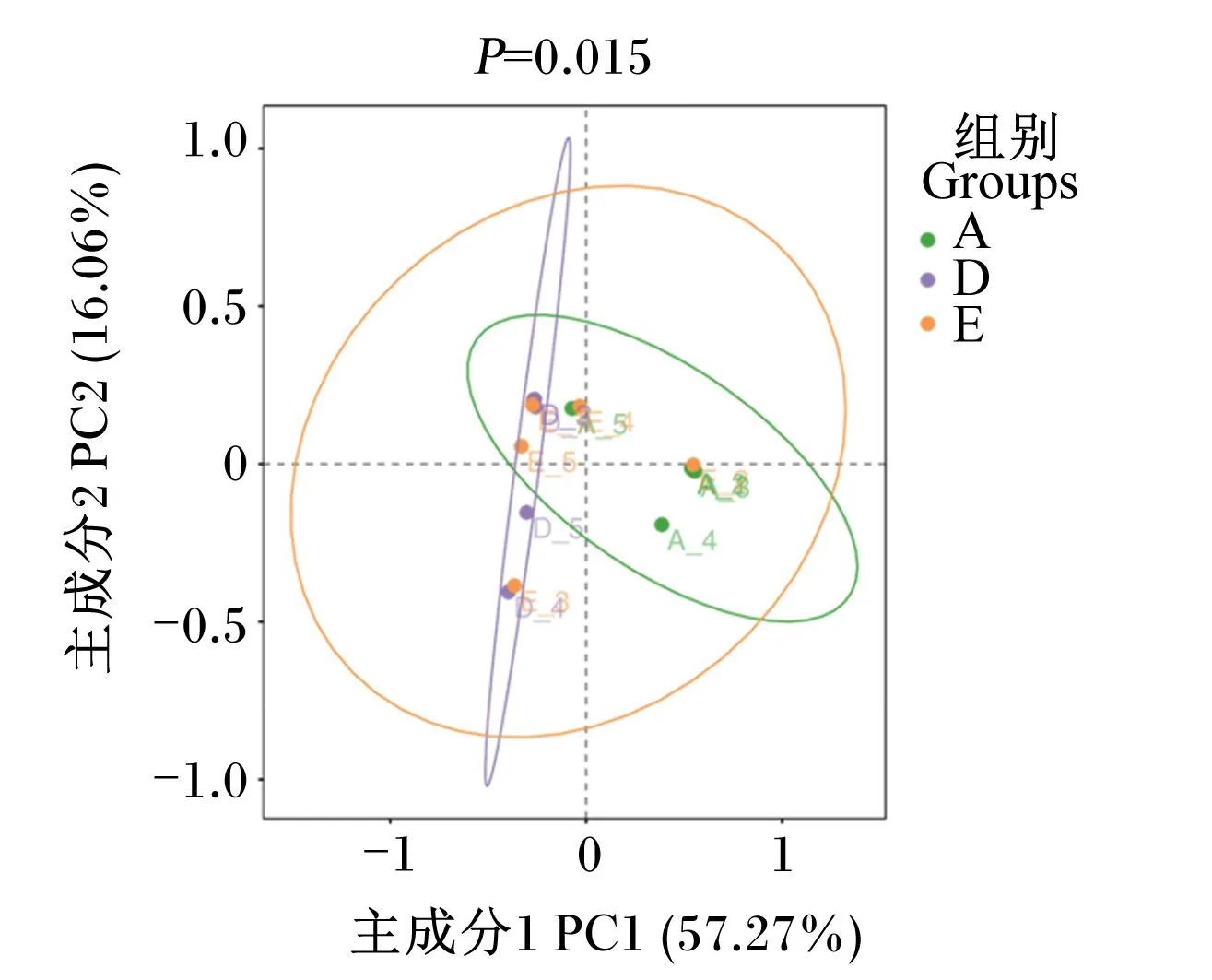
对肠道菌群的组成和结构分析发现,A组大黄鱼肠道菌群中ASVs种类最多,达到1 353种,其次是E组(749种),D组最少(242种)。3组间共有ASVs较少,且各个组的样本间也存在明显的个体差异,各个样本共有的ASVs仅7个(图3-a、图3-b)。各组大黄鱼肠道菌群结构存在差异,A组中厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门、梭杆菌门(Fusobacteriota)和放线菌门(Actinobacteriota)的相对丰度占98%以上;D组中厚壁菌门和脱硫杆菌门(Desulfobacterota)的相对丰度占90%以上,变形菌门的相对丰度较低;E组中不同样本的差异较大,但以厚壁菌门、脱硫杆菌门和变形菌门为主,部分样本中拟杆菌门、梭杆菌门和放线菌门的相对丰度较高,见图3-c。对草鱼的研究显示,草鱼肠道菌群可分为2个功能组:功能组1(G1)由变形菌门组成,功能组2(G2)由梭杆菌门、厚壁菌门和拟杆菌门组成,功能组2/功能组1(G2/G1)比值可以作为有效反映草鱼微生物群结构和功能特征的生物标志物(biomarker)[18]。3个组中G2(厚壁菌门、拟杆菌门和梭杆菌门)与G1(变形菌门)比值差异不显著(P>0.05),中位数值均约为2.5,A组和D组中多数样本高于E组,A组与D组相当,见图3-d。
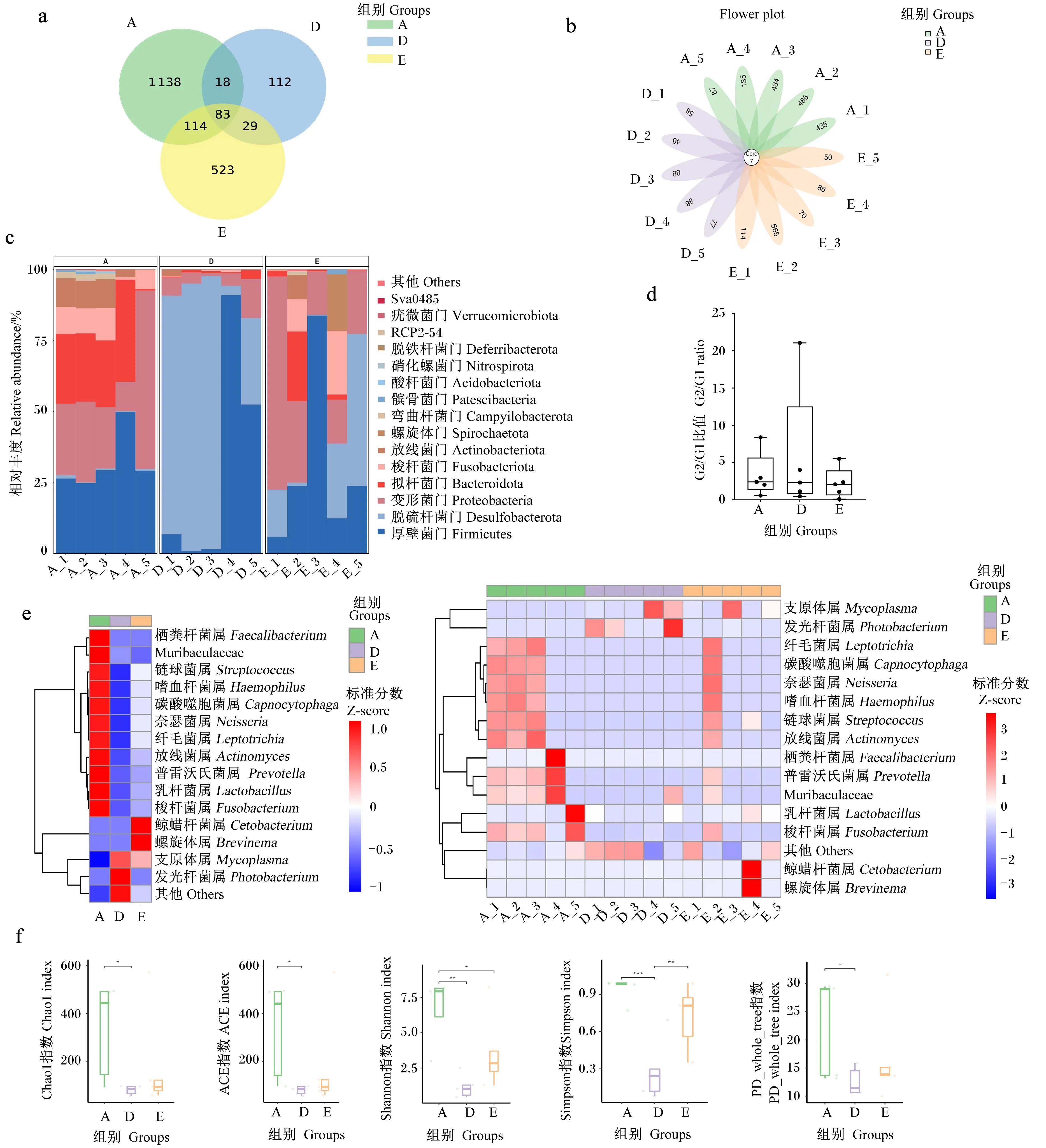
a、b:基于ASVs的韦恩图;c:肠道菌群优势菌门相对丰度分析;d:G2/G1比值分析,其中G1(功能组1)为变形菌门相对丰度,G2(功能组2)为梭杆菌门、厚壁菌门和拟杆菌门相对丰度之和;e:各组和各样本肠道菌群属水平物种丰度热图;f:α多样性分析。图中*表示P<0.05,**表示P<0.01,***表示P<0.001。
对相对丰度排名前15的菌属进行聚类分析,绘制热图(图3-e),发现在属水平上3组物种相对丰度差异较大,结合各个样本的菌群丰度差异,A组中普雷沃氏菌属(Prevotella)、Muribaculaceae、放线菌属(Actinomyces)、链球菌属(Streptococcus)、梭杆菌属(Fusobacterium)、嗜血杆菌属(Haemophilus)、碳酸噬胞菌属(Capnocytophaga)、奈瑟菌属(Neisseria)、纤毛菌属(Leptotrichia)和乳杆菌属(Lactobacillus)相对丰度较高,这些菌属在D组中相对丰度最低,D组中其他属细菌、发光杆菌属(Photobacterium)和支原体属(Mycoplasma)相对丰度较高,E组中各个样本物种相对丰度差异较大。
肠道菌群的α多样性指数可以直观反映组内物种多样性,图3-f显示3个组的Chao1指数、ACE指数、Shannon指数、Simpson指数和PD_whole_tree指数均存在差异,各指数的中位数值均表现A组>E组>D组。
2.2.3 差异菌群分析
为了进一步分析各组肠道菌群组成的差异,进行LEfSe分析寻找各组中的生物标志物。由图4的线性判别分析(LDA)值分布柱状图可知,A组大黄鱼肠道菌群中发现35个生物标志物,LDA值大于4的有16个,包括普雷沃氏菌属、栖粪杆菌属(Faecalibacterium)、梭杆菌属、瘤胃球菌属扭链群(Ruminococcus_torques_group)和P5D1-392(属);D组大黄鱼肠道菌群中发现8个生物标志物,LDA值均大于4,包括支原体属和发光杆菌属;E组大黄鱼肠道菌群中发现4个生物标志物,LDA值大于4的仅有变形菌门。由进化分支图(图4)可见,A组生物标志物不仅多且存在于多个距离较远的遗传进化分支上。
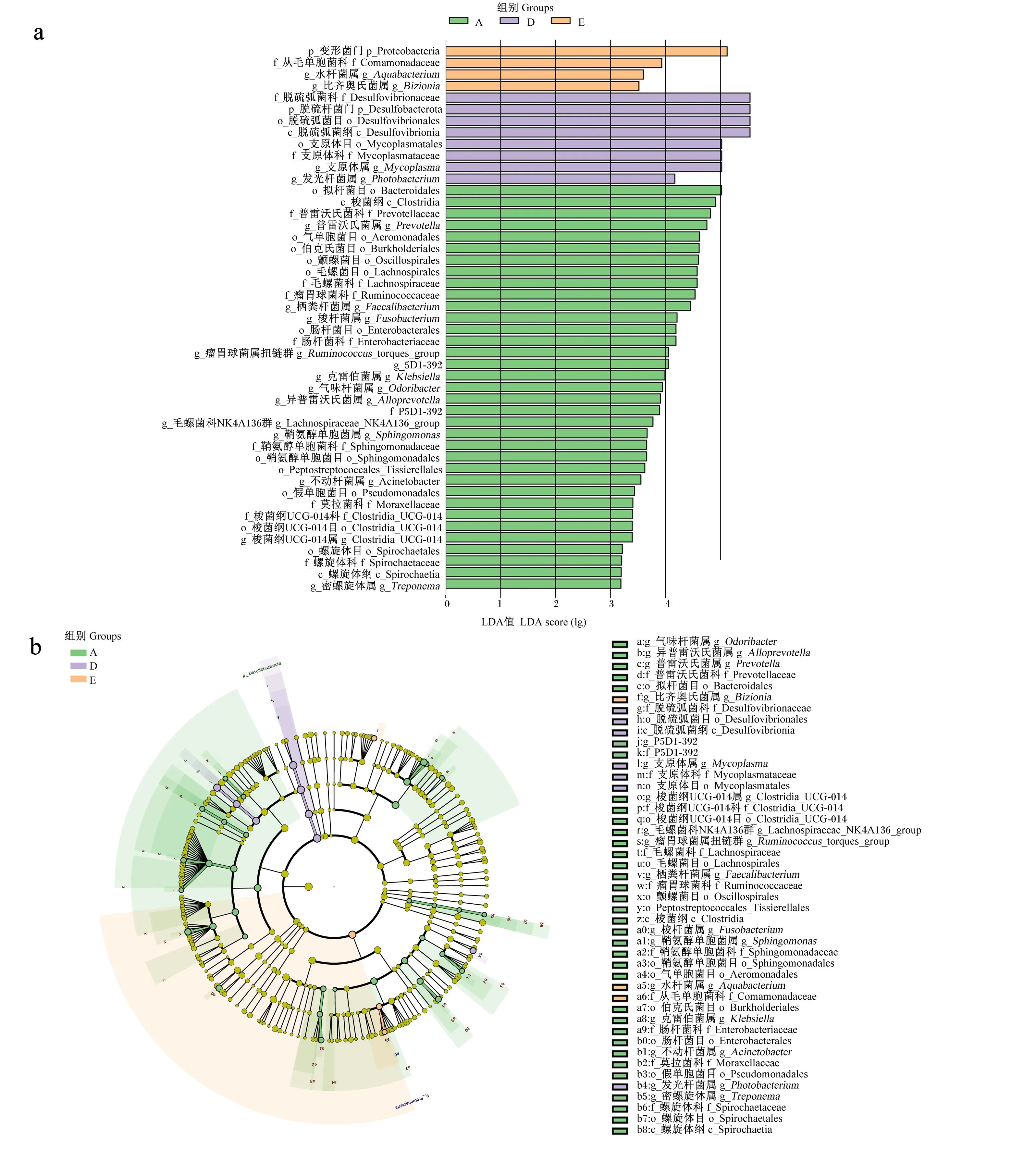
LDA值分布柱状图(图a)主要展示了LDA值大于预设值(less strict设为2;more strict设为4)的物种,即具有统计学差异的生物标志物;柱状图的颜色代表各自的组别,长短代表的是LDA值,即不同组间差异显著物种的影响程度。在进化分支图(图b)中,由内至外辐射的圆圈代表了由界(单个圆圈)至属(或种)的分类级别,不同分类级别上的每一个小圆圈代表该水平下的一个分类,小圆圈直径大小与物种相对丰度大小成正比;无显著差异的物种统一着色为黄色,差异显著的物种跟随组别进行着色,不同颜色表示在各自组别中起到重要作用的微生物类群。生物标志物对应的物种名展示在右侧,字母编号与图中对应。
组间排名前10的差异菌属(生物标志物)的相对丰度箱体图(图5-a)和样本间排名前15的差异菌属(生物标志物)相对丰度热图(图5-b)显示,A组中各样本普遍存在相对丰度较高的普雷沃氏菌属、梭杆菌属、克雷伯菌属(Klebsiella)、异普雷沃氏菌属(Alloprevotella)和毛螺菌科NK4A136群(Lachnospiraceae_NK4A136_group),发光杆菌属和支原体属相对丰度较低;与E组相比,D组中发光杆菌属较丰富,鞘氨醇单胞菌属(Sphingomonas)相对丰度稍低,其他菌属相对丰度与E组相当;仅E组各样本中普遍存在相对丰度较高的比齐奥氏菌属(Bizionia)、水杆菌属(Aquabacterium)和支原体属。
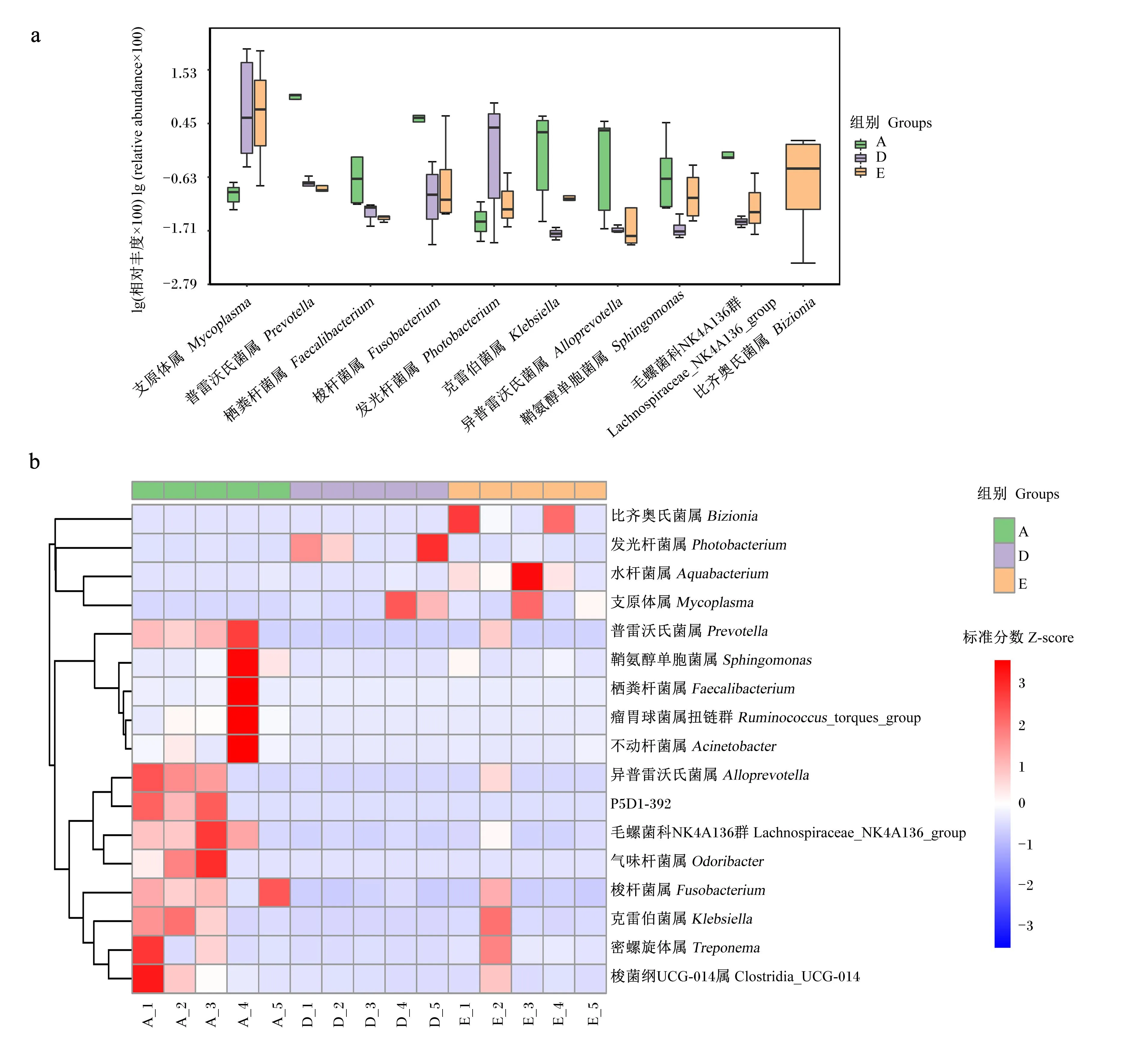
a:组间排名前10的差异菌属(生物标志物)的相对丰度箱体图;b:样本间排名前15的差异菌属(生物标志物)相对丰度热图。
2.3 特定菌群分析
2.3.1 丁酸合成相关细菌
斑马鱼上的研究发现丁酸可减少中性粒细胞和M1型促炎巨噬细胞向伤口的募集而产生抗炎作用,且这种抗炎作用在鱼类中具有普遍性[19]。我们前期的体外研究发现,拟杆菌门的产酸拟杆菌(Bacteroidesacidifaciens)、单形拟杆菌(Bacteroidesuniformis)、普通拟杆菌(Bacteroidesvulgatus)、肠鼠杆菌(Muribaculumintestinale)和金氏类拟杆菌(Parabacteroidesgoldsteinii)与丁酸的合成呈正相关[17]。此外,拟杆菌属的多种细菌在代谢碳水化合物产生SCFAs上有重要作用[20]。对3组大黄鱼肠道菌群中拟杆菌属细菌和与丁酸合成呈正相关细菌的相对丰度进行比较发现,A组样本的中位数值均大于D组和E组,D组和E组处于相同水平,见图6。
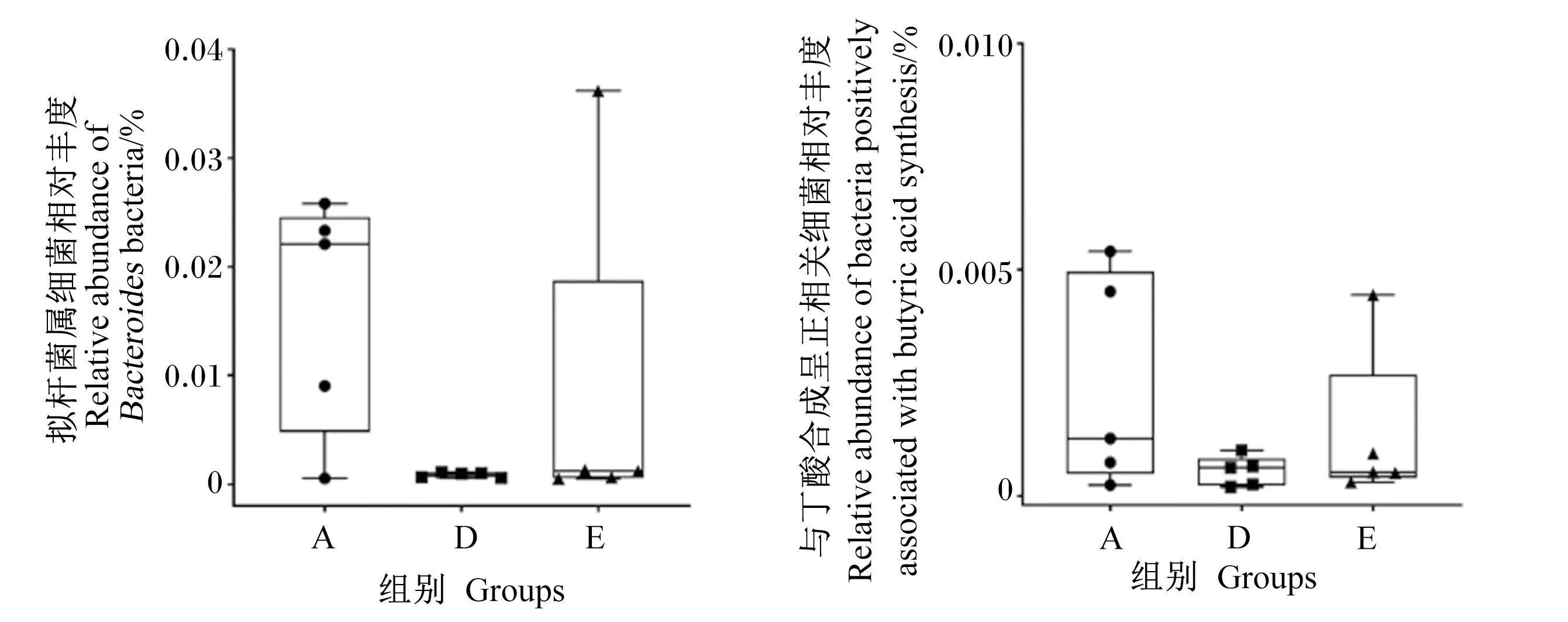
图6 海藻酶解物对大黄鱼肠道菌群中拟杆菌属细菌和与丁酸合成呈正相关细菌相对丰度的影响
2.3.2 假单胞菌属细菌
内脏白点病是大黄鱼养殖中的主要病害之一,假单胞菌属的变形假单胞菌是大黄鱼内脏白点病的主要致病原[21]。变形假单胞菌广泛存在于土壤、淡水和海水环境中,在大黄鱼肠道中较为常见,该菌在肠道中的大量繁殖可能是导致内脏白点病的关键。我们在海藻酶解物对体外培养的大黄鱼肠道菌群的研究中发现海带酶解物可降低假单胞菌属的相对丰度[17]。本次饲喂试验发现,饲料中添加0.5%海带酶解物的D组样本中假单胞菌属细菌相对丰度和绝对丰度的中位数值小于处于相同水平A组和E组,且D组中样本假单胞菌属细菌相对丰度均较低,A组和E组中少量样本的相对丰度较高,见图7。
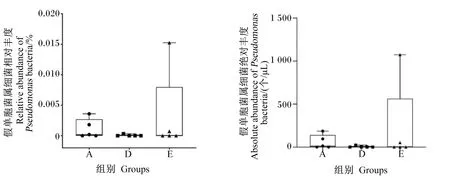
图7 海藻酶解物对大黄鱼肠道菌群中假单胞菌属细菌丰度的影响
为进一步确认海带酶解物对假单胞菌属细菌生长的抑制作用,使用由海带降解获得并纯化的褐藻寡糖进行大黄鱼内脏白点病病例中分离的致病变形假单胞菌的生长抑制试验,结果显示培养基中添加0.5%褐藻寡糖可以显著或极显著地抑制变形假单胞菌的生长(P<0.05或P<0.01),见图8。
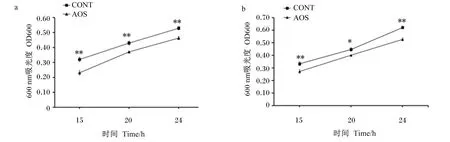
a:变形假单胞菌Pp-01;b:变形假单胞菌Pp-02。CONT:空白对照组;AOS:添加0.5%褐藻寡糖的试验组。数据点显示为“平均值±标准误”(n=4)。CONT数据点标注“*”表示与AOS相比差异显著(P<0.05),标注“**”表示与AOS相比差异极显著(P<0.01)。培养条件:营养肉汤培养基,接种量0.7×107 CFU/mL,有氧、25 ℃、100 r/min条件下培养。
2.4 肠道菌群功能差异
使用PICRUSt2(2.3.0b0)基于16S序列来预测已知微生物基因功能的构成,从而统计不同样本和组别之间在功能上的差异。基于KEGG进行第3层次水平(level3)上的功能预测表明A组、D组和E组肠道菌群在淀粉和蔗糖代谢(starch and sucrose metabolism)、谷胱甘肽代谢(glutathione metabolism)、磷酸转移酶系统(phosphotransferase system)、氰基氨基酸代谢(cyanoamino acid metabolism)、亨廷顿病(Huntington’s disease)和其他糖降解(other glycan degradation)上有显著差异(P<0.05,图9-a),这种差异在各组中的样本上存在个体差异(图9-b)。经比较发现,A组肠道菌群对糖的代谢增强(淀粉和蔗糖代谢、磷酸转移酶系统、其他糖降解),同时胰岛素抵抗增强;D组肠道菌群对糖的代谢较弱,胰岛素抵抗功能也较弱;E组不同样本的肠道菌群对糖的代谢能力差异较大,但对糖的代谢增强也会伴随胰岛素抵抗增强。D组肠道菌群在谷胱甘肽代谢和氰基氨基酸代谢上弱于A组和E组;同时,相比E组,A组和D组肠道菌群对硝基甲苯、氯环己烷和氯苯、苯乙烯等有害物质的降解能力可能会降低。
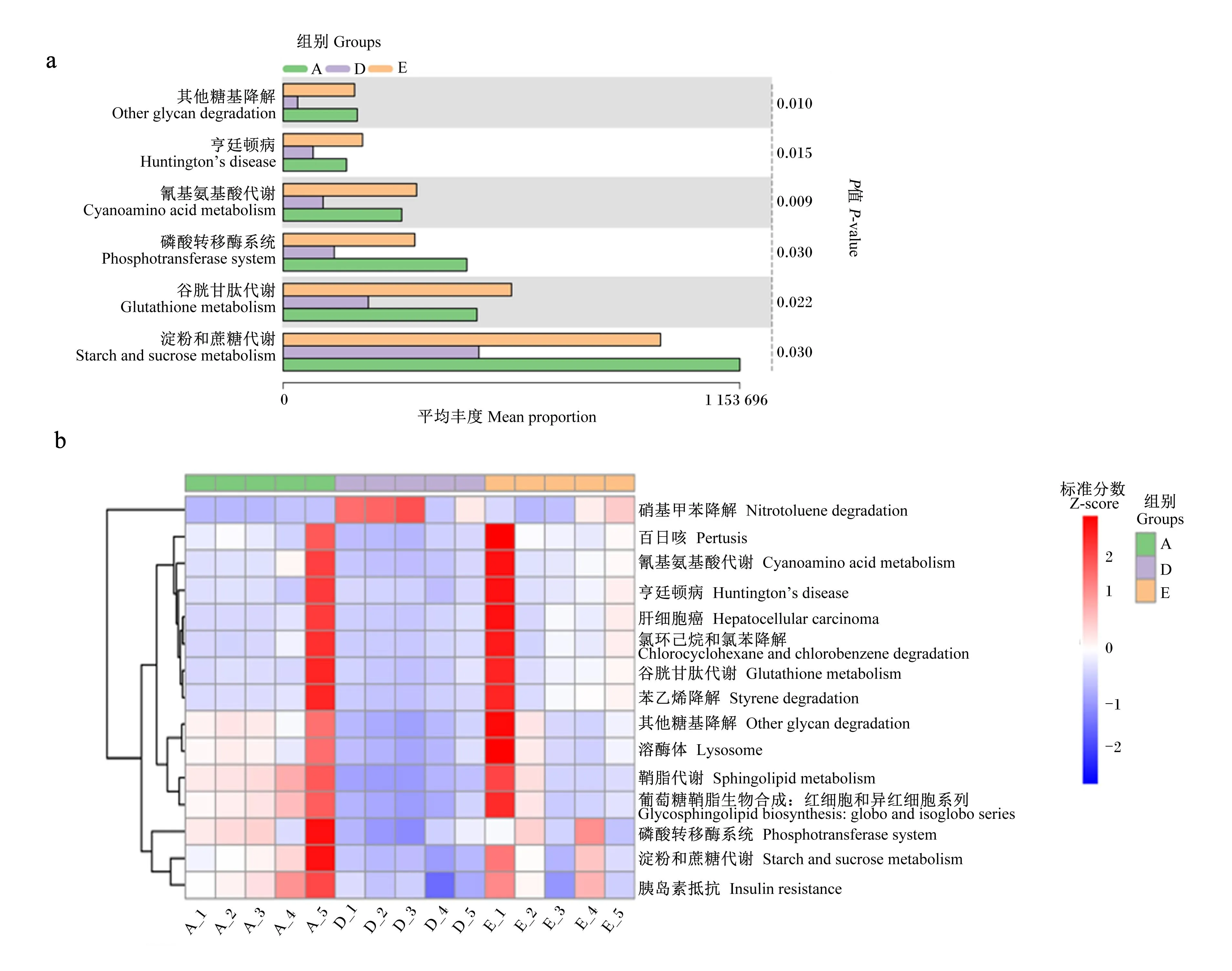
a:Kruskal-Wallis统计组间差异显著的KEGG预测结果;b:样本间丰度有显著差异的前15个KEGG预测结果的热图。
3 讨 论
本研究结果显示饲料中添加0.5%复合海藻酶解物或0.5%海带酶解物均可以显著提高大黄鱼的存活并促进生长,但两者调节形成的肠道菌群不同,基于16S序列的KEGG功能预测显示两者肠道菌群功能差异显著。
大黄鱼饲喂试验开展于2022年11—12月,期间试验所在海域水温由23 ℃逐渐降至18 ℃,水体中溶解氧(DO)含量在6.1~7.9 mg/L,该条件下大黄鱼采食量逐渐下降,内脏白点病等肠道细菌性疾病进入流行期,饲喂结束后发现对照组大黄鱼的存活率仅为46.7%,0.5%复合海藻酶解物组和0.5%海带酶解物组大黄鱼的存活率提高了20%。肠道菌群与动物的健康密切相关[22-23],其中关键的连接纽带可能是肠道菌群合成的SCFAs,尤其是丁酸[9,19]。草鱼肠道菌群可分为2个功能组:功能组1(G1)由变形菌门组成,该功能组细菌携带更多的毒力因子基因(VF)和抗生素抗性基因(ARG);功能组2(G2)由梭杆菌门、厚壁菌门和拟杆菌门组成,该功能组细菌富集了编码降解阿拉伯木聚糖、果胶、黏蛋白、菊粉和纤维素的酶基因,可促进SCFAs的产生,较高的G2/G1比值反映肠道菌群较为健康[18]。
本研究中,0.5%复合海藻酶解物组和0.5%海带酶解物组G2/G1比值的中位数相当,高于对照组,且多数样本的该比值高于对照组。我们前期的体外研究表明,添加0.5%复合海藻酶解物可显著增加丁酸的合成量,其中拟杆菌门中以产酸拟杆菌、单形拟杆菌、普通拟杆菌和肠鼠杆菌等细菌与丁酸合成呈正相关,而添加0.5%的海带酶解物未显示出这种效果[17]。0.5%复合海藻酶解物组拟杆菌属细菌和与丁酸合成正相关细菌的相对丰度高于处于相似水平的0.5%海带酶解物组和对照组,表明饲喂添加0.5%复合海藻酶解物的饲料可以促进大黄鱼肠道菌群合成丁酸,这和我们前期对大黄鱼肠道菌群体外培养所得结果一致。普雷沃氏菌属[24]、Muribaculaceae[25]、放线菌属[26]、梭杆菌属[27]、纤毛菌属[28]和乳杆菌属[29]均是具有益生功能的细菌,0.5%复合海藻酶解物还显著提高了大黄鱼肠道中这些具有益生功能的细菌的相对丰度和肠道菌群的α多样性,这可能是其能显著提高大黄鱼存活率的原因。
大黄鱼肠道菌群体外培养时添加0.5%海带酶解物未增加丁酸的合成量[17],本研究中饲喂0.5%海带酶解物也未提高大黄鱼肠道中与丁酸合成相关细菌的相对丰度和普雷沃氏菌属、Muribaculaceae等具有益生功能的细菌的相对丰度,并降低了肠道菌群的α多样性,但也显著提高了大黄鱼的存活率,表明饲喂0.5%海带酶解物提高大黄鱼存活率的机制与饲喂0.5%复合海藻酶解物是不同的。每年11月至次年的5月是中国福建宁德市周边海域大黄鱼内脏白点病逐渐进入高发的时期[30]。内脏白点病是大黄鱼养殖中的主要病害之一,发病后死亡率高达70%~80%,病原是变形假单胞菌属的变形假单胞菌[21,31]。变形假单胞菌广泛存在于土壤和海水环境中,在大黄鱼肠道中较为常见,该菌为专性需氧菌,正常状态下肠道内厌氧环境抑制其生长。春冬季时,海水溶氧量升高,可能促进了变形假单胞菌的生长[30],该菌达到一定丰度可引起肠道菌群紊乱,进而破坏肠道的免疫屏障,导致变形假单胞菌入侵宿主引发菌血症,在脾脏、肾脏和肝脏等器官形成感染性肉芽肿导致宿主死亡[32]。在大黄鱼肠道菌群体外培养时添加0.5%海带酶解物可以降低假单胞属的相对丰度[17],饲喂试验中也发现0.5%海带酶解物组假单胞菌属细菌的相对丰度和绝对丰度小于处于相同水平的0.5%复合海藻酶解物组和对照组,且其各个样本的假单胞菌属细菌丰度均较低。变形假单胞菌的生长抑制试验也进一步证实0.5%褐藻寡糖可以极显著地抑制该菌的生长,饲喂0.5%海带酶解物可能通过减少大黄鱼内脏白点病的发生而提高其存活率。
同时,研究发现饲喂0.5%复合海藻酶解物或0.5%海带酶解物可以显著促进大黄鱼增重。海藻作为饲料原料或海藻提取物作为添加剂可以促进生长已在多种鱼上得到证实。郭斌等[3]证实江蓠、浒苔和藻渣(褐藻藻渣)作为饲料原料可以促进大菱鲆幼鱼的生长,林建斌等[33]报道饲料中添加0.6%的海带多糖可以提高珍珠龙胆石斑鱼的生长,杨晴等[34]报道饲料中添加有效浓度为0.1%的褐藻糖胶可以提高黄颡鱼的增重率和特定生长率。本研究中饲喂含0.5%复合海藻酶解物或0.5%海带酶解物的饲料均显著促进了大黄鱼的生长,与现有的研究结果一致。研究已经证明肠道菌群与生长密切相关[35-36]。大黄鱼饲喂含0.5%复合海藻酶解物的饲料8周后,肠道菌群主要由厚壁菌门、变形菌门、拟杆菌门、梭杆菌门和放线菌门组成,而饲喂0.5%海带酶解物饲料的大黄鱼肠道菌群主要由厚壁菌门、脱硫杆菌门和低丰度的变形菌门组成,这与对照组以厚壁菌门、脱硫杆菌门和变形菌门为主,部分样本中拟杆菌门、梭杆菌门和放线菌门相对丰度较高存在较大差异。细菌属水平上,0.5%复合海藻酶解物组肠道菌群中存在丰富的普雷沃氏菌属、Muribaculaceae和乳杆菌属等益生菌,但这些细菌在0.5%海带酶解物组和对照组中的相对丰度均较低,且相较于对照组,0.5%海带酶解物组中多数样本的其他属细菌和发光杆菌属相对丰度较高,这些表明相对于对照组鱼群肠道菌群表现出的个体多样性,0.5%海带酶解物调整了鱼群的肠道菌群结构,使整个鱼群的肠道菌群结构趋于一致。同时,基于16S的KEGG功能预测显示0.5%复合海藻酶解物调节形成的肠道菌群对糖的代谢和胰岛素抵抗增强,而0.5%海带酶解物调节形成的肠道菌群对糖的代谢和胰岛素抵抗最弱,在谷胱甘肽和氰基氨基酸代谢上也最弱,这些都和对照组肠道菌群的预测功能不同。大黄鱼是肉食性鱼类,对糖的耐受能力较差,较低的血糖浓度即抑制其生长[37]。0.5%复合海藻酶解物调节形成的肠道菌群加强了对各种糖的代谢,SCFAs等糖代谢产物可能促进了大黄鱼生长;0.5%海带酶解物的作用则相反,可能降低了机体对糖及代谢物的摄入,并降低了对谷胱甘肽和氰基氨基酸代谢,进而促进了大黄鱼的生长。此外,0.5%海带酶解物组中观察到的ASVs最少(242种),其中112种与对照组共有,α多样性分析也显示0.5%复合海藻酶解物组肠道菌群最为多样,0.5%海带酶解物组略低于对照组。这些结果表明,虽然复合海藻酶解物和海带酶解物有47%的共同组分是海带,但两者引导发育的肠道菌群差异较大,本研究尚不能明确促进大黄鱼生长的肠道菌群组成或者具体细菌及其丰度,但可表明肠道菌群的α多样性与促生长作用并非正相关。
本研究中发现大黄鱼采食含0.5%复合海藻酶解物和0.5%海带酶解物饲料后肠道菌群组成和菌群功能差异明显。本试验中的复合海藻酶解物由29%的条斑紫菜、24%的石莼和47%海带组成的复合海藻酶解制成,而海带酶解物则全部为海带酶解制成。0.5%复合海藻酶解物组大黄鱼肠道菌群的α多样性显著高于0.5%海带酶解物组,0.5%海带酶解物组和对照组差异不显著,这和我们前期对大黄鱼肠道菌群体外培养时添加0.5%复合海藻酶解物和0.5%海带酶解物后所得结果一致。同时,研究显示,在大黄鱼幼鱼的饲料中添加1.00%或2.00%的褐藻糖胶(fucoidan)可以改变肠道菌群的整体结构,增加拟杆菌门的相对丰度,降低机会性病原体和兼性厌氧菌的相对丰度,促进大黄鱼幼鱼的生长[4]。这些结果表明支链化、硫酸化的海藻多糖可以增加大黄鱼肠道菌群α多样性,但可能作用剂量与支链化、硫酸化程度相关,使用较低剂量的支链化、硫酸化程度较高的海藻多糖即可增加大黄鱼肠道菌群的α多样性,促进合成丁酸的拟杆菌属细菌的增殖。
4 结 论
本研究结果显示,饲喂含0.5%复合海藻酶解物或0.5%海带酶解物的饲料均可以促进大黄鱼的健康生长,两者调节大黄鱼形成的肠道菌群结构不同,表明作用机制存在差异,0.5%复合海藻酶解物提高了大黄鱼肠道菌群α多样性和合成丁酸的拟杆菌属细菌的相对丰度,0.5%海带酶解物降低了大黄鱼肠道菌群α多样性并抑制了假单胞菌属细菌的生长,海藻硫化多糖和褐藻寡糖是形成这种差异的关键。
