骨骼肌源外泌体在肌肉和脂肪组织发育中的研究进展
2024-04-02李奇隆陈思思郭秋平李凤娜
李奇隆 陈思思 郭秋平 李凤娜*
(1.中国科学院亚热带农业生态研究所亚热带农业生态过程重点实验室,动物营养生理与代谢过程湖南省重点实验室,长沙 410125;2.中国科学院大学现代农业科学学院,北京 100049)
骨骼肌是由近轴中胚层一侧的肌原细胞发育而来,成肌祖细胞经过终末分化形成单核成肌细胞,然后融合成肌管,最终生成具有生物功能的肌肉组织[1]。骨骼肌约占人体的40%,负责全身能量稳态并作为身体蛋白质池,是一个高度动态和可塑性的器官,可响应运动和代谢需求。外泌体是具有脂质双层膜结构且直径为30~150 nm细胞外囊泡的一种亚群,能被骨骼肌细胞分泌。近几年的研究发现,骨骼肌源外泌体中含有细胞特异性的核酸、蛋白质、脂质和其他代谢产物,能作为信号分子传递给骨骼肌细胞或脂肪细胞,从而调控这些细胞的相关功能,在肌肉和脂肪组织发育过程中扮演着重要角色[2-3]。本文首先概述了外泌体的生成和组成,之后分别阐述了骨骼肌源外泌体在肌肉和脂肪组织发育过程中的调节机制,最后列举了工程化外泌体在骨骼肌中的具体应用。
1 外泌体概述
1.1 外泌体的生成
在生物体正常生理及病理状态下,各组织器官都能合成并分泌细胞外囊泡,根据它们的生物发生模式、组成和大小,细胞外囊泡的3个主要亚群被识别出来:外泌体、微粒和凋亡小体[4]。外泌体是在1983年研究网织红细胞成熟为红细胞过程中产生转铁蛋白时被发现的[5],是一种直径大小范围在30~150 nm(平均100 nm)的具有内体来源的细胞外囊泡[6]。外泌体的产生涉及一个独特的细胞内调节过程,这决定它们的组成,并且一旦分泌到细胞外空间,可决定它们的功能[7-8]。质膜先是第一次内陷,后依次形成含有腔内囊泡的早期分选核内体、晚期分选核内体,最终形成细胞内多囊泡体(multivesicular bodies,MVBs),当MVBs与质膜融合时,释放外泌体[9-11](图1)。
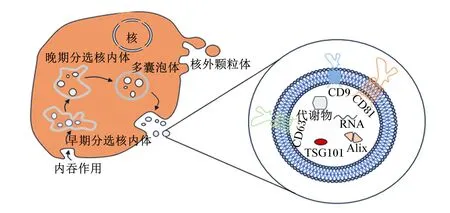
TSG101:肿瘤易感基因101 tumor susceptibility gene 101;Alix:凋亡连接因子2-相互作用蛋白X apoptotic linking factor 2-interactingprotein X。
1.2 骨骼肌源外泌体的组成
骨骼肌源外泌体富含核酸、蛋白质和脂质,参与全身代谢。已有研究报道,来自不同细胞类型的外泌体样囊泡(exosome-like vehicles,ELVs)制剂已证明它们含有不同的RNA群体,这其中包括转录本[12-13]和非编码RNA[14]。在骨骼肌细胞中,C2C12细胞源ELVs也富集miRNA亚群[15]。通过对成肌细胞ELVs中最集中的miRNA进行生物信息学预测,表明其可共同调节肌肉生理学的重要细胞通路,即参与肌肉质量调节的信号通路、神经肌肉接头、免疫反应、钙信号和细胞骨架的信号通路[15]。同时利用DNA微阵列技术,在人类骨骼肌细胞释放的ELVs也检测到了mRNA,185个转录本被鉴定,并且ELVs显著富集编码受体和离子通道的转录本,以及转录调节因子,特别是锌指转录因子[16]。此外,蛋白质组学分析已经确定了从人体肌管的条件培养基中释放的ELVs特定蛋白质亚群,在“膜泡运输”、“细胞黏附与迁移”、“自由基清除”和“细胞间信号转导与相互作用”的蛋白中富集[17];同时比较蛋白质组学分析也表明,肌管ELVs蛋白主要是那些被内吞并进入内体以嵌入MVBs或降解进入溶酶体的蛋白[18-19]。
细胞内脂肪酸的积累会使葡萄糖代谢受到抑制,产生胰岛素抵抗,ELVs的释放则可能是保护细胞的形式之一,以防止细胞内脂肪酸的积累[20]。脂质也是ELVs膜的重要组成部分,特定脂质在ELVs中富集[21]且这种特异性脂质富集、膜高蛋白质脂肪比和不对称分布与较高的膜硬度有关[22];与其他脂肪酸相比,肌管ELVs富集棕榈酸、硬脂酸、油酸、棕榈油酸和月桂酸,这些脂肪酸被用于产生能量或用于组成细胞膜的磷脂双分子层[21,23]。
2 骨骼肌源外泌体在肌肉发育中的作用
多项研究表明,骨骼肌源外泌体在维持肌肉稳态和与其他组织交流方面具有旁分泌和内分泌双重作用[24-25],成肌细胞和肌管这2种肌细胞类型是表达四跨膜蛋白家族、肿瘤易感基因101(TSG101)和凋亡连接因子2-相互作用蛋白X(Alix)等蛋白标记物以及参与信号转导的其他蛋白[20,26-27]的外泌体来源,其释放的外泌体可将其蛋白、mRNA和miRNA转运到受体细胞,从而调节靶细胞功能[28-29],扮演着细胞与细胞之间相互交流的角色,介导组织间通讯[30]。骨骼肌源性外泌体在成肌细胞的增殖、分化和肌肉损伤修复中发挥着重要作用(图2)。

ELVs-MT:肌管源外泌体样囊泡 exosome-like vehicles derived from myotubes;TNF:肿瘤坏死因子 tumor necrosis factor;DIO:膳食诱导肥胖 diet-induced obese;MyoG:肌细胞生成素 myogenin;MyoD1:成肌分化因子1 myogenic differentiation 1;Cyclin D1:细胞周期蛋白D1;Akt:蛋白激酶B protein kinase B;Sirt1:沉默信息调节因子2同源蛋白1 silent mating type information regulation 2 homolog 1;MHC:肌球蛋白重链 myosin heavy chain;PCNA:增殖细胞核抗原 proliferating cell nuclear antigen;CKMT2:线粒体肌酸激酶2 creatine kinase, mitochondrial 2。
2.1 成肌细胞增殖
生物信息学分析发现,成肌细胞源外泌体样囊泡(exosome-like vehicles derived from myoblast,ELVs-MB)和肌管源外泌体样囊泡(exosome-like vehicles derived from myotubes,ELVs-MT)差异表达miRNA的预测靶基因参与肌肉生长发育过程[26],尤其可能参与在成肌过程中被调控的经典Wnt信号通路[34]。成肌细胞产生的ELVs可能反映了细胞增殖过程中发生的蛋白质、核酸或脂质周转[27,35]。研究报道,用棕榈酸酯培养后的C2C12细胞源外泌体能够降低成肌细胞中基因肌细胞生成素(MyoG)和成肌分化因子1(MyoD1)的表达,提高细胞周期蛋白(cyclin)D1和蛋白激酶B(Akt)蛋白的表达水平,促进成肌细胞增殖[23];在轻微氧化应激状态下,肌管细胞源外泌体可以下调成肌细胞基因MyoG和肌球蛋白重链(MHC)的表达,上调增殖细胞核抗原(PCNA)的表达,表明该状态下可以促进成肌细胞增殖[32];此外,骨骼肌组织条件培养基得到的外泌体(含有ELVs-MT和ELV-MB)还可以通过调控骨骼肌干细胞微环境,显著上调肌卫星细胞cyclinD1基因表达,下调成肌分化因子(MyoD)、MyoG基因表达而促进肌卫星细胞的增殖[36],但用C2C12细胞源,只含有ELVs-MT处理成肌细胞时,则得到了与上述相反的结果[26]。上述研究揭示了骨骼肌源外泌体在成肌细胞增殖过程中所发挥的作用并不一致,而产生上述差异的原因可能与成肌细胞分泌的外泌体是由不同的诱导环境所产生,从而导致异质性。
2.2 肌管的形成
已有研究报道,ELVs-MT的miRNA可靶向成肌细胞增殖相关基因沉默信息调节因子2同源蛋白1(Sirt1)的3′-非翻译区(UTR),通过这一途径降低成肌细胞中内源性Sirt1的表达水平,从而诱导细胞分化[31];ELVs-MT还会诱导成肌细胞表达分化早期标志蛋白如MyoG[26]。与此相反的是,膳食诱导肥胖(diet-induced obese,DIO)小鼠ELVs-MT中含有的棕榈酸被转移到受体肌管中,肌肉分化标志蛋白如MoyG、MyoD1和线粒体肌酸激酶2(creatine kinase, mitochondrial 2,CKMT2)等均被下调[23],表明富集棕榈酸的ELVs-MT可抑制成肌细胞分化形成肌管,并最终影响肌肉组织表型;在病理状态下骨骼肌源外泌体抑制成肌细胞分化,并诱导肌肉萎缩[33]。在成肌细胞分化的过程中分泌的外泌体可内化到脂肪组织中的干细胞,诱导其与邻近细胞融合,产生表达MHC和结蛋白的肌管样细胞[37]。研究报道,许多参与从成肌细胞到肌管形成的蛋白都在外泌体中被发现,推测外泌体在成肌细胞分化形成肌管的过程中发挥着重要作用;随着成肌细胞分化形成肌管,分泌蛋白的模式也会随之发生改变,蛋白质组学分析表明,大部分外泌体蛋白来源于骨骼肌细胞质,并且在这些蛋白中,只有10%具有典型的分泌序列,43%被鉴定为缺乏N端分泌序列的非经典分泌蛋白[16,38]。上述研究进一步表明,骨骼肌源外泌体对成肌细胞分化调控功能的差异与在不同生理状态下分泌的外泌体成分有着紧密联系。
2.3 肌肉损伤修复
已有研究报道,从发炎的肌管中分离出的ELVs能够引起成肌细胞炎症,诱导肌肉萎缩[33]。除炎症模型外,肌管来源的外泌体可通过改善杜氏肌营养不良症(Duchenne muscular dystrophy,DMD)小鼠的肌肉膜完整性来实现功能改善和缓解肌肉退化[39];同时还有研究进一步报道,窖蛋白-1是一种抗纤维化信号分子[40],DMD患者肌源性成纤维细胞外泌体miR-199a-5p靶向该分子,可诱导骨骼肌纤维化[41]。在肥大刺激的情况下,骨骼肌卫星细胞被激活,在位于纤维周围的细胞外基质(extracellular matrix,ECM)中产生成肌祖细胞(myogenic progenitor cells,MPCs),MPCs分泌含有miR-206的ELVs,抑制纤维化受体细胞中胶原蛋白生物合成的主要调节因子核糖体结合蛋白1[42],进而防止过度的ECM沉积,以适应肥大刺激下的最佳肌肉重塑。上述研究表明,骨骼肌源外泌体与肌肉萎缩有关,揭示了骨骼肌源外泌体对DMD或其他膜受损的骨骼肌疾病的治疗潜力。
在肌肉萎缩的情况下,用地塞米松处理C2C12肌管48 h降低了细胞内miR-23a的水平,但增加了其在ELVs-MT的丰度[43],表明萎缩诱导条件下导致miRNA选择性装载到ELVs-MT中。研究发现,过氧化氢(H2O2)预处理肌管释放的ELVs与成肌细胞共孵育以模拟氧化应激,可导致肌管直径减小,并刺激成肌细胞增殖[32];另有研究发现,用肿瘤坏死因子(TNF)-α和TNF-γ的混合物处理肌管时也观察到类似结果[33]。根据上述研究推测,ELVs-MT可能影响成肌细胞的增殖与分化过程,从而参与损伤后骨骼肌质量维持和再生。
3 骨骼肌源外泌体在脂肪发育中的作用
骨骼肌源外泌体在体内多种组织的掺入,表明骨骼肌可通过外泌体途径将特定的信号传递到关键代谢组织[23,44]。目前的研究中,肌肉释放的外泌体对脂肪组织稳态的调节作用研究较少,且主要集中在骨骼肌源外泌体,而骨骼肌也能行使分泌功能对脂肪细胞产生调节作用[45-46]。研究发现,miR-146a-5p主要富集在骨骼肌来源的外泌体中,其通过递送miR-146a-5p显著抑制前体脂肪细胞的成脂分化[47],表明miR-146a-5p对于调节正常骨骼肌发育和脂肪生成之间的平衡至关重要;快慢骨骼肌特异性分泌的外泌体携带miR-27a-3p可抑制成纤维-成脂祖细胞(fibro-adipogenic progenitors,FAPs)成脂分化,减少甘油诱导的肌间脂肪浸润[48];miR-133a和miR-206在肌纤维来源的外泌体中高表达,可下调其靶蛋白Smarcd1和侏儒相关转录因子2(Runx2)在前体脂肪细胞中的表达水平[49],这表明骨骼肌源外泌体中含有的miRNA可以转移到前体脂肪细胞中调节基因表达。在健康情况下,骨骼肌源外泌体作为抵抗成脂信号,可抑制3T3-L1脂肪细胞中的脂质积累,并抑制FAPs分化为脂肪细胞。此外,肥大肌管来源释放的外泌体样囊泡可调节儿茶酚胺敏感性并诱导脂肪细胞释放甘油[50],表明骨骼肌源外泌体样囊泡可以局部控制脂肪组织的发育,并调节脂肪组织中代谢物的释放来实现合适的骨骼肌能量代谢。上述研究揭示了骨骼肌源外泌体尤其是富集的miRNA对脂肪细胞分化发育命运的重要调控作用。
4 工程化外泌体在骨骼肌发育中的应用
外泌体广泛参与骨骼肌的生理和病理过程,但是由于外泌体的纯度较低和产量不足,需要大量的供体才能在体内诱导足够的效应[51-52],而人工合成的外泌体具有组织特异性靶向修饰能力,其可能是体内研究的一种节省供体的优选方法。例如,miR-26a是骨骼肌分化和再生过程中所必需的[53],制备的包含肌肉特异性靶向肽的miR-26a过表达外泌体,有助于其选择性递送至肌细胞[54];还有研究将miR-215模拟物转染到大鼠骨髓间充质干细胞中,开发了过表达miR-215的外泌体,逆转了H2O2诱导的细胞活力抑制并增加了L6细胞的凋亡[55]。除了外泌体miRNA外,外泌体蛋白也有生物活性作用。据报道,含有热休克蛋白60(heat shock protein 60,Hsp60)的外泌体可诱导过氧化物酶体增殖物激活受体γ辅激活蛋白-α1(peroxisome proliferators-activated receptor γ coactivator-α1,PGC-1α)表达[56],则通过用Hsp60过表达质粒对C2C12细胞系进行基因修饰,产生了含有Hsp60的外泌体,激活了C2C12细胞系中直接参与线粒体生物合成和抑制肌肉萎缩的PGC-1α异构体1的表达[57]。此外,还有工程化外泌体作为诱导受体调节骨骼肌发育的报道,如有研究构建了表达白细胞介素-6(interleukin-6,IL-6)信号转导子的诱导受体的外泌体,该诱导受体选择性抑制C2C12成肌细胞和肌管中的IL-6反式信号通路,从而部分改善IL-6受体复合物的诱导效应[58]。总体而言,具有修饰内容物和组织特异性靶向能力的工程化外泌体在肌肉疾病的治疗中展现出较好的应用前景。
5 小结与展望
综上所述,骨骼肌源性外泌体在骨骼肌发育中的成肌细胞增殖、分化和损伤修复中的研究较为深入,而对于脂肪组织稳态的调控作用研究缺乏,骨骼肌源外泌体在脂肪组织的稳态中扮演的角色还需要进一步探究。细胞内吞、膜融合和受体介导的内化是外泌体被细胞内吸收的主要机制[59],这些可变的内化机制和外泌体中存在的信号分子是外泌体被广泛接受为微环境中细胞间通讯的重要参与者并值得研究的重要原因[60]。肌肉与脂肪组织之间相互作用的研究主要集中在脂源性外泌体在肌肉稳态中的调节功能,两者是否互作平衡值得深入探讨,并且在肌源性外泌体方面只有骨骼肌源在组织互作中受到关注,不同类型肌纤维释放的外泌体如何参与“对话”?它们在不同类型的脂肪组织中是否也以相同的方式调节脂肪细胞脂质代谢稳态?目前,体外研究已明确骨骼肌组织释放的外泌体可控制脂肪组织中脂质生成,肌肉和脂肪组织之间通过交换多种信号来控制各自的质量和代谢稳态。此外,当前对外泌体的识别和其作用机制的了解还远远不够,只有少数miRNA被鉴定出来,外泌体的脂质和蛋白质很可能在其生物学作用中发挥着重要作用。因此,系统探讨不同诱导环境或生理状态下骨骼肌源外泌体内容物的异质性及其对脂肪组织发育过程的调节机制,在肌肉与脂肪组织的互作平衡研究中显得尤为重要。
