基于物理方法的皮肤创伤动物模型构建及评价指标研究进展
2024-04-02欧雪余志杰何瑶郑晓媛
欧雪,余志杰,何瑶,郑晓媛∗
(1. 重庆大学医学院,重庆 400030;2. 重庆市第四人民医院,重庆市急救医疗中心药剂科,重庆 400014)
世界卫生组织(World Health Organization,WHO)将皮肤创伤定义为全球性公共问题,特别是需要长期治疗的慢性伤口,给医疗保健系统带来巨大的经济负担[1-2]。 随着人口老龄化加剧,以及糖尿病和肥胖的影响,慢性创面的患病率不断升高[3]。 面对该流行趋势,迫切需要研究人员对其致病机制进行深入研究,动物模型则成为研究发病机制及治疗靶点的主要工具,能弥补在细胞实验水平缺乏的整体效应影响,为研究人员在整体水平研究皮肤创伤提供了可行性。 目前,皮肤创伤动物模型的构建主要以物理方法为主,如由物理因素造成的机械性损伤(擦伤、切割伤、刺伤、撕裂伤、咬伤、碾压伤)、温度性损伤(烧伤、烫伤、冻伤)、压力性损伤和放射性损伤。 而不同的物理方法构建的动物模型其生物学特点有所差异。 因此,本文基于物理方法皮肤创伤动物模型的构建方法与评价指标,总结分析不同动物模型的优缺点,从而为构建科学合理的皮肤创面动物模型以及研究促进创面愈合的新疗法提供参考意义。
1 小鼠模型及评价指标
1.1 小鼠全层皮肤创面模型
目前,构建小鼠全层皮肤创面模型主要采用近交系C57BL/6 及BALB/c 品系小鼠,通过活检穿孔器或手术剪刀切除小鼠背部或后腿部分皮肤,从而制造1 ~6 个3 ~10 mm 直径的圆形创面[4-8]。 值得注意的是,当创面直径太小时,其伤口愈合时间越短、愈合速度越快,不利于需要长期观察处理因素对伤口愈合的研究。 小鼠耳部皮肤相对较薄,制造1 mm 深至软骨的小伤口,可在1 周后变为全层孔,该部位受呼吸运动的影响较小,容易观察血管再生和伤口的愈合情况[9]。 另外,不同部位的创面其收缩程度不同,尾部与背部皮肤相比收缩程度更高,多依赖于上皮间质转化使伤口闭合,其愈合时间较长,约21 d 才能完全愈合[10]。 同时尾部没有致密的毛发,无需进行剃毛处理。 此外,由于裸鼠存在明显的免疫功能缺陷特点且无毛发覆盖,表现出严重的创面炎症反应,造模成功率较高且能够动态的可视化伤口愈合情况,也常作为皮肤创面模型动物,但其伤口愈合时间较长[11-12]。
小鼠全层皮肤创面模型主要通过对不同时间点的创面图像分析, 利用组织病理检查(histopathology examination, HPE) 和免疫组化(immunohistochemistry,IHC)法评价创面微环境炎性细胞浸润及非炎性细胞迁移增殖分化程度,再通过定量分析炎症因子如干扰素(interferon,IFN)-γ、肿瘤坏死因子(tumor necrosis factor,TNF)-α、白细胞介素(interleukin,IL)-6、 IL-10,生长因子如血管内皮生长因子(vascular endothelial growth factor,VEGF)、表皮生长因子(epidermal growth factor,EGF)、转化生长因子(ttransforming growth factor,TGF )-β1、 基 质 金 属 蛋 白 酶 ( matrix metalloproteinases,MMP)、CXC 趋化因子等指标的表达水平,综合评价模型的成功与否。 其通常在伤后12 h 炎性细胞开始浸润伤口;24 h 内上皮开始增厚;48 h 内整个伤口表面开始发生再上皮化;5 d 新生血管生成;7 d 炎性细胞减少、实现完全上皮化;10 d 伤口完全愈合[4-6,8]。
1.2 小鼠切除性伤口夹板模型
人类皮肤伤口的愈合过程与小鼠不同,人类主要通过表皮再生促进伤口愈合,而小鼠则主要通过收缩反应[13]。 为克服这一问题建立切除性伤口夹板模型。 该类模型通常选择内径大于或等于创面直径的环形塑料或硅胶夹板固定在伤口周围,用强力胶或医用粘合剂粘附,5-0 号尼龙线以间断缝合的方式固定,从而保证其在伤口位置的长时间固定,直至伤口愈合[14-18]。 切除性伤口夹板模型小鼠普遍存在严重的炎症反应,尤其是糖尿病小鼠的伤口炎症则更为明显,并且伤口容易感染且分泌物较多[19]。 因此在模型构建成功后多选择Tegaderm 透明敷料覆盖伤口,防止细菌感染和伤口干燥,同时该透明敷料也便于创面愈合情况的观察。 此外,为避免小鼠转头咬断缝合线,也可使用硅胶背心或医用绷带进一步包扎[17,20]。
此类模型已用于评估微移植物技术、细胞疗法或机制研究对伤口愈合的效力[21-23]。 愈合初期炎症阶段,中性粒细胞、巨噬细胞、T 细胞数量显著增加;增殖阶段主要以CD31、CD34、Ki67、α-平滑肌动蛋白(smooth-muscle actin,SMA)、收缩上皮长度和再生上皮长度为指标评估创面血管生成、肉芽组织形成及再上皮化程度;MMP 活性常用来评价细胞外基质向瘢痕组织的重塑[14-18,20-23]。
1.3 小鼠皮肤移植模型
大面积皮肤创伤模型主要采用真皮模板、同种和异种皮肤移植、细胞片移植至裸鼠或免疫缺陷小鼠全层皮肤创面模型[24-27]。 该类小鼠由于缺乏T淋巴细胞、无胸腺,具有免疫功能缺陷的特点,因此对移植物的耐受性较好、移植排斥风险更低[25,28]。临床上常用真皮模板修复皮肤,其可通过创造一个适合宿主细胞渗透和生成新真皮的微环境来取代受损的真皮,同时能抑制伤口收缩、减少瘢痕形成和纤维化。 目前,同种和异种皮肤移植也应用较广,通常可选择中厚度或全厚度皮肤,前者愈合速度、血管重建快,仅需7 周时间就能脱去缺血结痂,而后者至少需12 周,但全厚度皮肤能更好的概括人类皮肤的完整结构[25-26]。 此外,也有学者选择人上皮细胞片移植以评估工程细胞片保存技术,其能完全覆盖创面、保存良好的细胞外微环境减少细胞凋亡,但移植前需花数周才能产生可移植物,耗时较长[27]。 此类模型多采用肉眼观察表皮变化、炎性细胞浸润及促(抗)炎因子表达、血管生成和移植物存活率等指标进行评价[25-28]。
1.4 小鼠溃疡模型
溃疡属于慢性伤口,其具有时间长、过度炎症反应、持续性感染及耐药微生物生物膜形成等特点[29]。 目前,有学者通过结扎髂外动脉及切除股浅动脉诱导后肢缺血,再制造膝关节下全层创面以构建足溃疡模型[30];或是用两个圆形磁铁夹住小鼠背部皮肤12 h,取下磁铁使血液正常流通12 h 以构建压力性溃疡模型[31]。 该模型与全层创面模型相比创面愈合率明显更低,愈合速度更慢,14 d 仍有结痂,无法实现完全愈合,可用于研究慢性伤口愈合过程中各个阶段相关参数的变化,如再上皮化百分率、上皮厚度指数、角质化、肉芽组织厚度和瘢痕抬高指数(scar elevation index,SEI)等[29-31]。
1.5 小鼠烧伤模型
小鼠烧伤创面模型采用沸水烫、紫外照射等物理损伤方式构建。 目前,多采用92 ~100℃水在小鼠背部烫伤,从而制造2 ~4 个烧伤创面或全身20%烫伤[32-33]。 该方法具有烫伤温度和面积容易控制的优点,并且其作用均匀、重复性好、模型稳定。 另外,WONG 等[34]选择C57BL/6 小鼠和受伤或烧伤后可完全再生皮肤的非洲刺毛鼠(Acomys),将其暴露于200 mJ/cm2的紫外线照射以构建小鼠烧伤模型。 48 h 急性紫外照射导致C57BL/6 小鼠表皮厚度增加及明显的炎症反应,此时角蛋白(keratin,K)14 表达水平显著高于K10,角质形成细胞处于快速增殖状态,而Acomys形成了K14+/K10+双阳性中间层,使得角质形成细胞发生快速分化和凋亡,且无表皮增生和炎症反应,从而实现伤口的快速愈合。 小鼠烧伤模型伴有极少或不出血的特点,可避免止血过程,其主要用于探究细胞疗法促进皮肤组织再生的相关机制,通常以CD31、α-SMA、K10、K14 为指标评价血管生成能力和角质形成细胞的增殖情况[32-33]。
1.6 小鼠线性创伤模型
线性创伤模型多在小鼠背部或腹部,利用手术刀对皮肤进行切割以产生线性切口,长度以2 cm 左右为宜,深达筋膜。 此类模型可用于分析经皮给药的药物治疗效果评价[35]。 该模型以创面抗张力强度(tension strength,TS)、瘢痕强度、HE 染色、血液分析为评价指标及方法,但不适于组织病理学与生化学指标的观察。
其具体造模方法见表1。
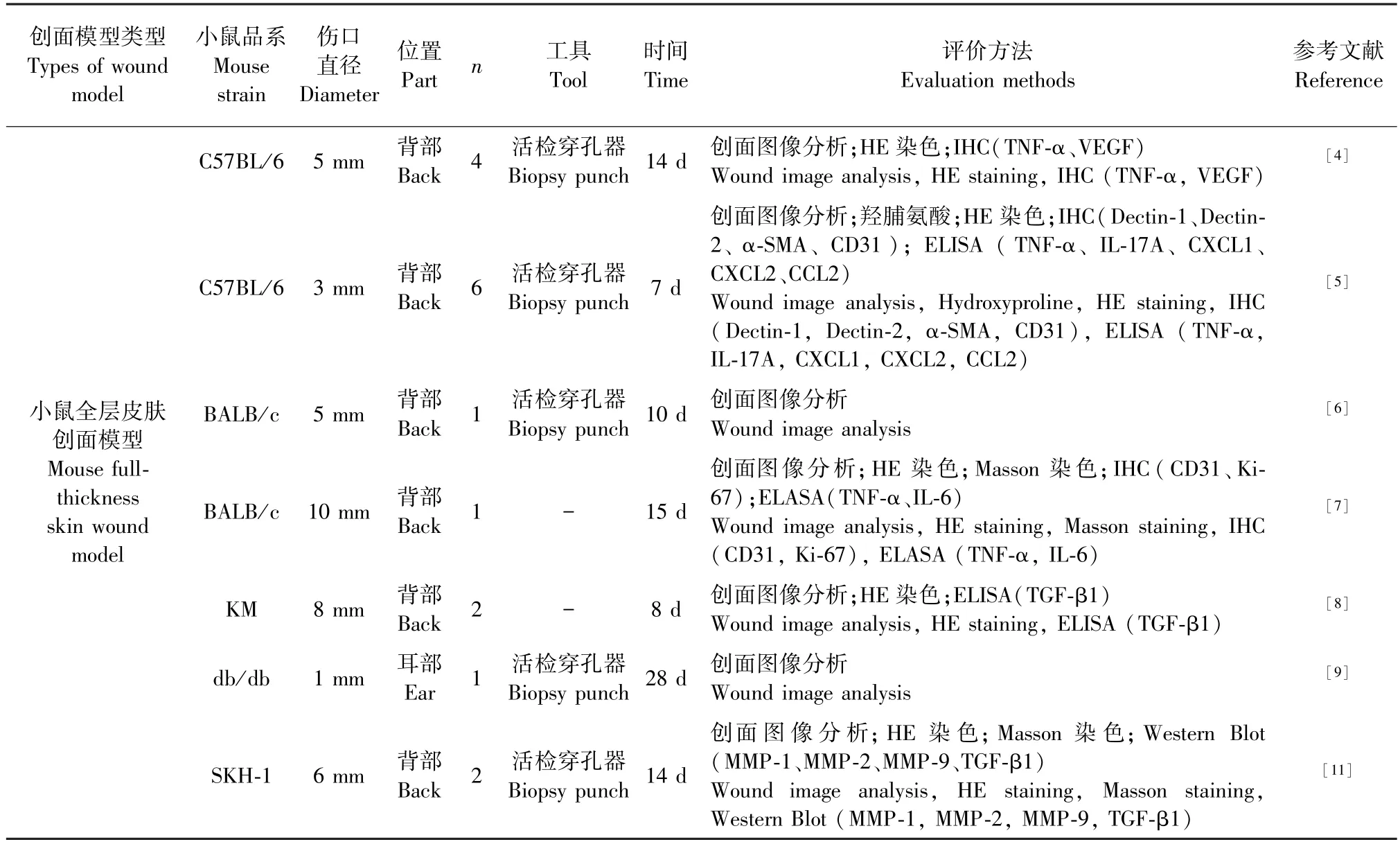
表1 小鼠皮肤创面模型的构建及评价方法Table 1 Construction and evaluation methods of mouse skin wound model
2 大鼠模型及评价指标
2.1 大鼠全层皮肤创面模型
大鼠在生理学、形态学和遗传学上都比小鼠更接近人类,因此大鼠成为生物医学的更理想研究动物[36]。 目前,构建大鼠全层皮肤创面模型主要采用封闭群Wistar 及SD 白化大鼠,通过无菌活检穿孔器、手术剪刀或金属冲头切除大鼠背部局部皮肤构建创面。 由于大鼠体型较大,因此,可制造1 ~6 个6 ~40 mm 直径的圆形创面,但其创面愈合时间、模型稳定性、最终取材量普遍高于小鼠[37-42]。 其具体造模方法见表2,一般造模后7 d 内主要处于炎症阶段,7 ~14 d 主要表现为细胞增殖阶段,第7 天开始细胞外基质重塑,完全愈合的时间受创面大小、位置、造模方式等因素影响[37-41]。 例如,为模拟慢性伤口不同程度的局部组织缺血,通过在大鼠皮下放置硅膜或玻璃盖玻片的方法显著延迟伤口的愈合[43-44]。 目前,此模型主要用于评估不同的药物制剂、纳米材料及细胞疗法对伤口愈合的促进作用[45-48]。
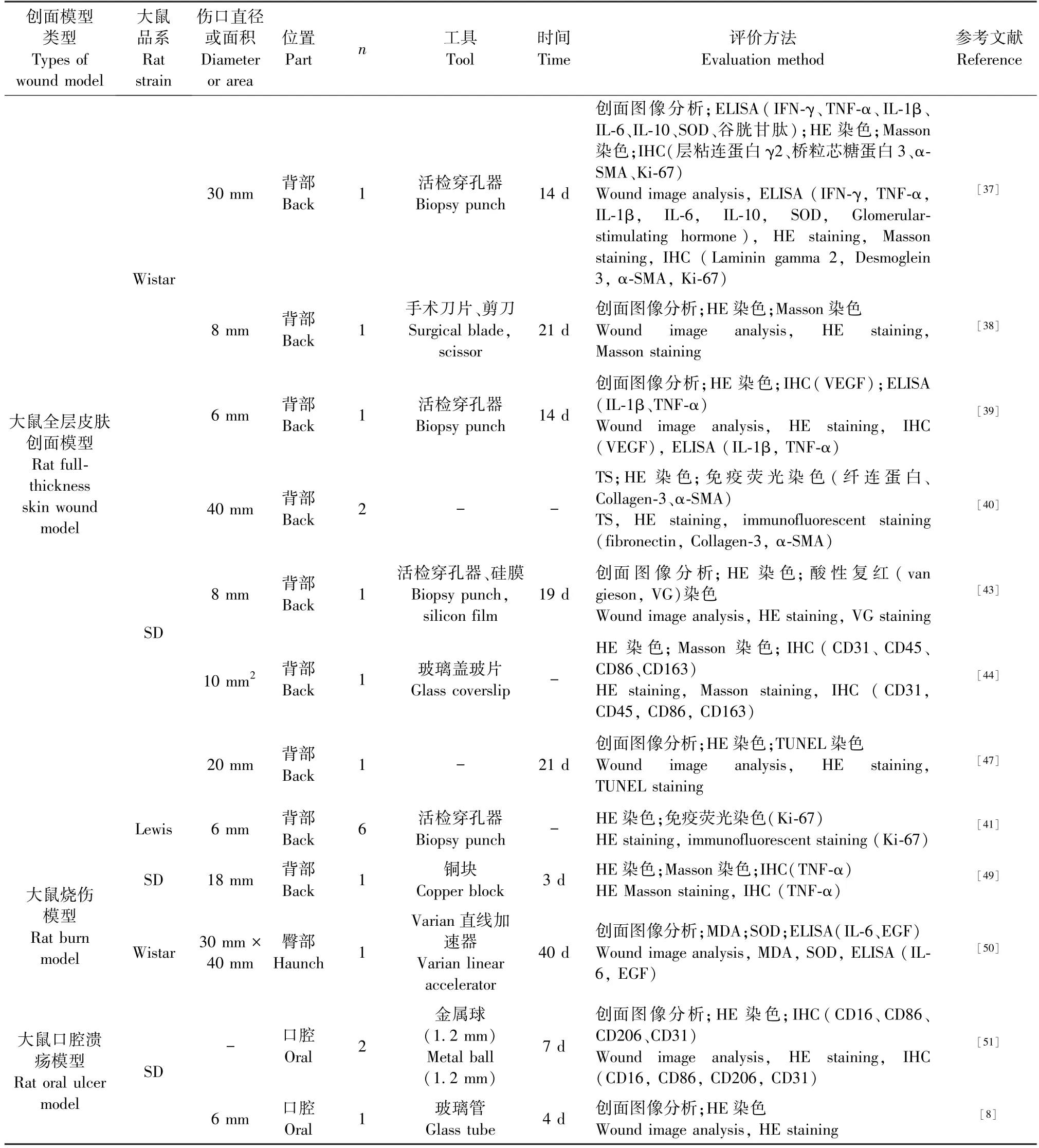
表2 大鼠皮肤创面模型的构建及评价方法Table 2 Construction and evaluation methods of rat skin wound model
2.2 大鼠烧伤模型
通过热金属烫伤、电子束照射等物理损伤大鼠背部或臀部构建烧伤创面模型[49-50]。 采用金属烫伤方法其操作简单易行且烫伤面积便于控制,但存在金属块接触烫伤区域的压力难以控制、烫伤深度误差较大的缺点。 而电子束照射则无需直接接触致伤源,有效消除了这一影响,并且该方法在麻醉或者清醒状态下均可进行,且无需剃毛,约1 周会发生脱毛现象,2 周出现大片干性皮肤脱皮,3 周皮肤变湿润并有毛囊和红斑出现[49]。 目前,烧伤模型已用于评估新型水凝胶和富氢水促进烧伤创面愈合的相关机制研究,通常造模1 周内IL-6 显著增加,直到第4 周表皮生长因子(epidermal growth factor,EGF)和超氧化物歧化酶(superoxide,SOD)表达水平逐渐升高,丙二醛(malon-dialdehyde,MDA)含量则呈下降趋势,5 周可实现伤口完全愈合[49-50]。
2.3 大鼠口腔溃疡模型
主要通过金属球和30%冰醋酸浸泡的玻璃管按压下牙龈或上颚以构建口腔溃疡模型[8,51]。 口腔与皮肤组织不同,在愈合过程中表现出较少的炎症反应,一般约12 d 恢复[51]。 由于口腔溃疡病因复杂,发病机制不明,临床上尚无特效治疗药物,因此该模型可用于探究治疗口腔溃疡的创新疗法。
3 其他动物模型及评价指标
兔全层皮肤创面模型的构建多选1.5 ~2.5 kg 的新西兰白兔,通过手术刀或剪刀切除背部皮肤,制造6 ~20 mm 的圆形或方形创面。 创面形状不同对应的麻醉方式也不同,通常圆形创面采用肌肉注射盐酸氯胺酮和赛拉津[52-53],而方形创面则于4 个顶角皮下注射利多卡因[54]。 兔耳皮肤紧致毛发少,具有较多神经和血管,常于腹侧制造6 ~8个7 ~15 mm 圆形创面,由于3 周内成纤维细胞数量显著增加、胶原蛋白过度沉积、慢性炎症引起SEI显著增高,从而导致兔耳肥厚瘢痕,形成兔耳增生性瘢痕模型。 因此该模型常作为研究皮肤疤痕形成的细胞分子机制的首选模型[53,55-58]。
猪全层皮肤创面模型采用大型白色杂交猪、约克夏猪、皮特兰猪,这类大型动物需在全麻情况下先绘制出伤口图案,再通过无菌手术刀于背部单侧或双侧制造6 ~20 个边长20 ~50 mm 方形全层创面[59-61]。 猪皮肤的表皮、厚度、毛囊密度、皮脂腺等与人类皮肤相似,被认为是与人类皮肤进行比较的最佳实验模型,但出于其不同位置收缩程度不同的特点,制造创面时必须严格依照标准化程序操作[62-63]。 因此,KUO 等[64]选择体型、体重和生理状态与人相似的小型兰屿猪,在背部两侧的不同位置制造创面阵列,建立最佳创面大小和相邻创面最小距离的黄金标准,以有效区分各种干预措施,证实了背部皮肤的伤口位置不会显著影响伤口的闭合或收缩。 此类模型可用于精确筛选不同创面敷料、细胞治疗和药物的有效性。
羊全层皮肤创面模型多选择绵羊,在局部麻醉下,采用无菌手术刀片和方形导向器在背部制造1 ~4 个等距、边长20 ~40 mm 方形创面。 一般需在致伤前1 个月进行驱虫处理[65-66]。 然而,目前绵羊模型更偏向于骨骼、韧带和肌腱方面的创伤研究,对皮肤创伤愈合的研究较少。
大型非啮齿类动物模型造模后出血量较多,1 ~2 周内处于出血和炎症阶段且通常伴有大量渗出液,需定时更换伤口敷料[59-66];2 ~3 周可观察到新生肉芽组织形成、细胞外基质沉积和角质形成细胞再上皮化;2 个月基本可实现再上皮化和伤口完全闭合,但仍存在轻微炎症;6 个月皮肤的细胞外基质重塑程度和拉伸强度仍未恢复到正常水平,若要实现完全恢复需一年或更长时间[52-66]。 详见表3。
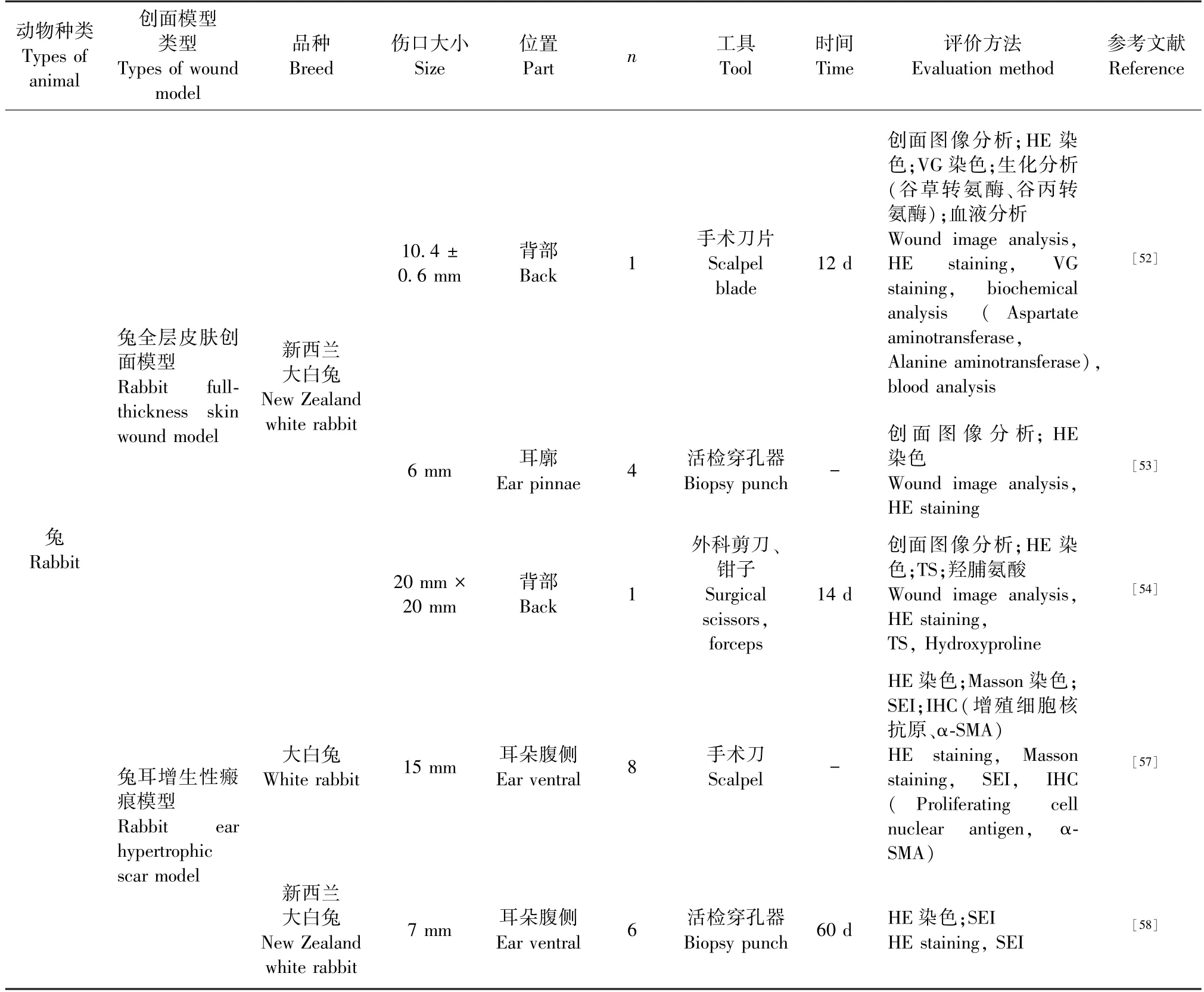
表3 其他动物皮肤创面模型的构建及评价方法Table 3 Construction and evaluation methods of other animal skin wound models
4 总结与讨论
大小鼠价格相对低廉、易获取,而大型动物成本高、饲养难,且皮肤创伤的操作过程及麻醉要求相对较高,因此常选择大小鼠作为研究皮肤创伤的模型动物。 大小鼠全层皮肤创伤动物模型的构建与其他模型相比操作简单、周期短、成模率较高,是探究皮肤创面愈合相关机制最常用的创伤模型。而切除性伤口夹板模型、皮肤溃疡、移植模型和大型动物模型则耗时较长,需考虑夹板的缝合、控制缺血方式的选择、移植物的准备及保存等问题,并且由于存在严重的炎症反应和渗出物较多的特点,需定时更换敷料以保持伤口湿润以及防止细菌感染。 但此类模型能够更好地克服伤口收缩以模拟人表皮再生过程,常用于评估不同细胞疗法对伤口愈合的效力。 通过紫外和电子束照射构建的烧伤模型具有烫伤面积易控制、无需直接接触致伤源的优点,能够有效减少金属烫伤导致深度误差较大的缺点,该模型可应用于临床常见的烧伤患者和辐射烧伤患者皮肤创面愈合的相关研究。 大鼠口腔溃疡模型是推动人类口腔内伤口愈合相关机制研究的关键一环,然而按压金属球和30%冰醋酸浸泡的玻璃管诱导的口腔溃疡模型与临床的口腔溃疡仍有一定的差异,因此如何更好地模拟构建临床口腔溃疡模型仍需进一步的探索。
物理方法构建的皮肤创伤动物模型方法多样,制造的创面没有统一标准,通常为急性伤口,愈合时间较短且伴随正常的炎症反应,无其它的潜在影响因素。 而临床上多为慢性伤口(如血管性溃疡、糖尿病足溃疡、创伤性溃疡、压力性溃疡),影响因素复杂多样,常表现为严重的炎症风暴、细胞增殖较少、促生长因子表达较低,且常伴有细菌的感染。可见,通过物理方法构建的皮肤创伤动物模型与临床患者的皮肤创伤微环境仍有一定的区别。 因此,下一步研究应聚焦于如何构建更加符合临床皮肤创伤复杂微环境的动物模型,可通过移菌方式、皮肤移植、基因敲除鼠、物理化学协同诱导等方式构建多因素诱导的复合创伤模型,从而为开发促进皮肤创伤愈合的药物研究、新疗法提供参考依据。
此外,皮肤创伤动物模型的评价方法和指标,主要通过采集图像进行伤口愈合过程中形态学分析,同时观察炎性细胞浸润程度、炎症因子(IFN-γ、TNF-α、IL-6、IL-10)及生长因子(VEGF、EGF、TGFβ1)的表达水平、细胞增殖Mark 蛋白(CD31、CD34、Ki67、PCNA、α-SMA、K10、K14)表达、细胞外基质重塑(MMP-1/2/9、Collagen-3、SEI)共同评价皮肤创伤模型及药效指标。 然而,目前皮肤创面的图像采集只限于某个时间点,无法动态监测记录伤口的愈合过程,因此,创面愈合过程的动态可视化图像采集仍存在挑战和难点,如何通过微型生物传感器、显微成像仪等设备技术,研究可定量化创面面积、可视化创面图像、动态化监测创面菌群变化设备仍需做进一步思考与探索,以确保皮肤创伤动物模型评价指标的科学化和精准化。
总之,目前皮肤创伤模型的构建仍处于探究阶段,动物模型无法完全模拟人类皮肤伤口的愈合过程,与临床患者相比仍有较大差异。 研究人员应根据动物品系多样性、造模方法优缺点、评价指标的选择性以及操作的可行性,充分结合研究目的,科学合理的选择最优的皮肤创伤动物模型构建方法,旨在构建更符合临床皮肤创面微环境的动物模型,为促进创面愈合的新疗法、新材料、新药物研究提供参考依据。
