BAPN 诱导小鼠胸主动脉夹层合并急性肺损伤模型的建立
2024-04-02买志妍江丽青朱翰朝张溧昀王云段维勋
买志妍江丽青朱翰朝张溧昀王云∗段维勋∗
(1. 宁夏医科大学临床医学院,银川 750004;2. 空军军医大学西京医院心血管外科,西安 710032;3. 宁夏医科大学总医院心脏大血管外科,银川 750004)
胸主动脉夹层(thoracic aortic dissection,TAD)是心脏大血管外科最凶险的主动脉疾病之一[1]。TAD 是一种由于各种原因致血管壁内膜破裂,腔内的血液顺着内膜破裂口进入中膜形成夹层血肿,随着血液不断流入中膜并沿主动脉长轴扩展,使主动脉内膜和中膜分开形成真、假两腔的主动脉疾病[2-4],其发病率和死亡率在主动脉疾病中都位居前列。 据最近研究表明,每100 万人中约有5 ~10例发生TAD 且发病率呈逐年上升趋势[5-7]。 因其特有的发病特点,TAD 形成后会伴随一种或多种严重的并发症。 据有关文献报道约34.9% ~53.8%的TAD 患者合并急性肺损伤(acute lung injury,ALI)[8],导致患者围术期的生存质量明显降低。
近几年,学者基于TAD 动物模型[9-11],在TAD相关发病机制研究方面取得了一些突破性的进展[12],但有关TAD 合并ALI 发病机制或有效药物作用靶点等研究“望而却步”。 目前已有多种较为成熟的TAD 造模方式,最常用的造模方法之一是β-氨基丙腈( β-aminopropionitrile monofumarate,BAPN)药物诱导法[13-14]。 然而,关于构建一种合理的TAD 合并ALI 的动物模型仍是该领域研究的“软肋”。 因此,本研究的目的是采用BAPN 诱导小鼠形成TAD 的造模方式,观察小鼠ALI 的相关指标验证TAD 合并ALI 动物模型是否构建成功,并以期为研究TAD 合并ALI 发病机制等提供理论基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
45 只SPF 级雄性C57BL/6J 小鼠,3 周龄,体重约10 g,购自空军军医大学动物实验中心【SCXK(陕)2019-001】。 所有实验动物均在空军军医大学实验动物中心饲养【SYXK(陕)2019-001】,饲料由宁夏医科大学实验动物中心提供的标准普通饲料(20-SM230704019)。 饲喂环境: 室内温度为20 ~24 ℃, 相对湿度45% ~55%,光照/黑暗周期设定为12 h,均予以高压蒸汽对小鼠饲料和垫料进行灭菌处理。 严格遵循“减少、替代、优化”的“3R”原则对小鼠进行饲养。 本实验已通过空军军医大学实验动物福利伦理委员会审查批准(20220440)。
1.1.2 主要试剂与仪器
β-氨基丙腈( Sigma Aldrich 公司, 货号:ly1002184);BCA 蛋白定量试剂盒(美国Thermo Fisher 公司, 批号: VK314219 ); IL-6 ( E-ELM2453c)、 IL-1β (E-EL-M0037c)、 TNF-α (E-ELM3063)检测试剂盒均购自武汉伊莱瑞特生物科技股份有限公司;苏木素-伊红试剂盒购自北京索来宝有限公司;4%多聚甲醛、无水乙醇购自天津天大化工厂;二甲苯购自广东西陇科学公司。
Vevo3100 小动物超声仪(Visual-Sonics 公司,加拿大);激光共聚焦显微镜(Olympus 公司,日本);电子分析天平(瑞士Mettler 公司);脱色摇床为(Kylin-Bell 有限公司产品);离心机(无锡瑞江分析仪器有限公司);高温高压灭菌锅(日本Sanyo 公司);恒温水浴锅(上海博讯医疗生物仪器股份有限公司);普通冰箱(海尔集团);组织自动脱水机、石蜡包埋机、石蜡切片机均购自武汉俊杰电子公司;电热恒温鼓风干燥箱购自天津市莱玻特瑞仪器设备公司。
1.2 方法
1.2.1 实验动物分组及模型构建
使用随机数据表法将45 只3 周龄[15-16]雄性C57BL/6J 小鼠分成两组。 BAPN 组30 只:喂食正常饲料,BAPN 粉末溶于无菌双蒸水配制成浓度为1 g/(kg·d) 溶液,并使用棕色饮水瓶(防止BAPN见光分解)饮水给药4 周;CON 组15 只:给予正常饮食水。 使用小动物超声仪,分别在小鼠饮水第2、3、4 周测量胸主动脉最大直径(TAD 诊断标准为:局部主动脉扩张到正常直径的50%以上)[17-18],并结合主动脉组织HE 染色结果,确定小鼠TAD 是否形成[19],再将BAPN 组分为Non-TAD 组和TAD 组,进一步检测3 组小鼠肺组织HE 病理染色、肺组织W/D 及BALF 中总蛋白和炎症指标表达水平验证小鼠TAD 合并ALI 模型[20]。
1.2.2 小鼠一般情况及肺组织、主动脉大体观察
造模期间,观察小鼠活动状况,定期记录小鼠饮水量和体重,直至小鼠因夹层破裂死亡或实验结束,期间若发现小鼠死亡,立即解剖,探查死亡原因。 实验结束后,将实验小鼠麻醉并固定于小动物手术台,充分暴露胸腔,观察小鼠左右肺组织颜色、形态、表面有无坏死及渗出等,并留取两侧肺备用;分离主动脉周围组织,暴露主动脉,用PBS 充分冲洗2 ~3 次,观察主动脉是否有局部膨大及血管壁破裂,留取主动脉组织备用,并统计TAD 破裂及成瘤率。
1.2.3 小鼠主动脉苏木素-伊红(HE)染色病理学观察
用4%多聚甲醛固定好的主动脉组织依次置于浓度由低到高的乙醇溶液中脱水,二甲苯透明及石蜡包埋,切成5 μm 厚度切片。 再烤片、脱蜡、脱苯,进行苏木素染色细胞核5 min,返蓝,伊红染色细胞质5 min,冲洗、乙醇脱水、二甲苯2 min 透明后,中性树脂封片。 制备好的切片置于显微镜下观察。
1.2.4 小鼠肺组织HE 染色病理学观察
取小鼠左肺组织, HE 染色操作步骤同“1.2.3”。 将制备好的肺组织切片置于显微镜下观察并采集图像。 肺损伤程度评估采用2011 年于美国胸科学会研讨会[20]提出的肺损伤评分表,见表1。
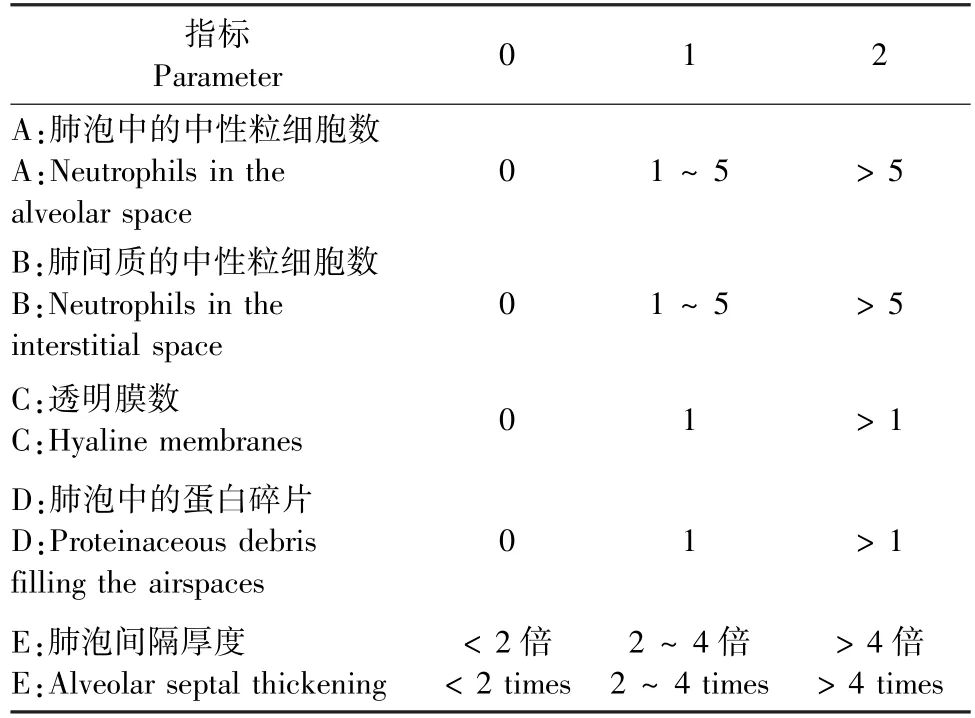
表1 肺损伤评分表Table 1 Lung injury scoring scale
1.2.5 小鼠肺泡灌洗液(broncho alveolar lavage fluid,BALF)中总蛋白水平检测
将小鼠适度麻醉并固定于手术台上,切开小鼠颈部皮肤,充分暴露并分离左右主支气管,缝合线结扎右侧主支气管。 使用静脉留置针向肺内注入1 mL 预冷无菌PBS 液,反复灌洗3 次,可回收75%~80%的灌洗液。 收集到的BALF 离心后吸取上清液,按照BCA 试剂盒操作说明测定上清液中总蛋白浓度。
1.2.6 酶联免疫吸附剂 ( enzyme linked immunosorbent assay,ELISA)法检测小鼠BALF 中IL-6、IL-1β、TNF-α 表达水平
收集小鼠肺泡灌洗液中上清液的方法同“1.2.5”。 按照ELISA 试剂盒的实验说明书逐步操作,在450 nm 波长处测定各孔的OD 值,并分别计算BALF 中IL-1β、IL-6、TNF-α 浓度。
1.2.7 小鼠肺组织湿干重比(dry/wet weight ratio,W/D)测定
取出右肺并清洁表面水渍后,置于电子分析天平上称重即肺湿重(wet weight,W)。 再将肺组织放于铝箔纸上,于60 ℃恒温干燥箱中烘干48 h 至恒重,取出肺组织再次称重即肺干重(dry weight,D)。计算湿/干重比值(W/D)评估小鼠肺水肿程度。
1.3 统计学分析
所有实验数据采用SPSS 23.0 统计学软件进行分析,计量资料先进行正态性及方差齐性检验,以平均值± 标准差(±s)表示符合正态性分布,两组间比较采用独立样本T检验,多组间比较采用单因素方差分析;若不符合正态性分布,采用秩和检验分析。 分类变量采用χ2检验分析。 用GraphPad Prism 9.5.0 软件作图并分析,以P<0.05 为差异具有统计学意义。
2 结果
2.1 小鼠一般情况
随着给药时间的增加,BAPN 组小鼠整体饮水量较CON 组呈现减少的趋势(图1A)。 两组小鼠体重随日龄增加虽都有增长,但相较于CON 组,BAPN组整体体重的增长趋于缓慢(图1B)。
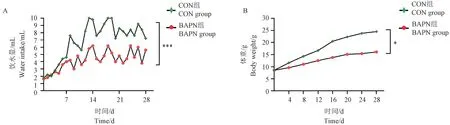
图1 两组小鼠饮水量和体重的比较Note. A. Daily water intake of mice. B. Changes in body weight of mice. Compared with CON group, ∗P <0.05, ∗∗∗P <0.001.(The same in the following figures)Figure 1 Comparison of water intake and body weight of mice in two groups
2.2 小鼠胸主动脉夹层成瘤及破裂情况
至实验结束,CON 组小鼠无主动脉夹层形成或死亡。 BAPN 组,5 只小鼠死亡,其存活小鼠有17 只形成TAD、8 只小鼠未形成,小鼠TAD 形成率为73%、破裂率为17%。 死亡小鼠当即予以解剖,观察到胸腔大量血凝块,主动脉壁存在破裂口,判定为夹层破裂致死(图2)。
2.3 小动物超声仪测量小鼠主动脉直径结果
采用小动物超声仪分别于给药第2、3、4 周测量CON 组和BAPN 组小鼠主动脉直径,根据胸主动脉最大直径是否扩张及主动脉HE 染色结果,将BAPN组分为Non-TAD 组和TAD 组。 如图3 所示,CON组和Non-TAD 组小鼠主动脉直径无明显差异,而与TAD 组相比,形成夹层小鼠的主动脉直径明显扩张,差异具有显著性(P<0.001)。

图3 三组小鼠主动脉扩张情况比较Note. A. Ultrasonic representation of aorta vessels of mice in each group. B. Statistical diagram of the maximum aortic diameter of mice in each group. Compared with non-TAD group, ###P <0.001.(The same in the following figures)Figure 3 Comparison of aortic dilation in three groups of mice
2.4 各组小鼠主动脉病理变化
在光学显微镜下观察3 组小鼠主动脉HE 病理染色,发现CON 组和Non-TAD 组小鼠主动脉壁结构均完整,未见明显增厚及炎性细胞浸润。 而TAD组小鼠主动脉中层可见明显增厚,并可见主动脉壁结构破坏、紊乱(图4)。
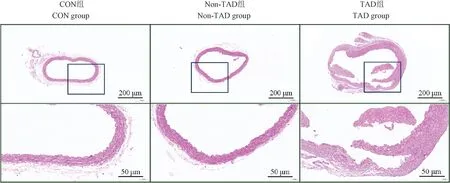
图4 三组小鼠主动脉HE 染色代表图Figure 4 HE staining diagram of aortas of mice in three group
2.5 各组小鼠BALF 中总蛋白水平及肺组织W/D比较
分别测量各组小鼠肺组织W/D、BALF 中总蛋白水平。 如图5 所示,CON 组和Non-TAD 组无显著性差异;TAD 组小鼠肺组织水肿程度以及BALF 中总蛋白水平明显高于另外两组(P<0.05)。

图5 三组小鼠BALF 中总蛋白水平及肺组织湿干重比的比较Note. A. Statistical chart of lung tissue wet-dry weight ratio of mice in each group. B. Statistical map of BALF total protein content in each group. Compared with non-TAD group, #P <0.05.Figure 5 Comparison of total protein level in BALF and the wet-dry weight ratio of lung tissue in three groups of mice
2.6 各组小鼠BALF 中炎症指标表达水平的比较
TAD 组小鼠BALF 中IL-6、IL-1β、TNF-α 含量均明显高于CON 组和Non-TAD 组(P<0.05),而CON组和Non-TAD 组炎症指标未见明显差异(图6)。
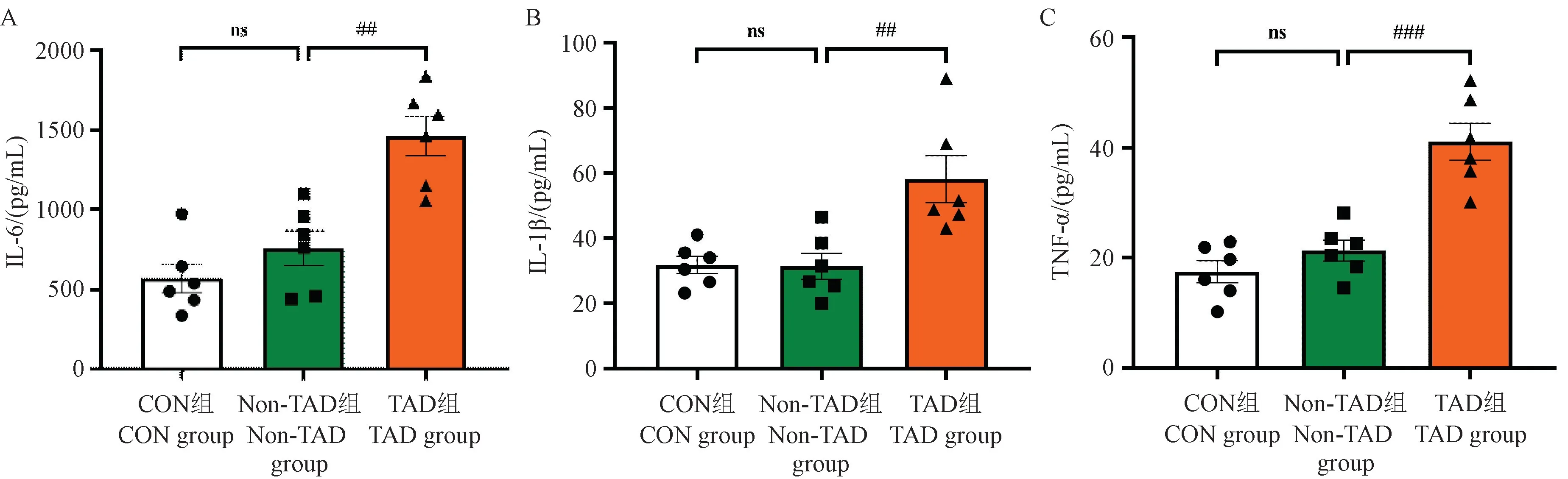
图6 三组小鼠BALF 中炎症因子表达水平比较Note. A. Statistical diagram of IL-6 content. B. Statistical diagram of IL-1β content. C. Statistical diagram of TNF-α content. Compared with non-TAD group, ##P <0.01.Figure 6 Comparison of the expression levels of inflammatory factors in BALF in three groups of mice
2.7 各组小鼠肺组织病理切片结果
CON 组小鼠肺组织未见明显病理改变;Non-TAD 组小鼠表现为肺组织结构完整,肺间质及肺泡腔内未见明显渗液,偶见肺泡壁疏松、肺泡腔轻度扩大;与CON 组和Non-TAD 组比较,TAD 组小鼠肺组织可见肺间质明显水肿增厚(橙色箭头),伴炎性细胞浸润(黑色箭头),肺泡上皮脱落及透明膜形成(蓝色箭头),肺泡腔内也可见炎性细胞浸润(图7A)。 根据肺损伤病理评分标准的结果分析,与CON 组和Non-TAD 组相比,TAD 组肺损伤病理评分显著增高,差异具有显著性(P<0.001),见图7B。
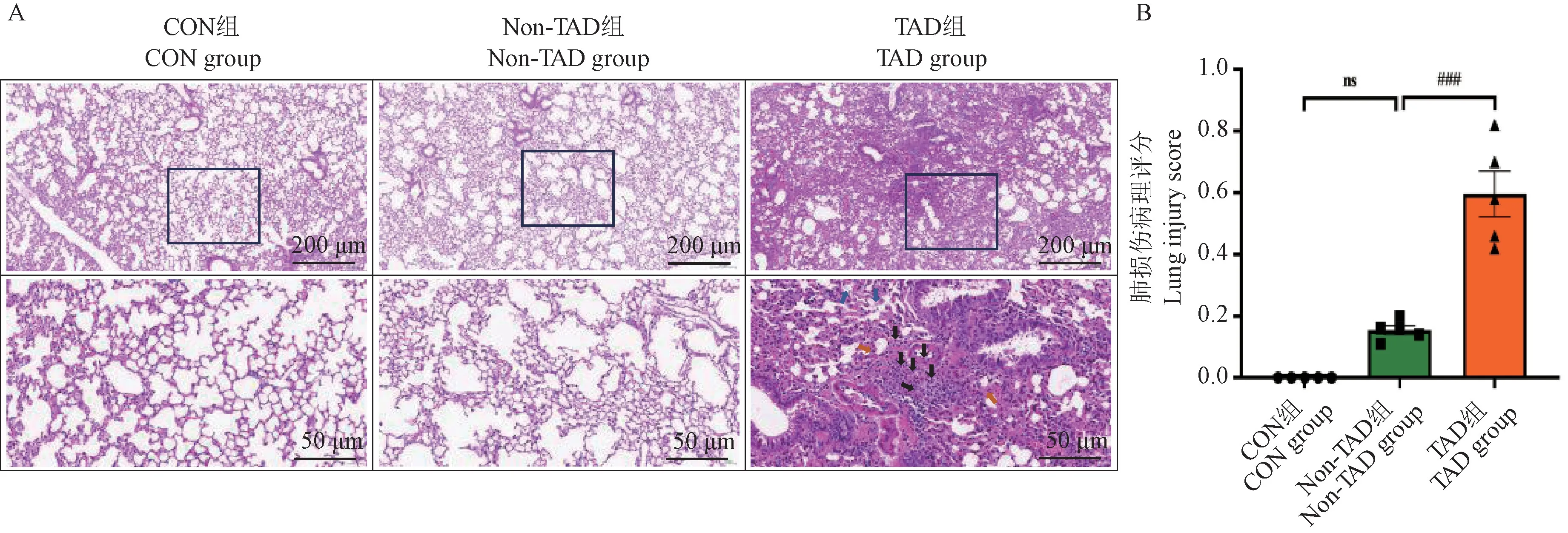
图7 三组小鼠肺组织病理染色和肺损伤评分Note. A. HE staining diagram of lung tissue of mice in each group. B. Statistical chart of lung tissue injury score of mice in each group.Figure 7 Pathological staining of lung and lung injury score in three groups of mice
3 讨论
TAD 是最常见的一种心血管急重症。 患者通常以剧烈胸痛为首要就诊症状,若诊断或治疗不及时,可引起一系列严重的并发症或夹层破裂等威胁患者生命的不良事件发生。 ALI 是TAD 患者在临床上最为常见的合并症之一,临床研究报道TAD 患者术前合并ALI 是导致术后发生急性呼吸窘迫综合征等不良反应事件的重要原因[21]。 而有关TAD 合并ALI 发病机制的研究却甚少。 因此,探究TAD 合并ALI 具体发病机制或有效治疗方式是研究人员目前迫切需要攻破的一大难题。 构建合理的TAD 合并ALI 动物模型是研究疾病发病机制、药物作用分子靶点或评估药物疗效不可或缺的实验工具。
TAD 动物模型大体可分为两种,即在体模型和离体模型,在体模型又包括药物诱导法[22]、开放手术或腔内手术诱导[23]和基因工程建模法[10]等。BAPN 是一种通过抑制赖氨酰氧化酶(lysyloxidase,LOX)活性,催化弹性蛋白和胶原蛋白中的赖氨酸残基交联形成锁链素,从而诱导实验动物形成TAD 的药物[24-25]。 目前,运用最为广泛的是BAPN 联合或者不联合血管紧张素Ⅱ(angiotensin-Ⅱ,Ang-Ⅱ)的药物诱导法[26]。 单纯BAPN 诱导动物形成TAD 就有多种造模方法[27-29]。 文章报道选取3 周龄雄性C57BL/6J 小鼠给予BAPN 1 g/(kg·d)饮水给药4周后TAD 形成率约70% ~90%,且该方法简便、易行且成本较低。 故本课题组用BAPN 1 g/(kg·d)饮水给药4 周诱导3 周龄C57BL/6J 小鼠形成TAD的造模方案,期间通过小动物超声仪测量CON 组和BAPN 组小鼠主动脉最大直径并结合两组小鼠主动脉组织HE 染色,将BAPN 组小鼠分为Non-TAD 组和TAD 组,为后续证明小鼠ALI 发生的主因是TAD而不是BAPN 药物干预而形成提供有力依据。 结果显示,相较于Non-TAD 组和CON 组小鼠,TAD 组小鼠主动脉最大直径明显扩张,且主动脉病理染色示血管中层增厚、内膜呈现较明显的破坏,且BAPN 治疗可一定程度延缓小鼠一般生长状况,这与既往文献[13-14,27]报道结果一致,表明本研究中TAD 小鼠模型构建成功。
ALI 是一种因各种原因引起肺部广泛炎症性病变的呼吸系统疾病[30]。 若病情加重,可发展为危重的急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)[31-32]。 随着人们对ALI 疾病的深入探索,已研发出多种符合人类ALI 病理特点的动物模型,并于2011 年美国胸科学会研讨会针对动物实验性ALI 提出较统一的诊断标准[20]:(1)组织损伤的组织学依据;(2)肺泡-毛细血管屏障的改变;(3)炎症反应;(4)生理功能障碍的依据。 满足三个及三个以上主要特征指标,可诊断为ALI 动物模型建立成功。 故本课题组通过小鼠肺组织HE 病理染色提供组织学证据;肺组织W/D 及检测BALF 中总蛋白水平体现肺泡-毛细血管屏障的改变情况;ELISA 检测小鼠BALF 中IL-6、IL-1β、TNF-α 表达水平提供炎症反应依据。 由实验数据显示,CON 组和Non-TAD 组小鼠中,CON 组小鼠肺组织病理染色无明显异常,Non-TAD 组小鼠肺组织病理染色示偶见肺泡壁轻度增厚、肺泡腔扩大或融合,但未观察到明显形态学改变,这与既往研究结果一致[33-35],两组小鼠肺损伤评分、肺组织W/D 和BALF 中总蛋白水平、TNF-α、IL-1β 和IL-6 表达水平均较低且二者无显著差异;而TAD 组小鼠肺组织病理染色示明显损伤,肺损伤评分、肺组织W/D 和BALF 中总蛋白水平、炎症因子表达水平均显著升高(P<0.05)。上述结果表明,BAPN 干预虽轻度影响小鼠肺组织病理改变,但对肺组织水肿和炎症反应的影响均无明显作用,而形成TAD 小鼠的肺组织病理损伤程度、肺组织水肿程度和炎症反应均显著加重,提示小鼠ALI 的发生与形成TAD 密切相关,并验证BAPN 诱导小鼠TAD 合并ALI 动物模型构建成功。
综上所述,本课题组通过BAPN 1 g/(kg·d)饮水给药4 周的建模方法成功诱导C57BL/6J 小鼠TAD 合并ALI 的动物模型。 有望基于该模型为探究TAD 合并ALI 发病机制或药物有效分子靶点奠定理论基础。 但需要注意的是,该项研究所采用的BAPN 饮水给药的造模方式存在一些不可控的因素,如无法控制每只实验动物的恒定摄药量以及BAPN 药物活性的不稳定性等,同时,由于本实验涉及的样本量较小,针对该模型的稳定性尚需进一步验证。
