IL2rg-/-大鼠支持人RSV 在体内的长期感染
2024-04-02熊芮吴勇杨艳伟屈哲刘甦苏王誉雅马丽颖付瑞彭宜红梁春南范昌发
熊芮吴勇杨艳伟屈哲刘甦苏王誉雅马丽颖付瑞彭宜红梁春南∗范昌发∗
(1. 中国食品药品检定研究院实验动物资源研究所(国家啮齿类实验动物资源库),北京 102629;2. 北京大学医学部基础医学院病原生物学系,北京 100083;3. 中国食品药品检定研究院安全评价研究所(国家药物安全评价监测中心),北京 100176)
人呼吸道合胞病毒(human respiratory syncytial virus, hRSV ) 为具有包膜的肺病毒科(Pneumoviridae)、正肺病毒属(Orthopneumovirus)的单股负链病毒[1]。 其感染呈全球性分布,并有季节性流行的特点[2-3]。 hRSV 的主要感染对象为2 岁以下的婴幼儿,临床上多表现为较轻的上呼吸道症状,如鼻塞、咳嗽等[4]。 hRSV 感染导致的重症多见于1 ~6 月龄的婴儿,通常发展为细支气管肺炎,出现低烧、喘息、胸壁回缩和呼吸急促等[5-6]。
人可能会反复感染hRSV,目前有两种hRSV疫苗获批被用于60 岁以上老年人接种免疫。hRSV 疫苗和治疗性药物在临床试验阶段或临床前研究中取得有限的进展,这在一定程度上是由于缺乏能够完全模拟人类临床感染特征、且持续感染的动物模型。 现有的hRSV 动物模型,包括常见的hRSV 非人灵长类及啮齿类动物感染模型,各有优势,但局限性也很突出。 除黑猩猩外,如最常用的棉鼠和BALB/c 小鼠,为hRSV 的半受纳宿主,仅部分个体易感。 为了建立hRSV 模型,通常采用大剂量病毒攻毒。 即便如此,hRSV 在很多动物模型的呼吸道靶器官内复制维持时间普遍较短[7],且组织病理改变轻微[8-10],与临床表现存在较大差异。
有研究发现采用hRSV 感染免疫功能受到抑制的棉鼠(环磷酰胺处理),其症状与普通棉鼠有明显不同[11-12]。 最为明显的变化是hRSV 清除时间延迟,免疫抑制的棉鼠在hRSV 感染6 周后依旧能在其肺部检测到高滴度病毒,并且肺部病理出现更严重的炎症反应。 这提示在免疫缺陷情况下,可能有利于建立症状更加典型的hRSV 感染模型。 白介素2 受体γ 链(interleukin 2 receptor subunit gamma chain,IL2rg)是IL-2、IL-4、IL-7、IL-9、IL-15 和IL-21的共同受体亚基,IL2rg基因的缺陷会导致大鼠机体免疫功能严重降低,尤其缺乏成熟的NK 细胞[13]。为了制作免疫缺陷效果显著的动物模型,本研究选择敲除IL2rg基因,使大鼠缺乏功能性NK 细胞,构建稳定的免疫缺陷环境,以支持hRSV 在体内持续、高水平复制,以建立更加稳定的感染模型,支持hRSV 治疗性药物体内有效性评价。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF 级Wild-type SD 大鼠(WT)由中国食品药品检定研究院实验动物资源研究所【SCXK(京)2022-0002】提供,纯合型SPF 级SD-IL2rgemx/NIFDC大鼠(缩写为IL2rg-/-)为实验动物资源研究所模式动物研究室自主构建。 WT 和IL2rg-/-大鼠均为3 周龄各17 只,雌雄各半,体重约为60 ~75 g,动物繁殖及实验均在中国食品药品检定研究院屏障设施【SYXK(京)2022-0014】内进行,温度24 ~26 ℃,相对湿度40% ~70%,12 h 明/12 h 暗,饲喂60Co 灭菌SPF 级饲料,自由饮灭菌自来水。 动物实验方案经本院实验动物福利伦理审查委员会审查批准(IACUC2021-B-004),RSV 感染实验在ABSL-2 动物实验室进行。
1.1.2 主要试剂与仪器
戊巴比妥钠(15 mg/mL,75 mg/kg),RNAlaterTMStabilization Solution (Invitrogen), PrimeScript RT reagent Kit with gDNA Eraser(TaKaRa),TB Green(TaKaRa), RBC Lysis Buffer ( BioLegend), Cell Staining Buffer ( BioLegend), Rat T/B/NK Cell Cocktail 抗体(BD),Bio-Plex Pro Rat Cytokine 24-plex Assay(Bio-rad)。
BD LSRII 流式细胞仪, Roche 罗氏LightCycler480。
1.2 方法
1.2.1 IL2rg-/-大鼠模型的构建和hRSV 感染模型的构建
使用TALEN GoldenGate 系统针对大鼠IL2rg基因外显子2 设计TALEN。 将对IL2rg 特异的TALEN质粒转染到大鼠C6 细胞(ATCC,CCL107)中。 用蛋白质印迹分析(Western Blot)确认TALEN 表达,并用MSDase 测定及检查TALEN 的活性。 在体外转录IL2rg-TALEN mRNA 并通过显微注射将其注射到SD 大鼠的受精卵中,然后将受精卵转移至假孕SD雌性大鼠。
WT 和IL2rg-/-大鼠的hRSV 攻毒组和DMEM组在滴鼻(Intranasal,I.N.)之前用戊巴比妥钠溶液浅度麻醉。 将胰岛素注射器针头磨平,吸取40 μL hRSV 病毒(1 × 106TCID50)悬液或DMEM 培养液,缓慢滴进大鼠的鼻孔内。
1.2.2 DNA 提取和基因检测
苯酚氯仿法提取鼠尾DNA,剪取鼠尾(长度<0.5 cm)置于1.5 mL Ep 管中,每管加250 μL 裂解液(含蛋白酶K 5 μL,TaKaRa)。 将样品放置55 ℃水浴锅过夜,加入250 μL TRIS-酚与氯仿的混合物(125 μL TRIS-酚+122.5 μL 氯仿+2.5 μL 异戊醇),充分颠倒混匀,12 000 r/min 离心5 min。 吸取200 μL 上清液至另一新Ep 管中,加入700 μL 冰冷的异丙醇,待有DNA 析出,12 000 r/min 离心10 min,弃上清。 加入冰冷的70% 乙醇(- 20 ℃)1000 μL 漂洗1 次,12 000 r/min 离心10 min,弃上清。 用TE(pH =8.0)溶液在55 ℃溶解沉淀2 h,测定浓度并稀释后用做PCR 模板。 用PCR 法检测IL2rg基因敲除大鼠F0 代基因,大鼠IL2rg 引物为IL2rg-F(5’-GCTCCAAGGTCCTCATGTCCAG-3’)和IL2rg-R(5’-ATCTTCGCCTTTCTGCCCATGAC-3’),电泳后测序。
1.2.3 细胞与病毒培养
将HEp-2 细胞接种于10% FBS 及1%双抗的DMEM 培养基,置于37 ℃,5% CO2培养备用。 当细胞达到90%满瓶时,吸去细胞培养基,用PBS 缓冲液冲洗一遍,加入2 mL 含2% FBS DMEM 培养基稀释的hRSV 病毒,置于37 ℃培养箱中感染2 h 后弃去上清,用PBS 缓冲液冲洗1 遍,再加入10 mL 2% FBS DMEM 培养基培养2 ~3 d,当在显微镜下观察到病变细胞比例达到80% ~90%时,将培养瓶先后置于-80 ℃冰箱和37 ℃培养箱中交替冻融裂解细胞,取上清病毒液,保存于-80 ℃冰箱备用。
1.2.4 临床症状观察与体重
当大鼠接种hRSV 或DMEM 培养液后,连续6 d在同一时间段测量体重,后每隔2 d 测量1 次至21 dpi(days post infection);连续8 d 在同一时间段测量大鼠肛温,后每隔1 d 测量1 次至18 dpi,同时观察有无呼吸道症状、弓背表现、及精神状态异常等临床症状。
1.2.5 病毒载量检测
用戊巴比妥钠溶液麻醉后处死实验动物,取鼻腔,气管和肺组织放入1.5 mL 无菌离心管,加1 mL RNAlater 保存液,4 ℃过夜后弃去RNAlater 保存液并将组织放入-80 ℃冰箱长期保存。 用TRIzol法提取组织RNA,用DEPC 水溶解RNA 后-80 ℃保存。 将hRSV 的RNA 逆转录为cDNA 后,采用绝对荧光定量PCR 检测组织hRSV 病毒载量。 目的基因使用引物hRSV-F(5’-AACGCACCGCTAAGAC AC-3’),hRSV-R(5’-GCCATCATATTCATAGCCT CGG-3’)。
1.2.6 流式法测定免疫细胞含量
用毛细玻璃管从眼内眦取血200 μL,EDTA 抗凝。 用抗体标记细胞,混匀后室温避光孵育20 min。裂解红细胞后,Cell Staining Buffer 混匀后避光低温放置4 h 内上机检测分析,在BD LSRII 流式细胞仪上采用FACS Diva 6.0 Software 软件获取细胞数据。
1.2.7 细胞因子检测
用毛细玻璃管经眼内眦取血200 μL,室温放置2 h,7000 r/min,离心20 min,吸取血清后放于-20 ℃冰箱保存。 细胞因子用MSD(Meso Scale Discovery)法检测。 将微珠加入样品孔中孵育,结束时加入细胞因子检测抗体继续孵育,后用试剂盒中的Streptavidin-PE 荧光色素显色,使用Bio-Plex 200系统读板,得最终检测结果,单位为pg/mL。
1.2.8 组织病理观察
取鼻和肺组织,用10%中性福尔马林缓冲液固定,石蜡包埋切片,厚度0.3 μm,苏木精-伊红(hematoxylin and eosin,HE)染色,中性树胶封片,显微镜观察并拍照。
1.3 统计学分析
2 结果
2.1 获得NK 细胞缺失的纯合IL2rg-/-敲除大鼠
IL2rg基因位于X 染色体上,全长3.7 kb,本模型设计的敲除位点位于2 号外显子(图1A)。 设计PCR 引物扩增IL2rg-/-大鼠目标基因切割位点附近序列,从WT 大鼠中扩增获得长度为929 bp,IL2rg-/-大鼠的PCR 片段长度为927 bp(图1B),测序获得敲除序列为5’-TT-3’。 另外,用流式细胞术检测纯合型IL2rg-/-大鼠外周血中的T、B 及NK 细胞表达含量(图1C,1D)。 结果发现,与WT 大鼠相比,IL2rg-/-大鼠的T 细胞、B 细胞、NK 细胞、及NKT细胞含量均显著性降低(P<0.01)。 以上结果表明,IL2rg基因敲除成功,IL2rg-/-大鼠表型符合预期,可以用于后续实验。
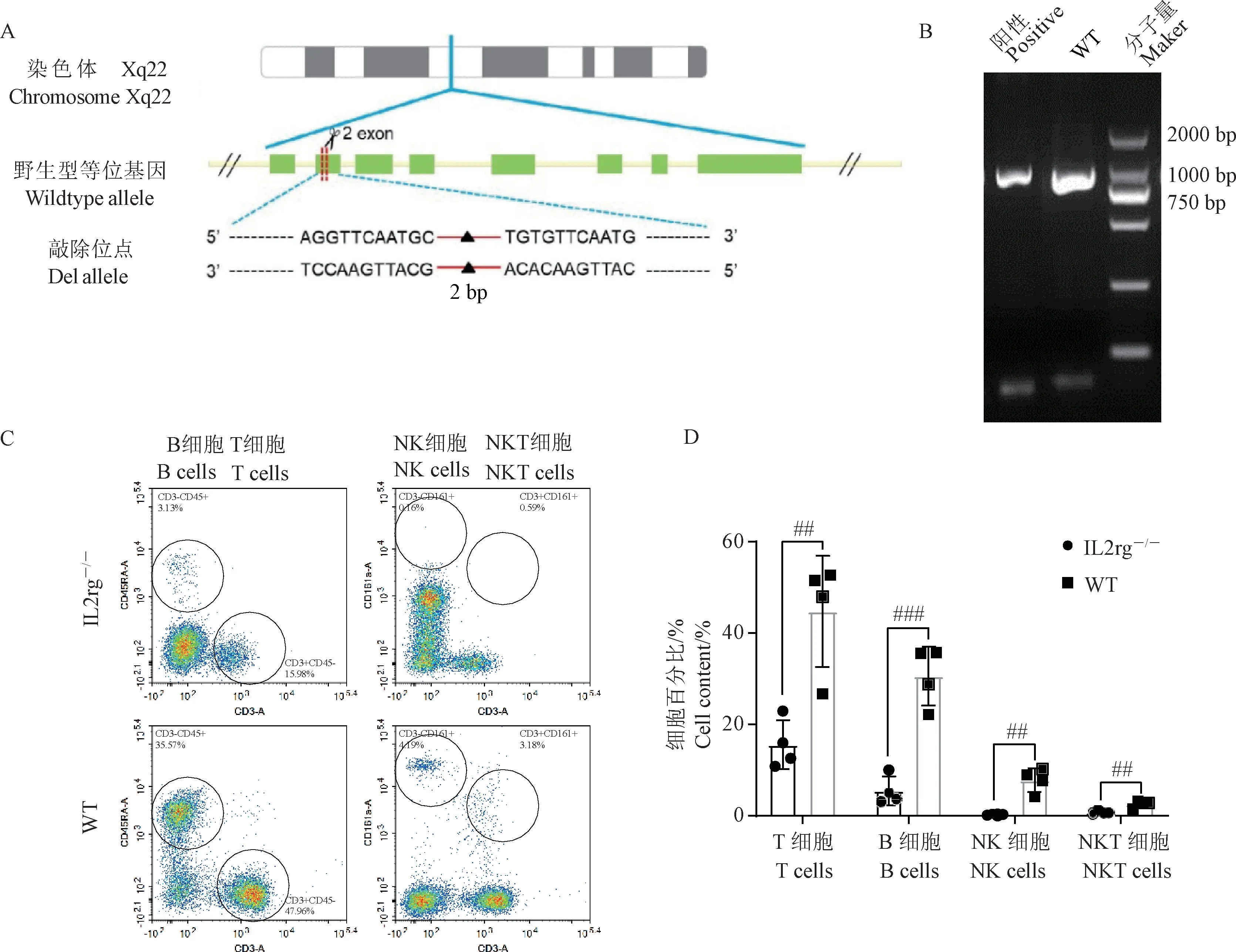
图1 构建敲除IL2rg 基因的IL2rg-/-大鼠(n =4)Note. A. Site of IL2rg gene knockout in rats. B. Genotype identification of IL2rg-/- rats by PCR. C. Flow cytometry test analysis of T,B,NK and NKT cells in the peripheral blood of WT rats and IL2rg-/- rats. D. Flow cytometry test analysis of T, B, NK and NKT cells in the peripheral blood of IL2rg-/- rats. Compared with WT rats, ##P <0.01, ###P <0.001.Figure 1 Construction of IL2rg-/- rats with IL2rg gene knockout(n =4)
2.2 建立IL2rg-/-大鼠hRSV 感染模型
将大鼠麻醉后经滴鼻途径感染hRSV,观察其临床特征和病理改变,并检测部分脏器中的病毒载量,血清细胞因子等参数,用以建立hRSV 的IL2rg-/-大鼠感染模型。 在35 d 观察期间内,未发现IL2rg-/-大鼠的明显临床症状。 其体重与WT 大鼠无显著性差异(P>0.05)(图2A),也未出现体温升高(图2B)。
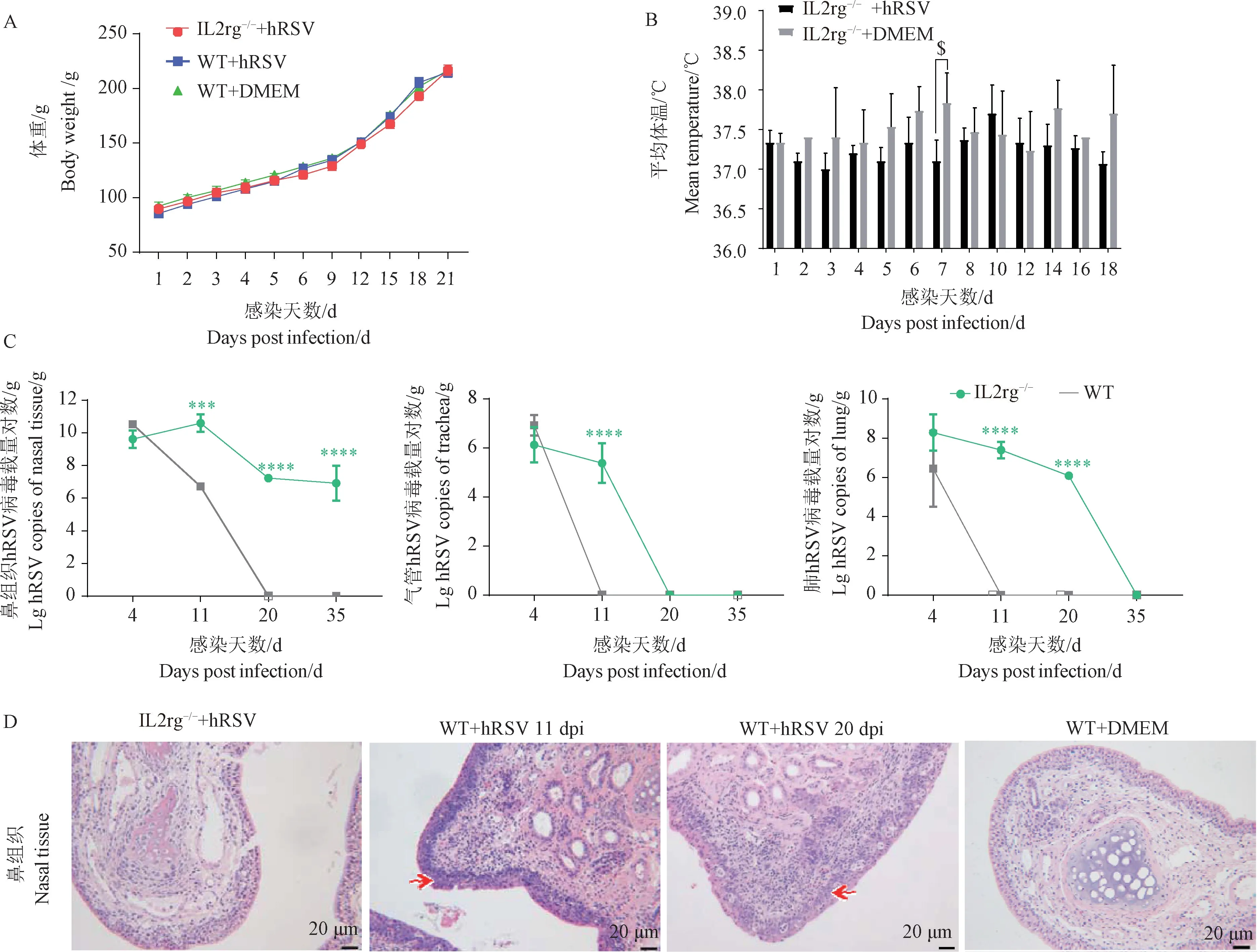
图2 构建IL2rg-/-大鼠的hRSV 感染模型Note. A. Body weight of IL2rg-/- rats and WT rats. B. Rectal temperature of IL2rg-/- rats with hRSV(n =5). C. Total hRSV copies in the target organs of IL2rg-/-(n =12) according to RT-qPCR. D. Respiratory histopathology of IL2rg-/- rats and WT rats,degeneration and necrosis of transitional epithelium and inflammatory cell infiltration(red arrows)observed in the nasal cavity of WT rats after hRSV infection.Compared with IL2rg-/- rats with DMEM group(n = 5), $P <0.05. Compared with WT rats(n = 12), ∗∗∗P <0.001, ∗∗∗∗P<0.0001.Figure 2 Construction of an hRSV infection model using IL2rg-/- rats
用RT-qPCR 法检测大鼠呼吸道各组织的病毒载量(图2C)。 hRSV 感染IL2rg-/-大鼠后,鼻组织中的病毒载量在11 dpi 达到峰值1 × 1010copies/g 组织;在35 dpi 时,病毒载量仍维持1 × 107copies/g。而在IL2rg-/-大鼠气管和肺组织中,病毒载量随hRSV 感染时间延长呈下降趋势,高拷贝数的病毒载量维持时间短,但在气管组织中,病毒复制维持到11 dpi 左右,肺组织中,维持在20 dpi 以上。 WT大鼠呼吸道各组织的病毒载量下降迅速,在感染中期均被清除。
hRSV 感染的IL2rg-/-大鼠其鼻、气管和肺组织未见炎症细胞浸润, 组织结构完整, 攻毒组和DMEM 对照组情况一致, 无明显病变(图2D)。 WT大鼠鼻组织中,偶见极轻度病理改变,在11 dpi 和20 dpi 时,WT 大鼠鼻组织移行上皮细胞和呼吸上皮细胞出现变性坏死,并伴炎性细胞浸润。
2.3 hRSV 感染IL2rg-/-大鼠引起的免疫反应
用流式细胞术分析IL2rg-/-大鼠感染hRSV 过程中免疫细胞群的变化,结果如图3 所示。 IL2rg-/-大鼠感染hRSV 感染后,外周血T 细胞含量基本维持不变(P>0.05),而4 dpi 的B 细胞含量有上升,达到19.84%,随后下降。 NK 细胞和NKT 维持在极低水平,且含量较稳定。 而WT 大鼠感染hRSV 后,可见B 细胞含量有上升趋势,但无统计学意义(P>0.05),而在IL2rg-/-大鼠的B 细胞含量明显上升,在4 dpi,其含量增长了近3 倍,在20 dpi 下降到感染前水平。 NK 细胞含量在hRSV 感染后有轻微波动,但无显著性差异(P>0.05)。
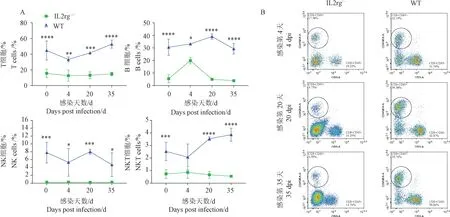
图3 hRSV 感染后IL2rg-/-大鼠的免疫细胞改变(n =12)Note. A. The contents of T, B, NK and NKT cells in IL2rg-/- peripheral blood on various time points following hRSV infection. B. The abundance of B cells in a representative IL2rg-/- rat at 3 time points after infection. Compared with WT rats, ∗P <0.05, ∗∗P <0.01,∗∗∗P <0.001, ∗∗∗∗P <0.0001.Figure 3 Abundance of immune cells in IL2rg-/- rats during hRSV infection(n =12)
感染hRSV 病毒后,IL2rg-/-大鼠血清24 种细胞因子中(图4A),绝大多数WT 大鼠无显著性差异,唯有IL-6 与MCP-1 的含量在病毒感染前后有明显不同(图4B)。

图4 hRSV 感染后IL2rg-/-大鼠的炎症反应Note. A. Heat map of peripheral blood cytokine concentration of IL2rg-/- and WT rats after infection. B. The expression of IL-6,MCP-1 in peripheral blood of IL2rg-/- rats and WT rats after hRSV infection. Compared with each other at different time points within the groups, ∗P<0.05,∗∗∗P <0.001,∗∗∗∗P <0.0001.Figure 4 Inflammatory response in IL2rg-/- rats during hRSV infection
WT 大鼠在感染后的0 dpi、4 dpi 和20 dpi 这3个时间点的IL-6 含量均无显著性差异,IL2rg-/-大鼠的IL-6 含量在4 dpi 明显高于0 dpi 与20 dpi 时的水平。 IL2rg-/-大鼠和WT 大鼠感染hRSV 病毒后,外周血中MCP-1 的变化趋势相同,MCP-1 含量都是先升高后降低,但IL2rg-/-大鼠MCP-1 因子升幅高于WT 大鼠。
3 讨论
为了获得能支持hRSV 病毒感染与复制、重现临床感染症状的动物模型,已经开展了大量的研究[7]。 在环磷酰胺处理,抑制宿主免疫系统的情况下,棉鼠对hRSV 易感性增强。 本文采用TALEN 基因编辑技术敲除SD 大鼠的IL2rg基因,经过筛选传代,获得可连续传代并稳定遗传基因敲除品系。 纯合的IL2rg-/-大鼠的NK 细胞呈功能性失活,导致大鼠固有免疫应答缺陷。 在滴鼻感染hRSV 后,其体重与WT 大鼠相比,减缓不明显,这与现有大多数hRSV 灵长类模型和啮齿类模型相似。
而在本研究中,观察到hRSV 能在IL2rg-/-大鼠的呼吸道靶器官内有效增殖,达到很高的滴度。 虽然IL2rg-/-大鼠下呼吸道中hRSV 病毒载量随感染时间延长而降低,气管内hRSV 病毒仍可维持2 周左右,与WT 大鼠相比,无论是病毒载量还是维持时间,都显示出明显的优势。 与已有免疫功能正常的hRSV 感染小鼠和棉鼠模型相比[14-15],IL2rg-/-大鼠肺组织的病毒载量与感染时间也明显延长至3 周。在前期的工作中,发现hRSV 在T、B 细胞缺陷的小鼠模型中,病毒水平及维持时间均大幅提高[16],这也说明适应性免疫缺陷对hRSV 感染的影响。
IL2rg-/-大鼠的B 细胞在hRSV 感染后早期有明显增殖现象,而T 细胞无变化,说明B 细胞可能在抑制hRSV 复制中发挥了作用,这与小鼠感染后表现出T 细胞终止hRSV 复制的重要作用略有不同[17],大鼠与小鼠的这种差异有待于今后进一步验证。 hRSV 感染IL2rg-/-大鼠后,鼻、气管和肺组织病理改变不典型,没有观察到合胞体形成等细胞病变,后续尚需进一步优化。
较小鼠而言,大鼠模型具有体积大、脏器大的特点,便于取到足量的材料,实验大鼠在神经科学研究、药代药理学研究领域用途广泛。 通过基因敲除技术获得的免疫缺陷动物模型,遗传稳定,重复性好,方便开展研究。 相较于新生小鼠[18]、老龄化棉鼠[19],以及需要控制用量、并长时间环磷酰胺处理制成的免疫缺陷棉鼠模型[20]而言,有突出的优势。 实验中,可以选取常用的3 ~4 周龄大鼠,便于实验安排与实验动物管理。 但是IL2rg-/-大鼠免疫缺陷的特性让其无法用于疫苗效果评价及需要宿主免疫反应的机制研究,这是免疫缺陷动物模型的局限性,同时也是免疫功能正常动物无可取代的优势。 但在如抗病毒药物筛选、抗hRSV 抗体体内效力评价等方面,IL2rg-/-大鼠模型支持hRSV 高水平复制和并长期感染,可以很好的区分药物治疗效果,是评估治疗方法的有用工具。
