辣椒CaDXS 和CaPDS 基因沉默的表型比较*
2024-04-01张金峰刘雅婷
张 鑫,桂 敏,2,刘 弟,张金峰,刘雅婷**
(1.云南农业大学 植物保护学院,云南 昆明 650201;2.云南省农业科学院 园艺作物研究所,云南 昆明 650205;3.云南农业大学 烟草学院,云南 昆明 650201;4.云南农业大学 农学与生物技术学院,云南 昆明 650201)
病毒诱导的基因沉默(virus-induced gene silencing,VIGS)是指携带目标基因1 段cDNA 的重组病毒载体侵染植物后,可诱导植物发生基因沉默而出现表型突变,通过植物表型或生理指标的变化,进一步推测其基因功能的方法[1-2]。辣椒(Capsicum annuumL.)起源于中南美洲热带、亚热带地区,大约在16 世纪后期传入中国。截至2019 年,辣椒在中国的种植面积超过2.26×106hm2,已是目前中国种植面积最广的蔬菜之一。近年来,中国的辣椒总产量超过6.4×107t,平均产量接近3×104kg/hm2,农业产值达2 500 亿元[3],在中国蔬菜作物中占有重要地位。利用VIGS 技术挖掘辣椒在抗逆境(病、虫、非生物胁迫等)、生长发育以及代谢调控中的相关基因,对深入理解病原生物—辣椒相互作用、揭示辣椒品质性状形成机理、病虫害防控、辣椒品种改良等具有重要意义。在VIGS 试验中,往往需要沉默某基因使植株出现白化等明显表型,以初步评估基因沉默效果,这种基因即为沉默标记基因,且以八氢番茄红素脱氢酶(phytoene desaturase,PDS)基因最为常用。PDS 是类胡萝卜素合成途径中的关键酶,催化无色的八氢番茄红素转变成有色的类胡萝卜素[4];而类胡萝卜素在植物中具有光保护作用[5],其合成途径被阻断导致植物光保护功能丧失,引起植株白化。在辣椒中,除PDS基因外,还有核酮糖-1,5-二磷酸羧化酶小亚基基因(ribulose-1,5-bisphosphate carboxylase small-subunit gene,rbcS),沉默后叶片会出现变黄和褪绿[6];在拟南芥(Arabidopsis thaliana)中,Chlorata42基因沉默10~12 d 后叶片变黄[7];在矮牵牛(Petunia bybrida)中,查尔酮合酶(chalcone synthase,CHS)基因沉默1 个月后,纯色牵牛花变为杂色花[8]。寻找新的辣椒沉默标记基因,对于辣椒VIGS 技术的补充、完善以及辣椒基因功能的研究具有重要意义。
自1995 年KUMAGAI 等[9]首次利用重组烟草花叶病毒(Tobacco mosaic virus,TMV)在本氏烟(Nicotiana benthamiana)中成功沉默PDS基因以来,越来越多的病毒沉默载体被运用到VIGS技术中,包括马铃薯X 病毒(Potato virus X,PVX)[10]、番茄金色花叶病毒 (Tomato golden mosaic virus,TGMV)[11]、烟草脆裂病毒 (Tobacco rattle virus,TRV)[12]、大麦条纹花叶病毒 (Barley stripe mosaic virus,BMSV)[13]等。RATCLIFF 等[12]研究发现:相较于PVX 沉默载体,TRV 沉默载体引起的病毒侵染症状更轻,能够在植物更多的组织中发挥沉默作用,且持续时间更长,沉默效率更高,其原因可能是TRV 沉默载体能够侵入植物的生长点。相较于其他病毒沉默载体,TRV沉默载体寄主广泛[14],已被广泛运用于验证植物基因功能的科学研究中。
在高等植物中,作为类胡萝卜素前体物质的异戊烯基焦磷酸(isopentenyl pyrophosphate,IPP)主要通过甲基赤藓糖醇(methylerythritol phosphate,MEP)途径合成。在MEP 途径中,首先由1-脱氧木酮糖-5-磷酸合酶(1-deoxy-D-xylulose-5-phosphate synthase,DXS)催化3-磷酸甘油醛和丙酮酸缩合形成1-脱氧木酮糖-5-磷酸(1-deoxy-Dxylulose-5-phosphate,DXP),之后经过一系列的酶促反应最终生成IPP[15]。而DXS 是MEP 生物合成途径中的第1 个关键酶[16],关键酶又被称为限速酶,决定总反应的速度和方向,沉默关键酶基因可能会对代谢过程产生更大的影响。
目前,TRV 介导的VIGS 体系已经成功沉默CaPDS基因并使辣椒植株出现明显的白化[6,17]。如果沉默CaDXS基因,阻断类胡萝卜素前体IPP的生成,进而降低辣椒类胡萝卜素的含量,辣椒同样可能产生白化表型。但利用TRV 沉默体系沉默CaDXS基因,辣椒能否出现白化以及与沉默CaPDS基因的辣椒表型有何区别还未见报道。本研究应用TRV 诱导的基因沉默技术,分别沉默辣椒的CaPDS和CaDXS基因,比较分析沉默CaPDS和CaDXS基因的辣椒表型,评估CaDXS基因作为辣椒沉默标记基因的潜力并验证Ca-DXS基因在辣椒类胡萝卜素合成过程中的功能,为寻找新的辣椒沉默标记基因和VIGS 技术的完善提供参考。
1 材料与方法
1.1 试验材料
本研究供试辣椒品种为萧新19 号,购自安徽萧新种业有限公司,其生长条件为23 ℃光照16 h,21 ℃黑暗8 h。
大肠杆菌感受态细胞(Trans1-T1 Phage Resistant Chemically Competent Cell,目录号:CD-501)购自北京全式金生物技术 (TransGen Biotech)股份有限公司;根癌农杆菌(Agrobacterium tumefaciens) GV3101 感受态细胞(GV3101 Chemically Competent Cell,目录号:AC1001)购自上海唯地生物技术有限公司。病毒载体pTRV1 和pTRV2均由云南农业大学植物保护学院陈小姣惠赠;pTRV2-CaPDS 由刘雅婷教授课题组构建。含有上述3 种载体的根癌农杆菌GV3101 菌株均保存于云南农业大学作物种质创新及可持续利用重点实验室。
1.2 试验方法
1.2.1 RNA 提取及cDNA 第1 条链的合成
采用TRNzol Universal 总RNA 提取试剂[ 天根生化科技(北京)有限公司 ]提取萧新19 号辣椒的总RNA;提取完成后,用无酶水溶解,-70 ℃冻存备用。用HiScript II 1st Strand cDNA Synthesis 反转录试剂盒(南京诺唯赞生物科技股份有限公司)将辣椒的总RNA 反转录为cDNA,用无酶水溶解,-20 ℃冻存备用。
1.2.2 辣椒DXS基因沉默片段的PCR 扩增
根据NCBI (https://www.ncbi.nlm.nih.gov/)已公布的辣椒DXS基因mRNA 序列(GenBank 登录号:NM_001398343.1),利用Solanaceae Genomics Network (https://solgenomics.net/)的VIGS Tool (https://vigs.solgenomics.net/)[18]分析确定该基因的最佳沉默片段范围;利用NCBI 在线引物设计工具Primer-BLAST (https://www.ncbi.nlm.nih.gov/tools/primer-blast/index.cgi),在最佳沉默片段的范围设计引物(表1)并添加酶切位点和保护碱基。以辣椒的cDNA为模板,用高保真PCR 酶(南京诺唯赞生物科技股份有限公司,2×Phanta Flash Master Mix Dye Plus)进行PCR 反应扩增CaDXS基因沉默片段。PCR 反应程序为:98 ℃预变性30 s;98 ℃变性10 s,59 ℃退火5 s,72 ℃延伸2 s,34 个循环;72 ℃延伸1 min。PCR 反应结束后,产物于-20 ℃保存。所有引物的合成和DNA 序列的测定由生工生物工程(上海)股份有限公司完成。

表1 本研究使用的引物Tab.1 Primers used in this study
1.2.3CaDXS基因沉默载体的构建和转化
扩增CaDXS基因沉默片段的PCR 产物经电泳检测后,用SteadyPure PCR 反应液纯化试剂盒(艾科瑞生物工程有限公司)对CaDXS基因的沉默片段进行纯化回收。采用New England Biolabs 公司的限制性核酸内切酶EcoRI-HF®和KpnIHF®双酶切pTRV2 质粒载体和CaDXS基因沉默片段,回收纯化酶切产物。采用DNA 连接试剂盒Ver.2.1 (宝日医生物技术有限公司)连接双酶切的pTRV2 质粒载体和CaDXS基因沉默片段,并将连接产物转化至大肠杆菌感受态细胞[19]。挑取阳性单克隆,经菌落PCR 检测后测序鉴定PCR产物,测序验证正确的单克隆进行菌落液体振荡培养,-70 ℃保存备用并提取重组沉默载体pTRV2-CaDXS;沉默载体转化至根癌农杆菌GV3101 感受态细胞中,-70 ℃保存备用[20]。
1.2.4 农杆菌的准备和注射
将携带pTRV1、pTRV2、pTRV2-CaPDS 和pTRV2-CaDXS 载体的根癌农杆菌GV3101 菌液在YEB 液体培养基(50 μg/mL 卡那霉素和50 μg/mL利福平)中28 ℃、180 r/min 振荡培养12 h;以转速3 000 r/min 离心5 min,弃上清液,加入农杆菌浸润缓冲液[21](10 mmol/L MES、10 mmol/L MgCl2和200 μmol/L 乙酰丁香酮)重新悬浮菌体,调整菌液浓度至OD600值为0.8。将携带pTRV1 载体的农杆菌与携带pTRV2、pTRV2-CaPDS、pTRV2-CaDXS 载体的农杆菌分别按体积比1∶1 混合,置于28 ℃恒温培养箱避光静置3 h。用注射器针头轻划辣椒叶片背面,去掉针头后将菌液注入辣椒第1、2 片真叶,并设置3 个处理。①TRV:注射TRV1 和TRV2 沉默空载的植株对照组;② TRV-CaDXS:注射TRV1和TRV2-CaDXS 的植株处理组;③TRV-CaPDS:注射TRV1 和TRV2-CaPDS 的植株处理组。注射菌液后的辣椒植株置于23 ℃避光处理12 h,再置于23 ℃光照16 h、21 ℃黑暗8 h 的植物光照培养箱中培养。
1.2.5 实时荧光定量PCR 检测CaDXS基因和CaPDS基因的沉默效率
当TRV-CaDXS 和TRV-CaPDS 处理组的叶片出现白化后,分别从处理组和注射沉默空载的对照组各取3 株辣椒的第5、6 片真叶,提取RNA 作为3 个生物学重复,反转录为cDNA。荧光定量PCR 的每个生物学重复针对内参基因、CaDXS基因和CaPDS基因进行4 个技术重复。反转录(HiScript®III All-in-one RT SuperMix Perfect for qPCR)和qPCR 试剂(TaqPro Universal SYBR qPCR Master Mix)均购自南京诺唯赞生物科技股份有限公司。以辣椒泛素结合蛋白(ubiquitin-conjugating protein,UBI-3)基因作为内参基因[22],所用引物序列见表1,在ABI 7500 荧光定量PCR 仪上进行实时荧光定量PCR 反应。采用2-ΔΔCt法[23]计算CaDXS和CaPDS基因的相对表达量,并用GraphPad Prism 8 作图。
2 结果与分析
2.1 CaDXS 基因沉默片段的扩增
辣椒DXS基因沉默片段的PCR 扩增获得单一清晰的目的条带,片段为389 bp,与预期大小一致(图1)。
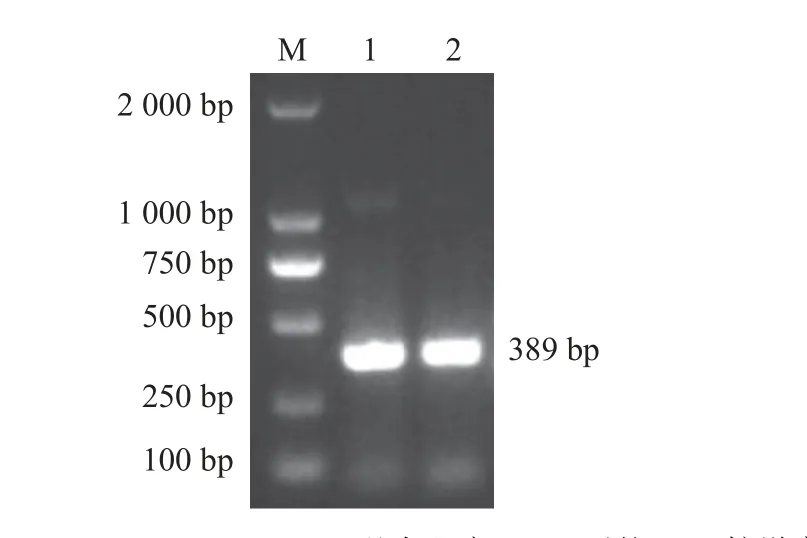
图1 CaDXS 基因沉默片段的PCR 扩增产物Fig.1 PCR amplification product of silencing fragment of CaDXS gene
2.2 沉默CaPDS 和CaDXS 基因的辣椒叶片表型
农杆菌注射到辣椒叶片10 d 后,注射叶叶柄断裂。注射21 d 后,TRV 处理的辣椒植株叶片未白化;沉默CaPDS基因的辣椒第5、6 片真叶靠近叶柄处的局部开始出现白化现象;沉默Ca-DXS基因的辣椒第5、6 片真叶开始出现褪绿现象。注射约30 d,沉默CaDXS基因的辣椒叶片也逐渐出现明显的白化(图2a);沉默CaPDS基因的辣椒叶片,其白化面积从靠近叶柄处逐渐蔓延扩大(图2b)。注射33 d,沉默CaPDS基因的辣椒新生叶几乎白化,第5、6 片真叶大部分白化,局部有绿色;沉默CaDXS基因的辣椒第5、6 片真叶出现明显且均匀的白化(图2c)。沉默Ca-PDS和CaDXS基因的辣椒均有4 株白化;相较于沉默CaPDS基因,沉默CaDXS基因的辣椒约晚9 d 出现白化,白化程度不够彻底;TRV 处理的辣椒植株叶片则始终未出现白化,且沉默CaPDS和CaDXS基因的辣椒植株相较于TRV 处理的辣椒植株偏小(图2c)。

图2 沉默CaPDS 和CaDXS 基因的辣椒叶片表型Fig.2 Phenotypes of the leaves of chili pepper plants by CaPDS and CaDXS gene silenced
2.3 CaDXS 和CaPDS 基因的沉默效率
CaDXS基因在沉默辣椒中的表达量显著低于对照组(P<0.05),沉默效率为86.80%;CaPDS基因在沉默辣椒中的表达量极显著低于对照组(P<0.001),沉默效率为93.08% (图3)。

图3 处理组和对照组CaDXS 和CaPDS基因的相对表达水平Fig.3 Relative expression levels of CaDXS and CaPDS gene in treated group and control group
3 讨论
辣椒表型观察和实时荧光定量PCR 结果表明:CaDXS和CaPDS基因均被成功沉默。李杰等[24]使用TRV 沉默载体分别沉默辣椒番茄红素β-环化酶(lycopene β-cyclase,Lcyb)基因、芸薹素唑耐受因子1 (brassinazole-resistant 1,BZR1)基因和CaPDS基因,结果表明:CaPDS、CaLcyb和CaBZR1基因表达量均显著降低,且沉默组辣椒叶片的类胡萝卜素含量显著低于正常对照植株;在沉默组中,类胡萝卜素含量从低到高依次为沉默CaPDS、CaLcyb、CaBZR1基因的辣椒;观察沉默21 d 后的表型,沉默CaPDS基因的叶片出现白化,沉默CaLcyb基因的叶片颜色变浅,沉默CaBZR1基因的植株生长受到抑制,表明类胡萝卜素含量越低,叶片颜色变化越明显。已报道的沉默标记基因通过阻断类胡萝卜素或叶绿素的合成影响叶色,通过阻断与花色形成密切相关的类黄酮等物质合成影响花色。
本研究沉默的2 个基因和沉默拟南芥Chlorata42基因的共同点是改变叶色,但不同点在于本研究的2 个沉默标记基因处于类胡萝卜素合成途径,拟南芥Chlorata42基因处于叶绿素合成途径。沉默Chlorata42基因的拟南芥叶片出现黄化,其原因可能是沉默基因阻碍镁螯合酶复合物的形成,进而减弱叶绿素的合成[25-26]。TURNAGE等[25]和BURCH-SMITH 等[7]先后利用甘蓝曲叶病毒(Cabbage leaf curl virus,CbLCV)沉默载体和TRV 沉默载体沉默拟南芥Chlorata42基因,Cb-LCV 沉默载体诱导的拟南芥新叶在沉默21~28 d后黄化,而TRV 沉默载体诱导的新叶在沉默10~12 d 后黄化。
与改变叶色的沉默标记基因不同,沉默CHS基因改变的是花色。沉默CHS基因的植株呈现花色变白的现象,可能是阻碍了对花色形成起主要作用的类黄酮物质(如花青素)的生物合成[27-29]。TRV 沉默载体沉默毛花猕猴桃(Actinidia eriantha)红色花瓣中的AeCHS基因,约20 d 出现花瓣漂白现象,花青素含量显著降低[30]。利用改良的中国番茄黄化曲叶病毒(Tomato yellow leaf curl China virus,TYLCCNV) 卫星DNA 沉默载体沉默矮牵牛PbCHS基因,1 个月后纯色牵牛花变为杂色花[8]。因此,利用VIGS 技术研究基因功能时,应考虑基因表达的组织特异性。
沉默rbcS基因的植株出现变黄和褪绿可能是由于沉默该基因导致核酮糖-1,5-二磷酸羧化酶/加氧酶(Ribulose-1,5-bisphosphate carboxylase/oxygenase,Rubisco)全酶成分的缺乏。rbcS基因编码稳定Rubisco 全酶结构所必需的小亚基[31],而Rubisco 是植物光合作用反应固定CO2的关键酶并参与光呼吸途径[32]。研究表明:烟草rbcS 反义突变体AL5 中的Rubisco 含量仅为正常烟草的20%,总叶绿素和类胡萝卜素的含量也仅为正常烟草的50%[33];也有研究表明:TRV 载体沉默本氏烟的rbcS基因后,Rubisco 大、小亚基含量均显著降低,总叶绿素和类胡萝卜素含量也显著降低,叶片变黄[34]。以上研究表明:rbcS含量的降低导致Rubisco 含量降低,但Rubisco 含量降低的植株中总叶绿素和类胡萝卜素含量也降低的机制尚不清楚。
本研究表明:沉默CaDXS基因的辣椒出现明显白化的时间晚于沉默CaPDS基因的辣椒。分析其原因可能是沉默CaDXS基因导致DXP 减少,该物质减少造成的影响在生物合成途径中逐级传递至类胡萝卜素。CaDXS处于类胡萝卜素生物合成途径的上游,CaPDS基因处于下游,沉默Ca-DXS基因后,需要更长的时间才能将DXP 减少的影响传递至类胡萝卜素,故沉默CaDXS基因的辣椒出现明显白化的时间较晚。相较于沉默Ca-PDS基因的辣椒,沉默CaDXS基因的辣椒白化不够彻底可能与生物合成途径中的代谢调节有关。沉默较上游的CaDXS基因可能导致更多种类胡萝卜素前体减少,但辣椒细胞可能通过调整更多的代谢途径增加对类胡萝卜素各种前体的合成,以减缓类胡萝卜素生物合成的受影响程度。
4 结论
本研究成功构建了TRV 介导的CaDXS基因沉默载体。CaDXS基因沉默后出现白化现象,说明该基因可作为辣椒基因沉默试验候选的标记基因,扩大了辣椒沉默标记基因的范围,为丰富辣椒沉默标记基因提供了参考。相较于沉默Ca-DXS基因的辣椒,沉默CaPDS基因的辣椒植株白化表型出现得更早且明显,因此CaPDS基因比CaDXS基因更合适作为辣椒沉默的标记基因。
