心脏术后相关急性肾损伤早期生物标志物研究进展
2024-03-30王添未唐程斌于海龙
王添未, 唐程斌, 蒋 伟, 于海龙, 邵 俊, 袁 静
(1. 扬州大学医学院, 江苏 扬州, 225001; 扬州大学临床医学院/扬州大学附属苏北人民医院,2. 心脏大血管病中心心脏重症监护病房, 3. 心脏大血管病中心,4. 重症医学科, 5. 神经内科, 6. 功能检查科, 江苏 扬州, 225001)
急性肾损伤是危重症患者常见的并发症,心脏手术是继脓毒症之后最主要的发病病因,全世界每年有超过2百万台心脏手术,心脏术后相关急性肾损伤(CSA-AKI)的发病率为5%~42%[1]。相较于不发生急性肾损伤(AKI)的患者,发生严重AKI患者的围术期病死率增加3~8倍[2]。CSA-AKI还会增加患者的远期死亡风险,有报道[3]称, CSA-AKI患者的5年和7年存活率分别仅为54%和38%。此外, CSA-AKI的治疗费用十分昂贵。未进行肾脏替代治疗的AKI患者住院费用高达2.6万美元,而进行肾脏替代治疗的患者甚至超过6.9万美元[4], 这无疑给个人和社会增加了巨大经济负担,因此心脏术后所致AKI的早期诊断、早期治疗是改善患者预后、减少经济负担的关键。但目前对AKI的诊断与分级标准都以肌酐与尿量为指标,其受到多种因素影响以及存在滞后性,对判断早期肾损伤具有一定的局限性[5], 寻求更加敏感、特异度强的CSA-AKI生物标志物是目前亟待解决的难题之一。近年来,医学界为寻求更加敏感的CSA-AKI早期生物标志物进行了大量研究,本文将探讨CSA-AKI的相关生物标志物的研究进展,以为临床预防和减少CSA-AKI发病率提供依据。
1 CSA-AKI的病理生理学
CSA-AKI的病理生理学机制仍未完全阐明,目前认为CSA-AKI的发展可能涉及以下几种主要的损伤途径,包括灌注不足、缺血再灌注损伤以及引发的炎症与氧化应激等因素(图1)[6]。
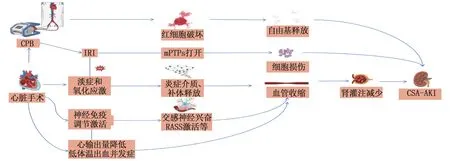
CPB: 体外循坏; IRI: 缺血再灌注损伤; mPTPs: 线粒体通透性转换孔; CSA-AKI: 心脏手术相关急性肾损伤;ROS: 活性氧; RASS: 肾素-血管紧张素-醛固酮系统。
1.1 肾灌注不足与缺血再灌注损伤
肾脏低灌注通常是CSA-AKI的首发因素,这往往是由心输出量的降低或低血压引起的。在这种情况下,神经免疫调节会被激活,导致全身血管收缩,肾血流量因此减少,长时间的肾脏缺血会导致肾小管损伤,肾小管上皮细胞破坏,进而导致肾小管功能障碍,最终导致肾损伤[7]。除了灌注不足,围术期高静脉压被认为是CSA-AKI的另一个血流动力学决定因素,这可能是静脉淤血增加了肾血管阻力,进而影响肾脏灌注来介导AKI发生的[8]。
虽然体外循环(CPB)能一定程度上改善肾脏灌注,但同时CPB也可能会导致肾脏的缺血再灌注损伤(IRI),并可能进一步导致肾脏中线粒体通透性转换孔(mPTPs) 的打开[9], 调节线粒体自噬[10], 最终导致AKI。IRI也会增加活性氧(ROS)的产生, ROS会通过激活促炎转录因子核因子-κB(NF-κB)等进一步加剧细胞功能障碍和肾损伤[10]。
1.2 炎症和氧化应激
在心脏手术期间,血液成分与CPB回路表面接触、IRI和氧化损伤等,均会诱导全身性的炎症反应发生[11]。炎症反应主要通过血管内皮和免疫系统的激活以及促炎细胞因子的释放和募集来介导肾小管损伤[12]。缺血导致的内皮细胞受损会引起组织炎症[13], 从而募集白细胞黏附于内皮细胞并进一步加剧内皮损伤,进而引发一系列炎症反应[14]。这种炎症级联反应最终导致肾内皮一氧化氮系统功能障碍,而后者在肾氧输送中发挥着关键作用[15]。同时,炎症期间激活的中性粒细胞、巨噬细胞和淋巴细胞会迁移至肾实质并加剧肾损伤,从而促进AKI[16]。
CPB导致的氧化应激是CSA-AKI发生的一大原因,其主要机制是CPB 使血液成分受到剪应力,导致红细胞裂解并释放游离血红蛋白和铁,从而诱发氧化应激[17]。 积累的游离铁不仅会促进组织损伤,还会诱导肾小管上皮细胞发生多种变化,例如细胞增殖受损、诱导脂质过氧化和蛋白质氧化等,最终导致AKI的发生[18]。
2 CSA-AKI相关生物标志物
目前AKI的诊断是根据AKI临床实践指南(KDIGO标准)进行的, KDIGO标准将AKI定义为: ① 48 h内肌酐升高≥26.5 μmol/L(0.3 mg/dL); ② 或7 d内肌酐较基线值升高1.5~2.0倍; ③ 或尿量<0.5 mL/(kg·h), 持续6 h以上[19]。
KDIGO标准诊断AKI主要依靠的是肌酐和尿量指标,但是肌酐容易受到年龄、性别以及蛋白质摄入量的影响,而尿量也容易受到病理因素、利尿剂等的影响,所以KDIGO标准对CSA-AKI早期诊断与预测有一定局限性,此外该诊断标准还存在滞后性[5]。因此,迫切需要一些新的更敏感及更特异的生物标志物去早期识别并干预CSA-AKI的发生发展,从而降低病死率,并降低医疗花费。CSA-AKI相关生物标志物见表1-1、表1-2。

表1-1 CSA-AKI生物标志物的特征比较
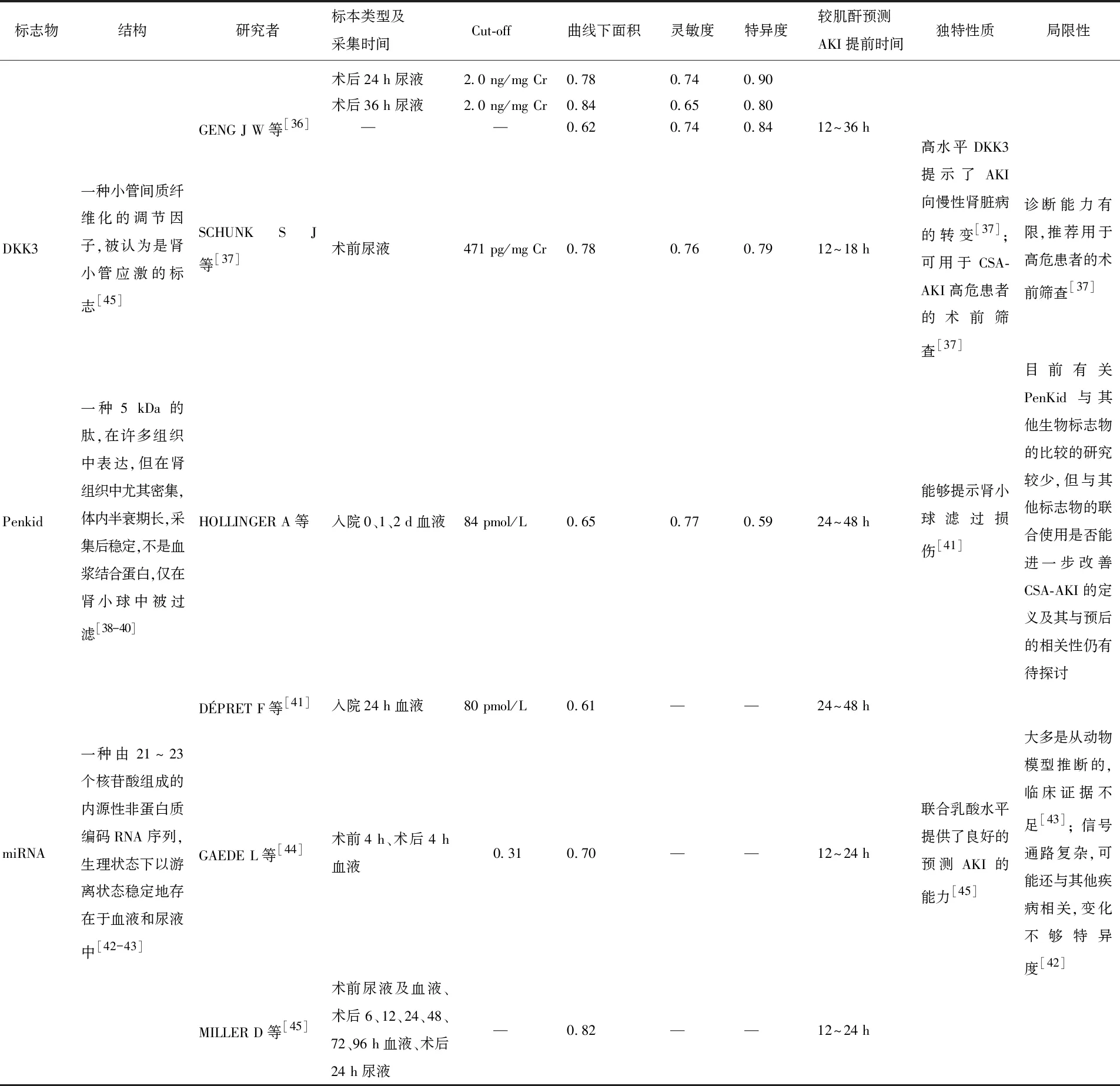
表1-2 CSA-AKI生物标志物的特征比较
2.1 中性粒细胞明胶酶相关脂质运载蛋白(NGAL)
NGAL是一种25 kDa的小蛋白,含有178个氨基酸[46]。NGAL由中性粒细胞产生,通过肾小球自由过滤,然后被近端小管完全重吸收[20]。NGAL通过免疫调节、炎症和肿瘤转化减少肾小管细胞凋亡并增加细胞增殖[21], 在肾缺血中发挥着重要的生理作用。
NGAL在心脏术后AKI的早期检测方面表现出良好的检验效能,被认为是肾脏的“肌钙蛋白”[47]。在纳入了71例接受心脏手术并进行体外循环的儿童研究中,分析NGAL对CSA-AKI的检验效能,结果显示,在CPB开始后仅2 h尿NGAL开始增加,曲线下面积(AUC)为0.99,灵敏度为1.00, 特异度为0.98[22]。MORIYAMA T等[25]研究也证实了这一点,研究显示, AKI组和非AKI组术后3 h尿NGAL水平分别为(950.5±827.9)和(430.0±250.6) μg/g(P<0.05),AUC为0.87, 具有良好的检验效能。此外, SLAGLE C L等[26]发现,在手术后发生AKI的新生儿中,其术后24 h尿液NGAL水平相较于其术前尿液NGAL水平增加了近200%, 而未发生AKI的新生儿增加小于1%, 24 h尿NGAL的AUC为0.79。除了在儿童患者中有着良好的检验效能,在成人患者中NGAL也拥有着优秀的早期识别CSA-AKI的能力。在MISHRA J等[22]的报道中也得到了证实,该研究显示在血清肌酐检测到AKI前48 h, 尿NGAL便可早期诊断AKI。同样,在CASAS-APARICIO G等[40]对重症监护室(ICU)患者的10项研究的汇总数据分析中发现,高尿NGAL水平也与不良结果相关,即使此时的血肌酐水平还未达到诊断标准。此外,心脏手术相关的中性粒细胞明胶酶相关脂质运载蛋白评分(CSA-NGAL)可以通过基线测量来辅助进行术前风险评估,评分值升高能够提示手术推迟,以便能够在患者肾功能恢复前最大程度地避免不必要的损害[23]。因此, CSA-NGAL评分可用于心脏手术患者的术前检查,以早期识别亚临床AKI并采取相关干预措施以防止进一步损伤[48]。
在实际临床应用中, NGAL除了能预测CPB所致的急性肾损伤外,对造影剂引起的严重急性肾损伤(CI-AKI)也有很好的预测效能。据XIAOLI L等报道[49], 在经皮冠状动脉介入治疗(PCI)术后血浆NGAL水平立即升高, 8 h后达到峰值,并持续24 h, 值得注意的是,该研究中NGAL水平与血清肌酐水平呈正相关,作者在检测灵敏度、特异度和受试者工作特征(ROC)曲线后,最终建议将NGAL作为CI-AKI的诊断标志物。NGAL对于患有不同程度充血性心力衰竭的老年患者也有良好的诊断作用。BOLIGNANO D等[50]研究结果表明,与对照组相比,心力衰竭患者的NGAL水平升高(P=0.000 1)。在这项研究中,最高的NGAL水平出现在最严重的IV级心力衰竭患者中,说明NGAL水平预示着患者疾病的临床严重程度。此外, NGAL还能预测心力衰竭患者的病死率,在作者2年的随访中发现,当患者NGAL高于基线783 ng/mL时,死亡危险比为4.08(95%CI: 1.29~12.96)[50]。此外, NGAL对于严重创伤、脓毒症、器官移植等原因所致的AKI也有良好的预测能力[51-52], 总之NGAL的临床应用主要局限在对各种原因导致的AKI的早期诊断上。
虽然NGAL的诊断能力具有较高的灵敏度和特异度,但其检测能力会受到其他物质的干扰,正如SKRYPNYK N I等[24]所报道的,单独的白细胞介素-6(IL-6)可以在没有AKI的情况下增加血浆和尿液NGAL, 从而使其在任何炎症过程中的特异度降低。此外,患者在心脏手术后经常会根据需要服用利尿剂、血管紧张素转换酶抑制剂和抗生素,这可能也会使得NGAL特异度降低[48]。在另一项队列研究[40]中, NGAL≥45 ng/mL的患者发生AKI的时间明显短于那些<45 ng/mL的患者,但入院时的NGAL并不能作为发生AKI的危险因素,并且在第7天的NGAL水平的灵敏度明显好于整个住院期间其他时间段的NGAL,这意味着NGAL预测AKI的时间窗有限,并且更高水平的NGAL阈值似乎更有助于预测AKI的进展而不是AKI的发作。总之,由于NGAL阈值仍有争议,仍需要更多研究来优化NGAL在早期识别CSA-AKI中的应用。
2.2 尿基质金属蛋白酶组织抑制剂-2(TIMP-2)和尿胰岛素样生长因子结合蛋白-7(IGFBP-7)
TIMP-2和IGFBP-7是在细胞应激或损伤期间由肾小管细胞表达和分泌的蛋白质。肾小管上皮细胞在细胞周期G0期处于静止状态,很少增殖[27]。当应激或损伤时, TIMP-2与IGFBP-7表达显著增加,从而在细胞周期G1期发挥作用,促进炎症发生和细胞凋亡,从而阻止肾小管细胞进入消耗大量能量的细胞分裂周期[27]。
作为最有潜力的标志物,[TIMP-2]×[IGFBP-7]表现出良好的检验效能和早期预测的能力。MEERSCH M等[27]研究表明,[TIMP-2]×[IGFBP-7]在体外循环后2 h内即可识别出AKI,AUC为0.84, 而依赖于Scr的诊断标准通常需要在接受CPB后3 d才能识别出AKI。一项包括8项研究共552例心脏手术患者的系统综述和Meta分析[53]也报告了[TIMP-2]×[IGFBP-7]在CSA-AKI检测中的可靠表现,其汇总灵敏度为0.79(95%CI: 0.71~0.86,I2=74.2%), 特异度为0.76(95%CI: 0.72~0.80,I2=80.8%),AUC为0.868。CUMMINGS J J等[30]研究还发现[TIMP-2]×[IGFBP-7]有着较强的远期预测能力,其研究表明,术中[TIMP-2]×[IGFBP-7]水平每增加10倍,患者发生2期或3期AKI的概率就会增加290%(P=0.01)。但并非所有研究都报道了[TIMP-2]×[IGFBP-7]的良好的预测能力。在GRIESHABER P等[28]研究中,对613例接受心脏手术的患者进行了队列研究,结果显示,[TIMP-2]×[IGFBP-7]仅能预测术后24 h早期AKI的发生(AUC为0.63,P=0.017), 而不能预测术后第6天及其以后的2~3期AKI的发生率(AUC=0.58,P=0.26)。
迄今为止,该生物标志物临床应用主要是早期识别有可能发生AKI的高危人群,并进行相应的肾保护干预。正如一项单中心随机对照试验[54]报道的那样,该实验旨在使用生物标志物导向的不同护理措施减少成人非心脏大手术后的术后AKI的发生率。在这项试验中,尿液[TIMP-2]×[IGFBP-7]水平超过0.3 (ng/mL)2/1 000的患者被随机分配至常规护理组或KDIGO集束化护理组,结果显示,通过集束化干预, AKI的发生率从48%下降到了27%[54]。另外一项单中心随机对照研究[55]中,研究人员将心脏术后4 h尿液[TIMP-2]×[IGFBP-7]水平的成人心脏手术患者随机分配,进行常规护理或KDIGO集束化护理,同样发现干预组的AKI发病率显著降低。
以上结果表明,[TIMP-2]×[IGFBP-7]具有强大的诊断能力,正因如此,美国食品和药物管理局(FDA)已经批准[TIMP-2]×[IGFBP-7]用于预测危重症成人12 h内的AKI[56], 但这并非意味着该生物标志物没有局限性。当尿白蛋白>125 mg/dL时会干扰检测结果,而当尿蛋白浓度>3 g/dL会使结果无效,尿胆红素浓度>7.2 g/dL也会在一定程度上影响结果的准确性[57]。[TIMP-2]×[IGFBP-7]缺乏统一的诊断阈值以及时间节点,仍需要更多的试验来研究该生物标志物在预防工作和干预试验中的功能,以提高其在增强CSA-AKI预测结果方面的能力。尽管如此,[TIMP-2]×[IGFBP-7]的批准应用是为研究一种可靠、准确的识别早期肾损伤的方法而向前迈出的重要一步。
2.3 肝型脂肪酸结合蛋白(L-FABP)
L-FABP是一种14 kDa的脂肪酸结合蛋白[32]。当肾近端小管因各种原因产生大量过氧化物时,会使得L-FABP不能能完全被脂质结合,从而分泌入尿液,最终导致其在尿液中的含量显著升高[31]。研究表明, L-FABP表现出了良好的早期预测能力。在KHAN M B等[33]研究中纳入了88例患者,其中有10例(11.4%)患者在心脏手术后发生了AKI。在AKI患者中,血清肌酐水平在手术后24~48 h开始升高,而尿L-FABP在4 h即开始升高。该研究显示,尿L-FABP的最佳临界值为269 ng/L, L-FABP临界值在4 h识别AKI的灵敏度为0.83, 特异度为0.83, 阳性和阴性预测值为0.38和0.97。
在临床上, L-FABP联合CPB时间可以帮助识别心血管手术中AKI高危人群。简单来说,在CPB时间评估术后AKI的风险后,16~18 h的尿L-FABP表现出更好的辨别能力,其AUC为0.72, 通过这种方法可以很好地鉴别出术后7 d内有可能发生AKI的高危患者,从而实现早期干预[58]。NARUSE H等[59]研究发现,入院时尿L-FABP水平是心脏重症监护病房(CICU)患者不良临床结局的有力预测指标,当尿L-FABP与肌酐联用时可显著改善CICU患者的远期临床结局。此外,基线尿L-FABP水平是预测急性失代偿性心力衰竭患者AKI的可靠生物标志物,AUC为0.93, 灵敏度为0.94, 特异度为0.87[34]。
不过,由于L-FABP在肝脏中转运,当患者合并肝脏疾病时,尿液中的L-FABP对早期预测CSA-AKI的特异度可能会降低,甚至失去诊断价值[60]。此外,一些现有的肾脏疾病,包括非糖尿病慢性肾病、早期糖尿病肾病、多囊肾病和特发性局灶性肾小球硬化等,都可能会影响尿L-FABP的诊断性能。
2.4 肾损伤分子-1(KIM-1)
KIM-1是一种1型跨膜糖蛋白,缺血和肾毒性条件下在近端小管细胞中表达[61]。正如HAN W K等[35]报道, KIM-1有良好的诊断特异度。该研究表明,小儿心脏手术AKI患者的KIM-1水平高于对照组, CPB后12、24、36 h, KIM-1诊断AKI的AUC分别为0.83、0.78、0.84。一项Meta分析[36]显示, KIM-1在心脏手术人群中诊断AKI的灵敏度为0.74(95%CI: 0.63~0.84), 特异度为0.84(95%CI: 0.76~0.90)。
尿KIM-1水平与肾组织损伤的程度相对应,可用于预测ATI患者的不良肾脏结局。特别是对于高度怀疑患有ATI但不适合进行肾活检的患者来说,尿KIM-1可以提高检测严重ATI的灵敏度和特异度,使临床医生能够更早地进行干预和治疗[29], 这是该生物标志物所特有的功能。OLVERA-POSADA D等[62]研究表明, KIM-1的临床意义除了能够早期识别AKI外,还在于能够量化肾损伤的程度以调整治疗方案。
然而, KIM-1容易受到炎症性疾病的影响,此外,糖尿病、高血压动脉粥样硬化性脑缺血等合并症会同样对尿KIM-1浓度产生显著影响,上述因素最终导致其预测AKI的能力下降[63]。
3 新兴生物标志物
3.1 Dickkopf相关蛋白3(DKK3)
尿DKK3, 一种小管间质纤维化的调节因子,被认为是肾小管应激的标志[61]。在SCHUNK S J等报道中,术前尿DKK3水平预测术后AKI的AUC为0.78(95%CI: 0.75~0.82,P<0.000 1), 且术前高水平DKK3往往预示着长期肾功能的显著降低,并提示了AKI向慢性肾脏病的转变。SCHUNK S J等[37]还发现,入院时尿DKK3/肌酐比值>471 pg/mg的患者CSA-AKI发生率显著增加,所以作者推荐将DKK3用于CSA-AKI高危患者的术前筛查[37]。
DDK3的临床意义在于其可辅助识别无临床肾病表现而存在潜在肾损伤风险的患者,从而使高DDK3水平的患者能通过术前肾保护措施,最大程度地改善临床预后。此外,术前高水平DDK3可预测冠状动脉造影后AKI的发生,并提示可能会发生肾小管的亚临床损伤[64]。DDK3的局限性主要表现在研究样本量有限,多为单中心研究,且大多为回顾性和观察性研究,无法评估因果关系,不仅如此, DDK3与其他肾病标志物,如NGAL、KIM-1等联合应用及比较的研究还很少,因此未来需要进一步扩大样本规模、设计前瞻性研究、开展机制研究等来优化和扩展其在肾脏领域的应用。
3.2 脑啡肽原a 119-159 (Penkid)
Penkid是一种5 kDa的肽,通过与阿片受体结合参与多种生理过程,其在许多组织中表达,但在肾组织中尤其密集[38]。Penkid体内半衰期长,采集后稳定,不易分解,更重要的是其不是血浆结合蛋白,仅在肾小球中被过滤[65]。BEUNDERS R等[39]观察到Penkid血浆浓度与肾小球滤过率呈正相关, Penkid能预测患者的28 d病死率,因此其被认为是肾小球滤过损伤的生物标志物。
目前鲜有将Penkid用于CSA-AKI预测的报道,但在急性心力衰竭患者中Penkid已成为预测肾功能恶化(WRF)的最有希望的标志物[66]。在上述研究中,PenKid与WRF相关(AUC为0.65,P<0.001)。在汇集队列的多变量逻辑回归分析[66]中, Penkid显示出与肾功能恶化的独立关联(调整后的OR为1.74,P=0.004)。
Penkid的临床意义是可以通过其水平预测患者预后,据DÉPRET F等[41]报道,在未被诊断为AKI的患者中,高Penkid水平患者的病死率显著高于Penkid浓度较低的患者。此外,使用PenKid预测AKI 可为不符合当前 AKI 定义的患者提供更好的表型分析,进而改善被这些患者的预后[41]。然而,将PenKid用于CSA-AKI的早期预测的相关报道数量有限,PenKid以及与其他指标的结合是否可以进一步提高CSA-AKI的早期诊断的能力还有待观察。
3.3 微小RAN(miRNA)
miRNA是一种由21~23个核苷酸组成的内源性非蛋白质编码RNA序列,生理状态下以游离状态稳定地存在于血液和尿液中[43],近年来有研究发现miRNA会参与炎症反应、缺血再灌注损伤等过程,从而促进AKI的发生发展[42]。临床研究[44]表明, miRNA-21有潜力识别CSA-AKI风险较高的患者,在这项研究中,作者纳入了115例接受心脏手术的患者,分别在术前和术后4 h测量miRNA-21。结果发现,发生CSA-AKI患者的基线miRNA-21显著低于未发生CSA-AKI的患者,当miRNA-21水平低于0.31时,患者发生AKI的相对危险度为3.11。研究[45]表明, CSA-AKI患者手术后miR-10a-5p水平较低,其水平与损伤严重程度相关,并且联合乳酸水平一起提供了良好的AKI预测能力,其AUC为0.82。
miRNA是近些年新兴的生物标志物,不同miRNA和AKI或CSA-AKI的相关研究[67- 68]均陆续有报道,如miRNA-30c-5p、miRNA-192-5p、miRNA-192等,总之miRNA有成为CAS-AKI的早期预测中的强有力标志物的潜力。但是, miRNA对于CSA-AKI早期诊断能力大多是从动物模型推断得到,临床证据不足,而且其信号通路复杂,并且其表达容易受到各种因素(年龄、性别、合并的其他疾病等)影响,从而导致结果的准确性受到影响[42- 43]。
4 生物标志物的联合应用
近年来,生物标志物的联合应用在早期发现AKI中的作用逐渐受到人们关注。例如, ARUN O等[69]注意到糖尿病患者尿NGAL和血清胱抑素C(CysC)水平的联合测定能较血尿素氮和血清肌酐更早发现AKI, 该研究通过生物标志物的联合应用将诊断时间窗提前了约12 h。一项评估尿NGAL联合KIM-1的疗效的前瞻性观察研究[70]表明,尿NGAL灵敏度更高,而KIM-1似乎特异于缺血肾损伤, 2种标志物联合使用的AUC为0.906。一项纳入603例成人心脏手术的研究结果显示,联合应用术后1 h尿液NGAL、KIM-1、白细胞介素-18(IL-18)和血清半胱氨酸蛋白酶抑制剂C, 可以早期识别出发生严重不良后果(院内死亡或行肾脏替代疗法)的患者[71]。LEE T H等[58]的研究结果也表明,联合术后6 h尿L-FABP和NGAL预测AKI的能力要强于单独使用尿L-FABP, 两者AUC分别为0.929和0.868。
目前来看联合多种生物标志物对CSA-AKI进行诊断及预后评估可能较单个标志物更具优势,但是标志物联用尚缺乏大规模、多中心的临床研究支撑,且其联用过程中存在的方法学问题也不可忽视。MEISNER A等[72]首次指出在联用生物标志物的研究中至少存在一种偏倚(其中选择偏倚最为常见),并建议研究者在后期进行数据整理时对研究队列进行分层分析,在将来的科学研究中要更加注重研究设计的严谨性与数据分析的缜密性,以进一步评估生物标志物联用的真实诊断价值。
5 总 结
在CSA-AKI的早期诊断中,生物标志物变得越来越重要,虽然一些新的生物标志物也已经被开发出来,但不可否认的是,每个生物标志物都有着各自的优缺点。所以,未来研究的重点应该集中在生物标志物的联合应用上,以期能够形成生物标志物之间的互补,从而为临床早期识别CSA-AKI提供最大的可能,并且未来仍需开展多中心、大样本前瞻性对照性试验研究,以进一步明确生物标志物联用的真实诊断价值。
