利多卡因通过降低微小RNA-181a表达抑制缺氧/复氧诱导的心肌细胞损伤
2024-03-30王锦平
张 敏, 王锦平, 何 勇
(四川省遂宁市中心医院 手麻部, 四川 遂宁, 629000)
心肌损伤主要见于各种原因导致的心肌器质性病变,最常见的是心肌炎。青年多见于心肌细胞被病毒侵犯,从而出现胸闷、心慌、气短等症状,中老年患者多见于冠心病、心肌缺血、心肌细胞受损。患者可表现为活动后的心前区疼痛,持续性的心前区疼痛见于心肌梗死、心肌缺血、心肌细胞坏死[1-2]。研究[3-4]表明,缺氧、复氧会引起心肌细胞损伤。利多卡因是可卡因的一种衍生物,是目前防治急性心肌梗死及各种心脏病并发快速室性心律失常的药物[5-6]。微小RNA-181a(miR-181a)是一个功能miRNA, 研究[7]表明,下调miR-181a-5p可减轻冠状动脉微栓塞引起的心肌细胞的氧化应激和炎症反应。miR-181a通过调节AKT信号通路影响大鼠心肌缺血再灌注损伤[8]。但miR-181a是否参与利多卡因在心肌损伤中的作用尚未见报道。本研究主要探讨利多卡因通过调控miR-181a对缺氧/复氧(H/R)诱导的心肌细胞H9C2损伤的影响。
1 材料与方法
1.1 主要材料
心肌细胞H9C2购自中科院上海细胞库; DMEM培养基、胎牛血清(FBS)购于美国Sigma公司; 胰蛋白酶购于美国Hyclone公司; MTT试剂购自北京百奥莱博生物科技有限公司; Annerxin V/FITC试剂盒购自上海碧云天生物技术研究所; BCA试剂盒购自上海翊圣生物科技有限公司; 于武汉博士德生物工程有限公司购置一抗和HRP标记的山羊抗兔二抗; 实时荧光定量聚合酶链反应(RT-qPCR)所有试剂盒购自大连宝生物科技有限公司; 丙二醛(MDA)、乳酸脱氢酶(LDH)、超氧化物歧化酶(SOD)试剂盒购自南京建成生物工程研究所; 酶联免疫吸附实验(ELISA)检测试剂盒购自上海酶联生物科技有限公司。
1.2 方法
1.2.1 细胞处理与分组: H9C2细胞在含100 mL/L的FBS的DMEM培养基中培养,置于体积分数为50 mL/L CO2、37 ℃培养箱中。待细胞铺满培养瓶底80%~90%时,用胰蛋白酶进行消化,进行传代培养。取对数生长期细胞,在95% N2、5% CO2的培养箱缺氧培养6 h, 更换正常培养基,培养4 h, 建立H/R模型,作为H/R组; 正常培养的细胞作为对照(Con)组。基于先前的研究[9], 使用1.0、2.5、5.0、10.0、20.0 μmol/L利多卡因处理H/R诱导的H9C2细胞,并分别设为1.0 μmol/L组、2.5 μmol/L组、5.0 μmol/L组、10.0 μmol/L组和20.0 μmol/L组; 将anti-miR-NC、anti-miR-181a分别转染至H/R诱导的H9C2细胞,记为H/R+anti-miR-NC组、H/R+anti-miR-181a组; 将miR-NC、miR-181a分别转染至H/R诱导的H9C2细胞,再用20 μmol/L利多卡因处理,分别记为H/R+miR-NC+20 μmol/L组、H/R+miR-181a+20 μmol/L组。
1.2.2 MTT实验: 在96孔板中,每孔20 μL MTT溶液(5 mg/mL)被添加到H9C2细胞温育4 h, 弃上清后, 加入150 μL二甲基亚砜,于震荡仪上震荡反应10 min,待结晶物完全溶解后,依据全自动酶标仪各孔A值被评估于490 nm处。
1.2.3 流式细胞术: 磷酸盐缓冲液(PBS)洗涤,胰蛋白酶消化, 1 000转/min转速离心5 min后,收集的细胞用PBS洗涤,加入结合缓冲液100 μL重悬,随后添加5 μL Annexin V-FITC。上机检测前混合5 μL PI, 室温静置20 min后,基于流式细胞仪分析细胞凋亡情况。
1.2.4 蛋白质印迹(Western blot): 用RIPA蛋白裂解液提取H9C2细胞总蛋白,采用BCA统一定量。通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)后,样本被转膜、封闭,加入半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)(1∶1 000)一抗稀释液, 4 ℃孵育过夜,洗膜缓冲液(TBST)洗涤,随后在(1∶2 000)二抗稀释液中室温浸泡 1 h, 暗室曝光显影。最后,采用Quantityone软件分析条带灰度值。
1.2.5 RT-qPCR 检测miR-181a表达: 采用TRIzol试剂从各组细胞中提取总RNA, 使用逆转录试剂盒、SYBR Green Real-time PCR试剂盒分别执行反转录和RT-qPCR。程序为95 ℃ 5 min, 95 ℃ 30 s, 60 ℃ 30 s, 72 ℃ 30 s, 共循环40次。此外, miR-181a上游引物5′-GGGCAGCCTTAAGAGGA-3′, 下游引物5′-CAGTGCGTGTCGTGGA-3′;U6上游引物5′-TTGGTATCGTGGAA-GGACTCA-3′, 下游引物5′-TGTCATCATATTTGGCAGGTT-3′。采用 2-△△Ct法计算miR-181a相对表达量。
1.2.6 试剂盒检测MDA含量及LDH、SOD活性: 收集各组细胞,提取上清液,使用试剂盒检测MDA含量及LDH、SOD活性,实验步骤按照操作说明书进行。
1.2.7 ELISA检测炎性因子水平: 收集各组细胞, PBS清洗2次后充分裂解细胞, 3 500转/min离心10 min。取上清液,使用ELISA试剂盒检测肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)水平。
1.3 统计学分析
2 结 果
2.1 利多卡因对H/R诱导的H9C2细胞活性的影响
与Con组相比, H/R组的细胞活性降低,差异有统计学意义(P<0.05)。与H/R组相比, 1.0、2.5 μmol/L组的细胞活性差异无统计学意义(P>0.05), 5.0、10.0、20.0 μmol/L利多卡因处理的细胞活性提高,差异有统计学意义(P<0.05), 且呈剂量依赖性。因此,后续以20.0 μmol/L利多卡因进行实验。见表1。

表1 利多卡因对H/R诱导的H9C2细胞活性的影响 %
2.2 利多卡因对H/R诱导的H9C2细胞凋亡的影响
与Con组相比, H/R组细胞凋亡率、Caspase-3蛋白表达升高,差异有统计学意义(P<0.05); 与H/R组相比, 20.0 μmol/L组细胞凋亡率、Caspase-3蛋白表达降低,差异有统计学意义(P<0.05)。见表2、图1。
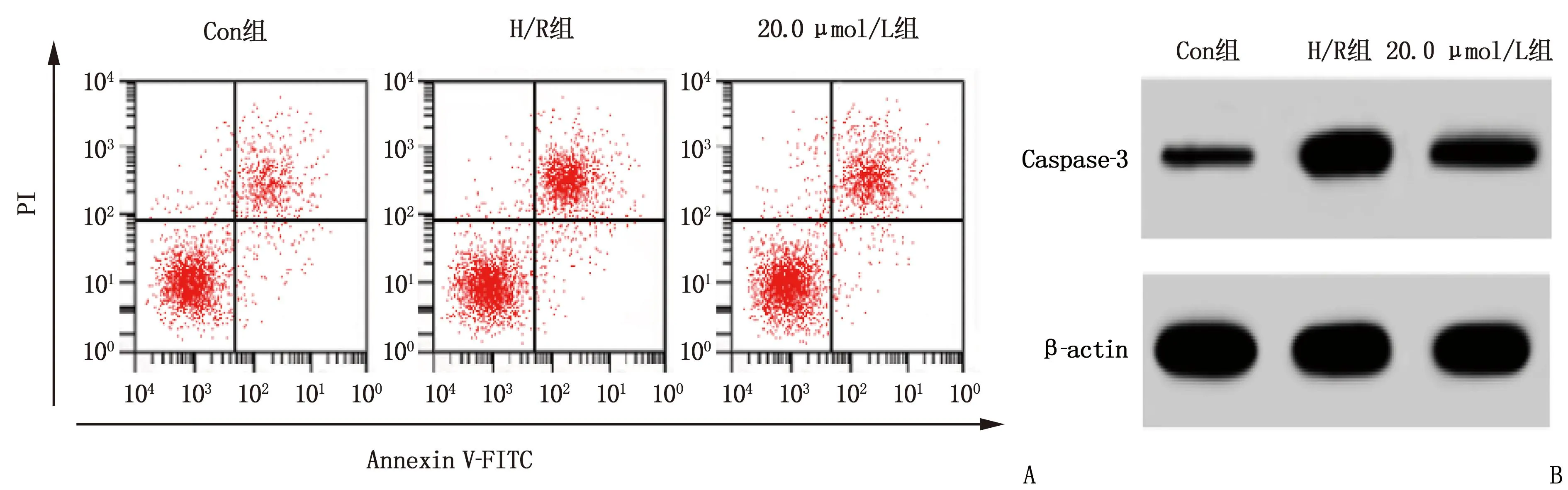
A: 凋亡图; B: 蛋白条带图。

表2 利多卡因对H/R诱导的H9C2细胞凋亡的影响
2.3 利多卡因对H/R诱导的H9C2细胞氧化应激和炎性因子的影响
与Con组相比, H/R组细胞MDA含量、LDH活性以及炎性因子(TNF-α、IL-1β、IL-6)水平升高, SOD活性降低,差异有统计学意义(P<0.05); 与H/R组相比, 20.0 μmol/L组MDA含量、LDH活性以及炎性因子水平降低, SOD活性提高,差异有统计学意义(P<0.05)。见表3。
表3 利多卡因对H/R诱导的H9C2细胞氧化应激和炎性因子的影响
2.4 抑制miR-181a表达对H/R诱导的H9C2细胞凋亡的影响
与H/R+anti-miR-NC组相比, H/R+anti-miR-181a组细胞miR-181a表达、凋亡率、Caspase-3蛋白表达降低,差异有统计学意义(P<0.05)。见图2、表4。

图2 蛋白条带图

表4 利多卡因对H/R诱导的H9C2细胞凋亡的影响
2.5 抑制miR-181a表达对H/R诱导的H9C2细胞氧化应激和炎性因子的影响
与H/R+anti-miR-NC组相比, H/R+anti-miR-181a组的细胞miR-181a表达、MDA含量、LDH活性以及TNF-α、IL-1β、IL-6降低, SOD活性升高,差异有统计学意义(P<0.05)。见表5。

表5 抑制miR-181a表达对H/R诱导的H9C2细胞氧化应激和炎性因子的影响
2.6 过表达miR-181a逆转利多卡因对H/R诱导的H9C2细胞损伤的影响
与H/R+miR-NC+20 μmol/L组相比,H/R+miR-181a+20 μmol/L组细胞凋亡率、Caspase-3蛋白表达升高, MDA含量、LDH活性以及TNF-α、IL-1β、IL-6升高, SOD活性降低,差异有统计学意义(P<0.05)。见图3、表6。

图3 蛋白图

表6 过表达miR-181a逆转利多卡因对H/R诱导的H9C2细胞氧化应激和炎性因子的影响
3 讨 论
心肌细胞损伤一般表现为心肌细胞缺血以及炎症、肥大、坏死等情况。造成心肌细胞损伤的原因有很多,包括缺氧、生物因素、物理因素、化学因素、营养失衡、神经内分泌因素、免疫因素、遗传缺陷以及社会心理因素等[10-14]。
利多卡因是最常用的局部麻醉剂之一,也是多种心脏病的抗心律失常药物。研究[9, 15]表明,利多卡因还具有多种药理作用,包括抗炎、免疫调节、抗肿瘤和抗氧化作用。目前,已经有许多研究报道利多卡因对心脏疾病具有良好效果。研究[16]表明,患者应用利多卡因可减轻心肌细胞损害,通过调控LDH、天冬氨酸氨基转移酶(AST)和α-羟丁酸脱氢酶(α-HBDH), 且麻醉时间快,维持时间长,效果良好。研究[17]表明,在成人单纯二尖瓣置换术中应用利多卡因,可以提高心脏手术中的心脏停搏效果。研究[18]表明,利多卡因对老年心脏手术患者具有较好的麻醉效果,具有一定的心肌保护作用; 研究[19]表明,利多卡因预处理促进H/R诱导的心肌细胞的活性,可抑制凋亡; 研究[20]表明,利多卡因预处理通过影响时钟基因BMAL1, 改善甲基乙二醛培养的H9C2心肌细胞的H/R损伤。本研究发现, H/R诱导后心肌细胞活性显著降低,但利多卡因可以显著提高细胞活性。H/R诱导后心肌细胞凋亡率显著升高,但20.0 μmol/L利多卡因可显著降低细胞凋亡率。H/R诱导后心肌细胞MDA含量、LDH活性以及TNF-α、IL-1β、IL-6水平显著升高, SOD活性显著降低; 但20.0 μmol/L利多卡因显著降低MDA含量、LDH活性以及TNF-α、IL-1β、IL-6水平,显著升高SOD 活性。由此说明,利多卡因可以降低心肌细胞的氧化应激和炎症水平,从而保护细胞免受低氧诱导的损伤。
miRNAs已被证实参与调节心肌细胞的损伤。miR-488-3p通过靶向ZNF791抑制急性心肌梗死诱导的心肌细胞凋亡[21]。miR-542-5p通过抑制自噬,加重缺氧/再氧诱导的心肌细胞损伤[22]。本研究表明,抑制miR-181a表达可显著降低心肌细胞凋亡率、MDA含量、LDH活性以及TNF-α、IL-1β、IL-6水平,显著升高SOD活性,说明抑制miR-181a表达,降低了细胞的氧化应激和炎症水平,表明miR-181a能够加重氧化应激条件下心肌细胞损伤。重要的是,与H/R+anti-miR-NC+20 μmol/L组相比, H/R+anti-miR-181a+20 μmol/L组细胞凋亡率、Caspase-3蛋白表达显著升高, MDA含量、LDH活性以及TNF-α、IL-1β、IL-6水平显著升高, SOD活性显著降低,说明利多卡因通过干扰miR-181a表达抑制H/R诱导的心肌细胞损伤。
综上所述,利多卡因通过抑制miR-181a表达,进而抑制H/R诱导的心肌细胞H9C2损伤,这为利多卡因治疗心肌损伤提供了理论基础。
