长链非编码RNA NUTM2A-AS1靶向微小RNA-129-5p调控氧化低密度脂蛋白诱导的血管内皮细胞损伤的机制研究
2024-03-30李晓宇张永咏杨忠信
李晓宇, 张永咏, 秦 娟, 杨忠信
(河南大学第一附属医院, 1. 心血管内科, 2. 胸外科, 河南 开封, 475000)
动脉粥样硬化(AS)是一种慢性血管性疾病[1]。内皮细胞损伤是AS发生发展的主要诱因[2]。氧化型低密度脂蛋白(oxLDL)是AS的危险因素,其参与内皮功能障碍和泡沫细胞形成,可引起血管内皮损伤[3]。研究[4]表明,微小RNA(miRNA)参与内皮细胞的损伤,例如miR-129-5p介导的Beclin-1可抑制AS中的内皮细胞自噬[5]。circ_0000345通过靶向miR-129-5p轴减轻人脐静脉血管内皮细胞(HUVEC)中ox-LDL介导的损伤[6]。miR-129-5p还可减轻脂多糖(LPS)诱导的急性肾损伤[7]。但miR-129-5p影响oxLDL诱导血管内皮细胞损伤的机制尚不清楚。研究[8]报道,敲低长链非编码RNA(lncRNA)NUTM2A-AS1通过靶向let-7c-5p/HMGB1轴减轻LPS诱导的人牙髓细胞损伤。经预测, miR-129-5p与lncRNA NUTM2A-AS1存在互补序列,但lncRNA NUTM2A-AS1对oxLDL诱导的血管内皮细胞损伤及机制是否与miR-129-5p有关尚未完全阐明。本研究探讨lncRNA NUTM2A-AS1靶向miR-129-5p调控oxLDL诱导的血管内皮细胞损伤的机制研究,现报告如下。
1 材料与方法
1.1 主要材料
HUVEC,DMEM培养基(上海雅吉生物科技有限公司); oxLDL(上海高创化学科技有限公司); Trizol试剂(南京森贝伽生物科技有限公司); 丙二醛(MDA)含量检测试剂盒,超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性检测试剂盒(上海吉至生化科技有限公司); 荧光定量试剂盒(上海研卉生物科技有限公司); 细胞凋亡检测试剂盒、RIPA蛋白裂解液(北京百奥莱博科技有限公司); 双荧光素酶报告基因检测试剂盒(武汉纯度生物科技有限公司)。
1.2 细胞处理与分组
将HUVEC培养于DMEM培养基,将lncRNA NUTM2A-AS1过表达载体和小干扰RNA以及相应对照(pcDNA和si-NC)分别转染至细胞,分别记为pcDNA-NUTM2A-AS1组、pcDNA组、si-NUTM2A-AS1组、si-NC组;用100 μg/mL的oxLDL处理细胞,设为oxLDL组,另将常规培养的细胞设为Con组。将lncRNA NUTM2A-AS1干扰表达载体及阴性对照、miR-129-5p模拟物及阴性对照转染至HUVEC后,用100 μg/mL的oxLDL处理,分别记为oxLDL+si-NUTM2A-AS1组、oxLDL+si-NC组、oxLDL+miR-129-5p组、oxLDL+miR-NC组;将NUTM2A-AS1干扰表达载体与miR-129-5p抑制剂或阴性对照共转染至HUVEC后,用100 μg/mL的oxLDL处理,分别记为oxLDL+si-NUTM2A-AS1+anti-miR-129-5p组、oxLDL+si-NUTM2A-AS1+anti-miR-NC组。
1.3 实时荧光定量聚合酶链反应(RT-qPCR)
用Trizol试剂提取各组HUVEC的总RNA, 合成cDNA后按荧光定量试剂盒说明进行PCR, 以GAPDH和U6为内参,相对表达量用2-△△Ct法计算。lncRNA NUTM2A-AS1上游引物5′-ATAGCTCACTGTAGCCTCG-3′, 下游引物5′-TTTGTTGTATGTAGACCCATC-3′; miR-129-5p上游引物5′-ACACTCCAGCTGGGCTTTTTGCGGTCTGG-3′, 下游引物5′-TGGTGTCGTGGAGTCG-3′;GAPDH上游引物 5′-GGTCACCAGGGCTGCTTT-3′, 下游引物5′-GGAAGATGGTGATGGGATT-3′;U6上游引物5′-CTCGCTTCGGCAGCACA-3′, 下游引物 5′-AACGCTTCACGAATTTGCGT-3′。
1.4 氧化应激分析
采用磷酸盐缓冲液(PBS)清洗各组细胞,随后采用超声方法裂解细胞,离心,取上清,按试剂盒说明书检测MDA含量和SOD、GSH-Px活性。
1.5 流式细胞仪检测
采用1×结合缓冲液重悬各组细胞,随后与5 μL Annexin V-FITC和PI避光染色5 min,最后流式检测。
1.6 蛋白质印迹法
使用RIPA提取细胞裂解物,定量后, 30 μg蛋白质样品与5×缓冲液混合, 95 ℃下煮沸20 min, 15% 十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),随后转膜。5%脱脂牛奶封闭1 h后,与相应一抗于4 ℃孵育过夜,清洗后,加入二抗室温孵育2 h, 然后用化学发光检测试剂盒检测蛋白条带。
1.7 双荧光素酶报告实验
将预测的含有miR-129-5p序列的片段克隆并插入psiCHECK-2质粒构建野生型荧光素酶载体,随后将片段序列点突变,插入载体构建突变型荧光素酶载体。在六孔板中,当细胞培养至约70%融合,将构建的载体和miR-NC或miR-129-5p共转染至细胞中,依次将细胞分为miR-NC和WT-NUTM2A-AS1共转染组、miR-129-5p和WT-NUTM2A-AS1共转染组、miR-NC和MUT-NUTM2A-AS1共转染组、miR-129-5p和MUT-NUTM2A-AS1共转染组。48 h后,检测荧光素酶活性。
1.8 RNA下拉实验
构建生物素标记miR-129-5p和miR-NC探针,并将其转染入HUVEC细胞,分别设为bio-miR-129-5p组和bio-miR-NC组。随后收集细胞裂解液,与链霉亲和素包被的磁珠孵育。采用qRT-PCR检测lncRNA NUTM2A-AS1的富集量。
1.9 统计学分析
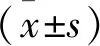
2 结 果
2.1 Con组与oxLDL组lncRNA NUTM2A-AS1、miR-129-5p表达比较
相较于Con组,oxLDL组lncRNA NUTM2A-AS1表达水平升高, miR-129-5p表达水平降低,差异有统计学意义(P<0.05), 见表1。

表1 Con组与oxLDL组lncRNA NUTM2A-AS1、miR-129-5p表达比较
2.2 干扰lncRNA NUTM2A-AS1表达对oxLDL诱导的血管内皮细胞损伤的影响
与Con组比较, oxLDL组lncRNA NUTM2A-AS1表达水平、MDA含量升高, SOD、GSH-Px活性降低,血管内皮细胞凋亡率和cleaved-caspase3、cleaved-caspase9蛋白表达水平升高,差异有统计学意义(P<0.05); 与oxLDL+si-NC组比较, oxLDL+si-NUTM2A-AS1组lncRNA NUTM2A-AS1表达水平、MDA含量降低,SOD、GSH-Px活性升高,血管内皮细胞凋亡率和cleaved-caspase9、cleaved-caspase3蛋白表达水平降低,差异有统计学意义(P<0.05), 见图1、表2。

A: 凋亡相关蛋白表达; B: 细胞凋亡流式图。

表2 干扰lncRNA NUTM2A-AS1表达对oxLDL诱导的血管内皮细胞损伤的影响
2.3 miR-129-5p是lncRNA NUTM2A-AS1的功能靶标
StarBase预测结果显示, miR-129-5p与lncRNA NUTM2A-AS1存在互补序列,见图2。双荧光素酶报告实验结果显示,上调miR-129-5p降低了WT-NUTM2A-AS1细胞荧光素酶活性,差异有统计学意义(P<0.05), 见表3。RNA下拉实验结果显示,在bio-miR-129-5p探针下拉的复合物中, NUTM2A-AS1的丰度更高,差异有统计学意义(P<0.05), 见表4。过表达lncRNA NUTM2A-AS1可抑制miR-129-5p的表达,敲低lncRNA NUTM2A-AS1可上调miR-129-5p的表达,差异有统计学意义(P<0.05), 见表5。

图2 miR-129-5p与lncRNA NUTM2A-AS1互补序列的StarBase预测结果
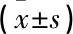
表3 双荧光素酶报告实验结果
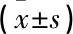
表4 RNA下拉实验结果
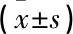
表5 lncRNA NUTM2A-AS1调控miR-129-5p的表达
2.4 过表达miR-129-5p对oxLDL诱导的血管内皮细胞损伤的影响
与oxLDL+miR-NC组比较, oxLDL+miR-129-5p组miR-129-5p表达水平升高, MDA含量降低, SOD、GSH-Px活性升高,血管内皮细胞凋亡率和cleaved-caspase9、cleaved-caspase3表达水平降低,差异有统计学意义(P<0.05), 见表6、图3。
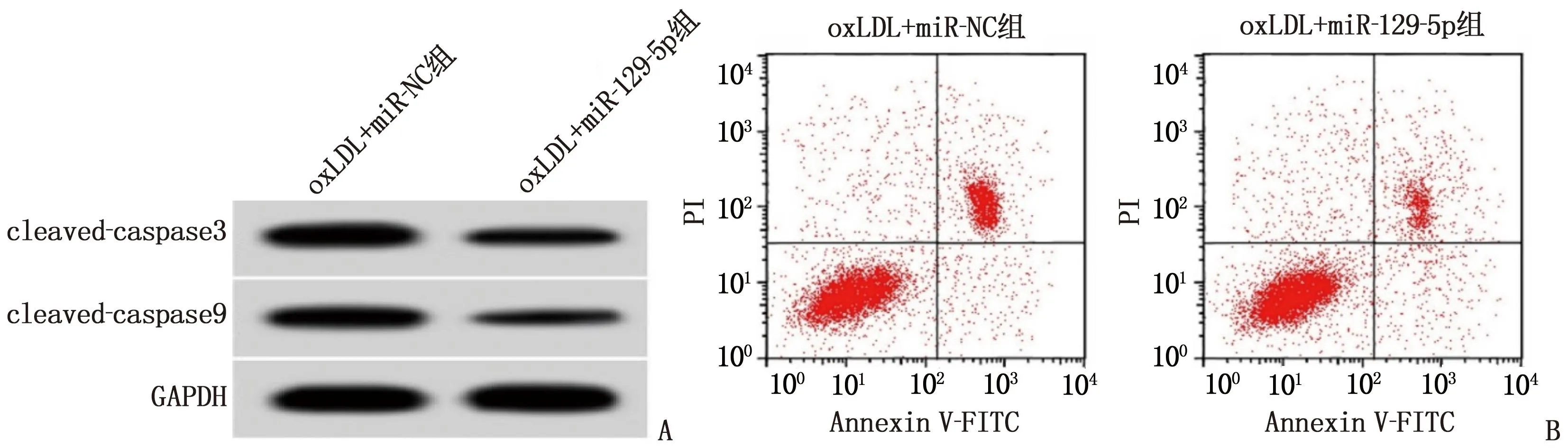
A: 凋亡相关蛋白表达; B: 细胞凋亡流式图。

表6 miR-129-5p过表达对oxLDL诱导的血管内皮细胞损伤的影响
2.5 下调miR-129-5p表达逆转了干扰lncRNANUTM2A-AS1表达对oxLDL诱导的血管内皮细胞损伤的作用
与oxLDL+si-NUTM2A-AS1+anti-miR-NC组比较, oxLDL+si-NUTM2A-AS1+anti-miR-129-5p组miR-129-5p表达水平降低,MDA含量升高, SOD、GSH-Px活性降低,血管内皮细胞凋亡率及cleaved-caspase3、cleaved-caspase9表达水平升高,差异有统计学意义(P<0.05),见图4、表7。
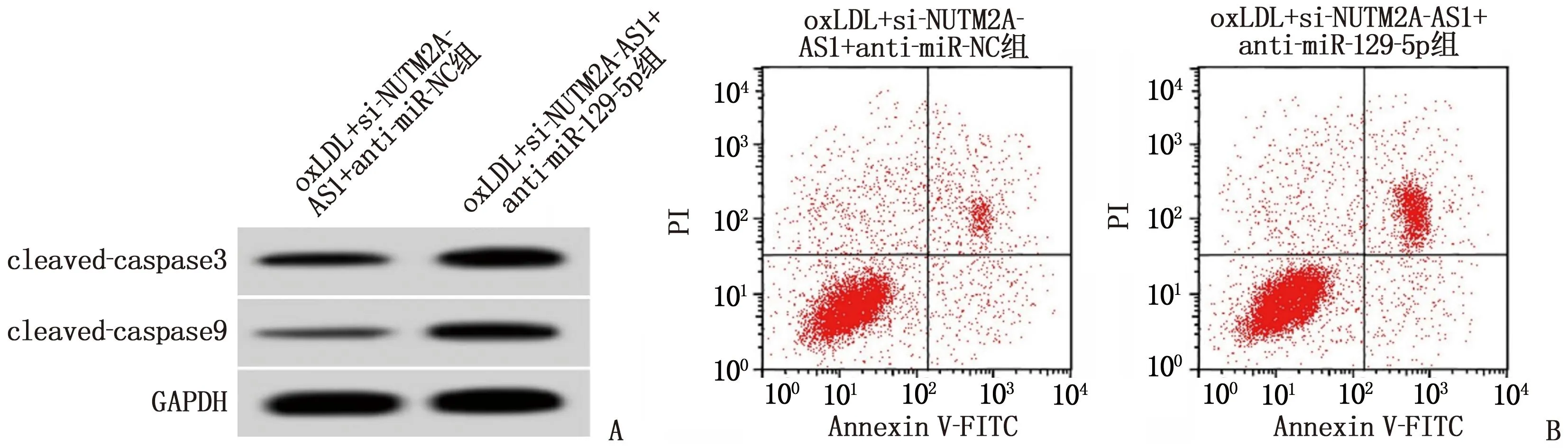
A: 凋亡相关蛋白表达; B: 细胞凋亡流式图。

表7 下调miR-129-5p表达逆转了干扰lncRNA NUTM2A-AS1表达对oxLDL诱导的血管内皮细胞损伤的作用
3 讨 论
AS是一种与氧化应激和内皮功能障碍相关的慢性血管炎症性疾病,而炎症反应、氧化应激等是引起内皮细胞损伤的重要因素[9-11]。oxLDL介导的血管内皮细胞损伤是AS的早期行为和主要信号[12]。因此,本研究采用oxLDL处理血管内皮细胞构建损伤模型。结果显示, oxLDL作用的血管内皮细胞中MDA含量升高, SOD、GSH-Px活性降低,血管内皮细胞凋亡率及cleaved-caspase3、cleaved-caspase9表达水平升高,证实oxLDL诱导了血管内皮细胞氧化损伤。miRNA参与调控细胞损伤过程,研究[13]显示,慢性心力衰竭患者血清中miR-129-5p下调, miR-129-5p上调则可减轻慢性心力衰竭大鼠的氧化应激和炎症反应。miR-129-5p可防止心肌缺血再灌注损伤[14], 并可有效抑制血管紧张素Ⅱ诱导的心肌细胞肥大和氧化应激[15]。miR-129-5p通过下调SOX6减轻阿尔茨海默病的炎症反应和神经损伤[16]。随后,本研究同样观察到miR-129-5p在oxLDL处理的血管内皮细胞中水平下调,上调其表达后MDA含量降低, SOD、GSH-Px活性升高,血管内皮细胞凋亡得到抑制,表明过表达miR-129-5p抑制了oxLDL作用后的血管内皮细胞氧化应激及细胞凋亡,说明miR-129-5p对内皮细胞同样具有抑制损伤的作用,与既往研究结果相符。
生物学软件预测发现, lncRNA NUTM2A-AS1与miR-129-5p有结合位点。oxLDL处理的血管内皮细胞中lncRNA NUTM2A-AS1表达水平升高,提示lncRNA NUTM2A-AS1可能与血管内皮细胞损伤有关。干扰lncRNA NUTM2A-AS1表达后, MDA含量降低, SOD、GSH-Px活性升高,血管内皮细胞凋亡抑制,表明干扰lncRNA NUTM2A-AS1表达可抑制oxLDL作用的血管内皮细胞氧化应激和细胞凋亡。此外, lncRNA NUTM2A-AS1能够靶向调控miR-129-5p, 而敲低miR-129-5p表达能够逆转lncRNA NUTM2A-AS1下调介导的血管内皮细胞损伤抑制。
综上所述,敲低lncRNA NUTM2A-AS1可以破坏oxLDL诱导的血管内皮细胞氧化及凋亡损伤,主要通过lncRNA NUTM2A-AS1/miR-129-5p轴介导,这些发现可能对AS未来治疗方法的设计具有指导意义。
