平足蛋白(PDPN)在肝星状细胞活化以及肝纤维化中的作用分析
2024-03-28王知意杨广越张玮浦娅琼赵鑫马文婷刘旭凌吴柳陶乐刘成
王知意, 杨广越, 张玮, 浦娅琼, 赵鑫, 马文婷,, 刘旭凌,, 吴柳,, 陶乐,, 刘成
上海中医药大学附属普陀医院 a.肝病实验室, b.中心实验室, c.感染科, 上海 200062
肝纤维化是由多种病因引起的慢性、进行性、弥漫性肝病,其主要病理特征是肝内细胞外基质过度增生与异常沉积所导致的肝脏结构和/或功能异常改变,持续进展可形成肝硬化,引起门静脉高压等并发症[1]。肝星状细胞(HSC)是肝纤维化发生的细胞学基础,抑制HSC活化是抗肝纤维化的重要步骤[2],然而抑制HSC活化的药物仍难走向临床[3],提示需要从新的角度探索HSC活化机制。
平足蛋白(podoplanin,PDPN)是一种特异于淋巴系统的黏蛋白型跨膜糖蛋白,在多种肿瘤中均有表达,被认为是肿瘤的标志物[4]。研究[5]发现,PDPN可能通过基质金属蛋白酶控制甲状腺乳头状癌细胞侵袭与迁移。然而PDPN在肝纤维化中的表达及功能罕见报道。本研究以PDPN在肝纤维化中的表达为切入点,探究PDPN对HSC活化的作用,为肝纤维化治疗提供新思路。
1 材料与方法
1.1 临床样本 选取2019年9月—2022年6月首次就诊于本院感染科的慢性乙型肝炎患者75例,收集患者性别、年龄等基本信息,记录患者生化指标检测结果,入院后患者签署肝穿刺知情同意书,病理分期由本院病理科鉴定报告。
1.2 动物及造模 12只雄性C57BL/6小鼠,6~8周龄,体质量(20±2)g,购自上海斯贝福公司[实验动物生产许可证号:SCXK(京)2019-0010],饲养于本院实验动物中心[动物使用许可证号:SYXK(沪)2019-0020],饲养室温度(22±1)℃,相对湿度30%~60%,12 h光照/12 h黑暗,自由进食和饮水,适应性喂养1周后随机分为正常组和模型组,每组各6只。模型组小鼠腹腔注射10% CCl4,0.04 mL/只,每周3次;正常组小鼠注射等体积橄榄油。6周后,各组小鼠禁食不禁水12 h,麻醉小鼠,下腔静脉采血,取出肝组织固定于10%福尔马林进行后续实验。
1.3 试剂与仪器 PDPN蛋白购自R&D公司,货号3670-PL;Trizol购自Takara,货号9190;逆转录试剂盒购自Takara,货号RR037A;SYBR购自Takara,货号RR420;PDPN抗体购自Abcam公司,货号ab128994和ab11936;BAY11-7082购自碧云天,货号S1523;CCl4购自上海凌峰公司,货号051025;免疫组化二抗(货号BA-1000)及ABC-HRP(货号6100)试剂均购自Vector;DAB购自中杉金桥,货号ZLI-9018;天狼星红染液由上海中医药大学刘平教授课题组馈赠;链酶蛋白酶购自Roche,货号9036-06-0;Ⅳ型胶原酶购自Sigma-Aldrich,货号V900893;透明质酸酶购自Sangon Biotech,货号I621BC0413;DNase购自Sigma-Aldrich,货号SLBF7798V;Nycodenz购自Alere Technologies AS,货号1002424;Percoll购自上海羿圣生物,货号40501ES60。FBS购自Gibco,货号10270-106;实时荧光定量PCR仪购自ABI,型号VIIA 7 DX;多功能酶标仪购自Thermo Varioskan,型号LUX;离心机购自Thermo,型号5804R。病理脱水、包埋等设备均购自Leica公司,具体如下:半自动轮转式切片机(型号RM2245)、自动脱水机(型号TP1020)、包埋机(型号EG1150H)、全自动染色机(型号ST5010)、自动封片机(型号CV5030)、荧光显微镜(购自Olympus,型号BX43)。
1.4 小鼠肝脏原代细胞分离 小鼠肝窦内皮细胞(LSEC)、HSC、Kupffer细胞、肝内胆管细胞(BEC)、肝细胞分离及培养方法参照课题组已发表文献[1]。
1.5 细胞培养及处理 小鼠原代HSC(DMEN-10% FBS)培养于12孔板,培养48 h后,换液为无血清培养基,PDPN蛋白处理15 min(终浓度为100 ng/mL),NF-κB抑制剂(BAY11-7082)处理1 h(终浓度1 µmol/mL),收集细胞检测炎症因子基因表达。
1.6 肝组织病理染色 选取肝右侧最厚一叶,10%中性福尔马林固定,自动脱水机逐级脱水,包埋、4 µm切片。Leica全自动染色机进行HE染色,观察组织学损伤。
天狼星红染色:石蜡切片脱蜡至水,蒸馏水洗涤3次,滴加天狼星红染色液,37 ℃孵育20 min,无水乙醇冲洗,晾干后封片。
免疫组化:石蜡切片首先脱蜡至水,再用EDTA抗原修复液>95 ℃热修复15 min后PBS洗3次,滴加H2O2灭活内源性过氧化物酶,使用BSA封闭后一抗4 ℃过夜,PBS洗3次,滴加对应二抗30 min,PBS洗净后滴加A+B 30 min,PBS洗净后用DAB显色,苏木素复染,无水乙醇脱水,二甲苯透明后封片。每组随机100倍下拍5个视野,采用Image-Pro软件统计阳性面积。
1.7 免疫印记 肝组织或细胞中加入含PMSF的RIPA裂解液,4 ℃,10 000 rpm,10 min离心后取上清。BCA法测定蛋白浓度,定量后加入Loading Buffer变性。取20 µg变性后的蛋白样品至SDS-PAGE电泳,230 mA,1.5 h分离胶,再转膜至PVDF膜,5% BSA封闭1 h,一抗(4 ℃)过夜孵育,二抗60 min室温孵育,洗净后显影收集图片。
1.8 实时定量PCR(RT-PCR) Trizol法提取肝组织和/或细胞总RNA,测定浓度后逆转录[Takara逆转录试剂盒(Cat:RR037A)]至cDNA,RT-PCR采用ABIViiA™ 7 Dx仪器检测相关引物,引物序列见表1,结束采用2-ΔΔCT法分析计算相关指标的基因相对表达量。

表1 RT-PCR引物序列Table 1 The RT-PCR primer sequences
1.9 统计学方法 采用SPSS 23.0 软件进行数据分析,计量资料以表示,2组间比较采用成组t检验;多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。两组数据相关性分析采用Spearman相关性分析法。P<0.05为差异有统计学意义。
2 结果
2.1 PDPN在肝纤维化患者肝组织中上调并与肝纤维化分期呈显著正相关 慢性乙型肝炎患者肝活检HE染色表明:S0期肝组织正常,S4期肝组织纤维增生、炎性浸润明显(图1a)。采用同患者的免疫组化检测PDPN表达,发现S0期肝组织PDPN表达呈弱阳性,S4期患者阳性分布于肝窦,表达显著升高(t=8.892,P=0.001)(图1b)。为了进一步衡量PDPN表达与肝纤维化分期的关系,检测75例患者PDPN的mRNA表达,结果表明,PDPN mRNA在正常肝脏中表达较低,在S3、S4期肝脏中表达显著升高,与正常组比较差异均有统计学意义(P值均<0.001)(图1c)。相关性分析结果表明,PDPN mRNA表达与肝纤维化分期显著正相关(r=0.655,P<0.001)(图1d)。
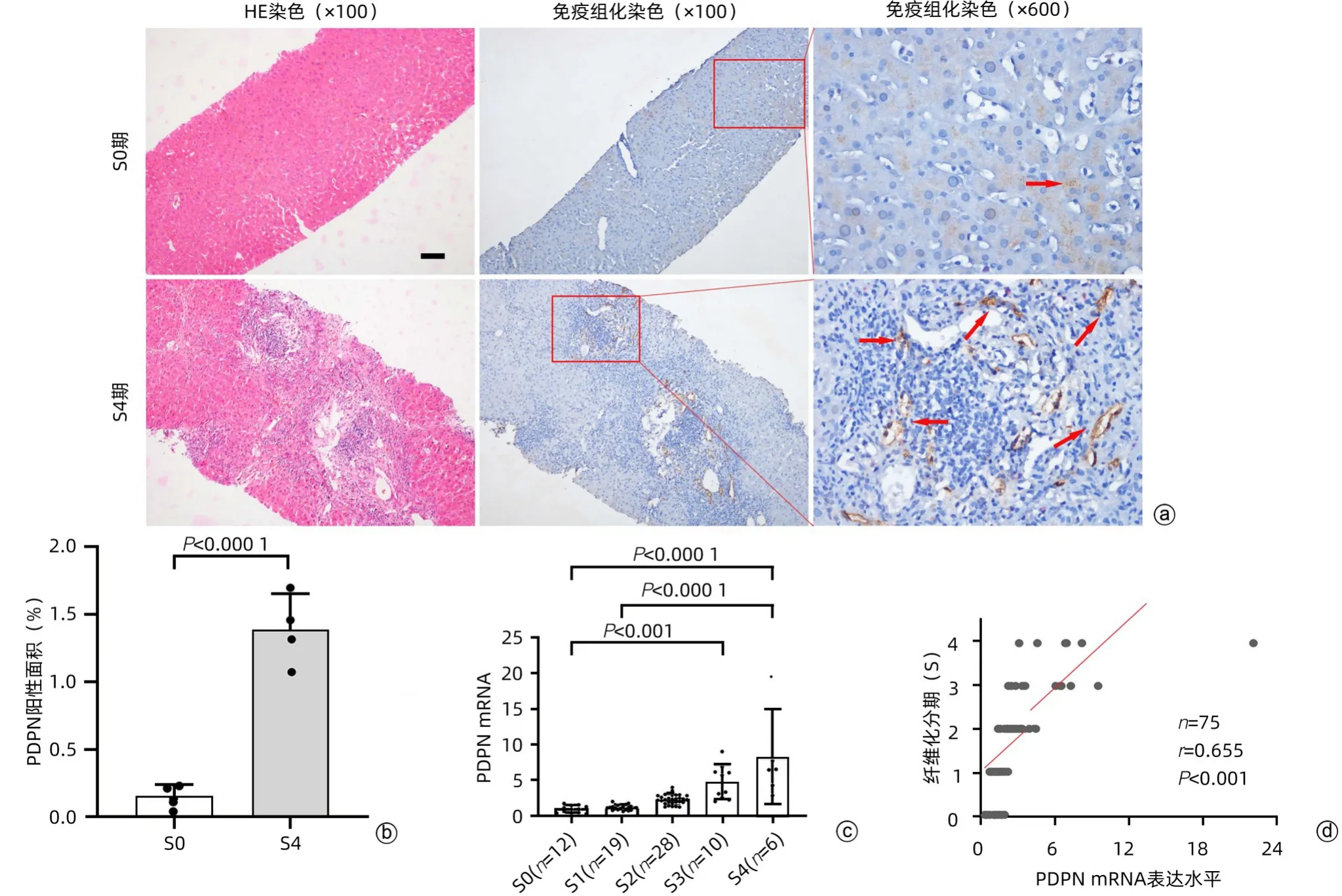
图1 PDPN在临床肝活检样本中的表达Figure 1 The expression of PDPN mRNA in liver biopsy tissue
2.2 PDPN表达在肝纤维化小鼠肝组织中升高 HE染色结果显示:正常组小鼠肝组织正常,小叶结构清晰,炎性浸润较少;模型组小鼠肝小叶中央静脉偏离,炎性浸润,脂肪变等病变。天狼星红染色结果显示:正常组小鼠组肝脏汇管区和中央静脉壁有少量胶原纤维着色,模型组小鼠肝组织见增生的胶原纤维分割肝小叶形成纤维间隔,部分假小叶形成(图2)。
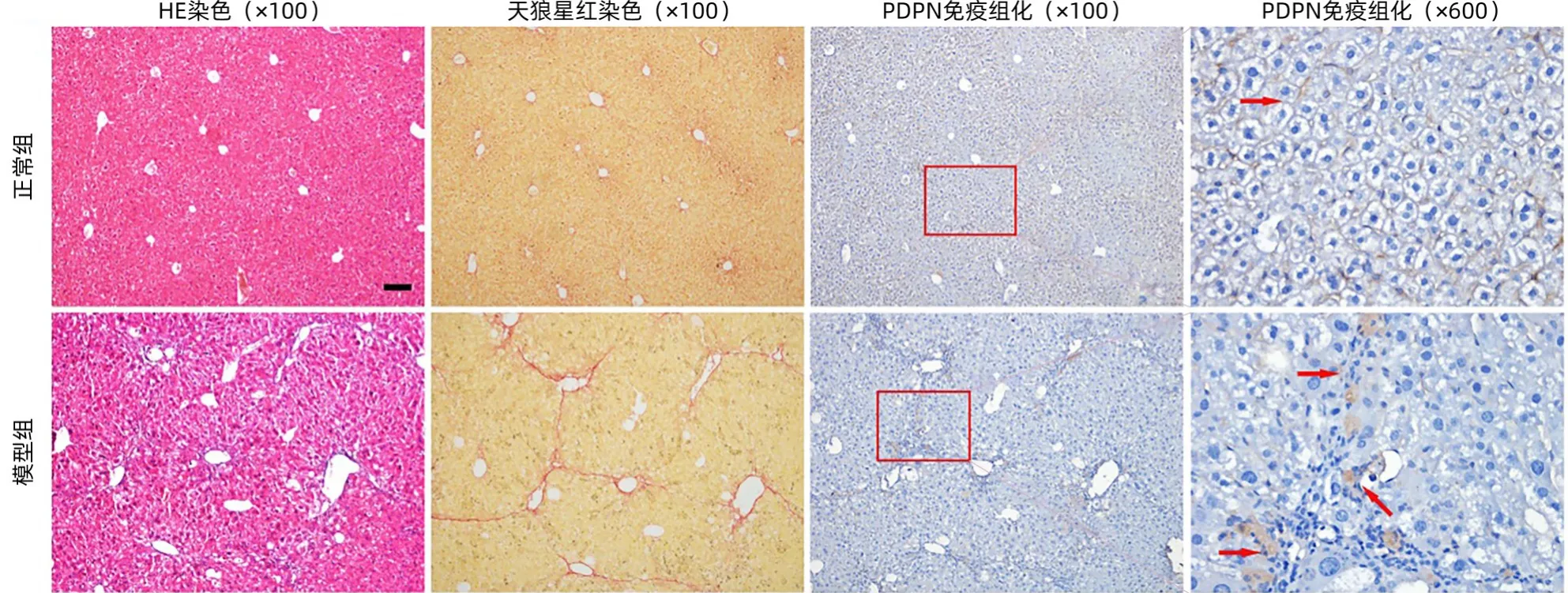
图2 两组小鼠肝组织病理染色结果Figure 2 The pathological staining of liver tissue in two groups
正常组PDPN阳性在肝窦区表达相对较少,模型组肝组织中PDPN在主要集中在纤维间隔,表达显著增加(P<0.001);提示肝纤维化进展中PDPN表达显著增加,在纤维间隔中表达增多(表2)。

表2 CCl4模型中PDPN及其mRNA表达分析Table 2 Statistics of PDPN protein and mRNA expression in two groups
2.3 PDPN主要表达在LSEC 为明确PDPN在肝脏中的来源,分离了小鼠肝脏中各种类型的原代细胞,PTPCR检测小鼠的肝细胞、LSEC、HSC、Kupffer细胞和BEC中PDPN的表达。结果表明,PDPN在LSEC中表达最高(图3)。提示肝脏PDPN主要来源于LSEC。
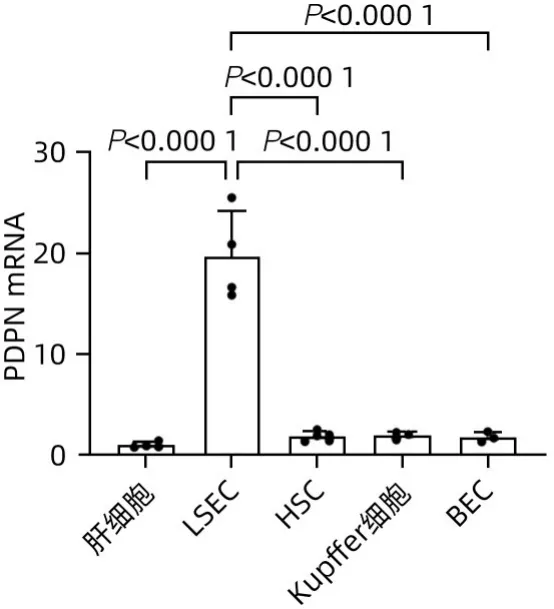
图3 小鼠肝脏各类型细胞中PDPN mRNA相对表达Figure 3 Relative expression of PDPN mRNA in various types of mouse liver cells
2.4 PDPN促进HSC活化相关通路 PDPN(100 ng/mL)处理原代小鼠HSC 15 min,RT-PCR检测炎症相关因子TNF-α、CCL3、CXCL1和CXCR1的mRNA表达,与对照组(PBS)相比,上述指标均显著升高(P值均<0.05),表明PDPN可促进HSC活化。BAY11-7082(NF-κB信号抑制剂)处理后,上述炎症指标水平均明显下降(P值均<0.05),表明在BAY11-7082处理HSC后,PDPN的促炎症效果显著降低(表3)。

表3 小鼠原代HSC中炎症指标水平Table 3 Expression of inflammatory in mouse primary HSC
3 讨论
肝纤维化是慢性肝损伤中的一个动态过程,各类慢性肝病和遗传相关疾病等均可导致肝纤维化[6]。其特征是细胞外基质增生与降解失衡,最终导致肝硬化[7]。活化的HSC是肝纤维化发生的细胞学基础,靶向HSC药物研究是目前的热点和难点,但尚未在人体研究中突显出疗效[8],这提示单方面将抗肝纤维化的研究聚焦在HSC上并不全面。
LSEC在维持肝内微循环稳态中起着关键作用[9],研究[10]发现LSEC与维持HSC静止和支持肝脏再生有关,但研究LSEC致肝纤维化报道较少。PDPN是一种黏蛋白跨膜蛋白[11]。最近研究[12]表明,PDPN在恶性肿瘤中高表达,如鳞状细胞癌、恶性间皮瘤,因此,PDPN也参与了肿瘤的形成和发展。另有研究[13]表明,PDPN在小鼠胆管结扎模型中表达升高,但PDPN参与肝纤维化进展的机制未见报道,本研究探讨了PDPN在HSC活化和肝纤维化中的作用。
本研究发现,在慢性乙型肝炎患者肝组织中PDPN的表达随着肝纤维化分期的增加而升高,并且与肝纤维化分期呈显著正相关,提示PDPN与肝纤维化进展密切相关。通过小鼠肝纤维化模型分析显示,PDPN主要分布在肝窦,主要在纤维间隔表达升高,再次证实PDPN与肝纤维化进展相关。通过对人和小鼠肝脏原代细胞分析发现,与肝细胞、HSC、Kupffer细胞及BEC相比较,PDPN高表达于LSEC。通过小鼠原代HSC发现,PDPN可显著诱导HSC炎症表达,提示PDPN可诱导HSC活化,而抑制NF-κB信号,PDPN诱导HSC炎症产生的能力显著被抑制,提示PDPN通过NF-κB诱导HSC活化促进肝纤维化进展。
综上所述,肝纤维化进展中,PDPN显著升高,肝脏中PDPN主要来源于LSEC,肝损伤后来源于LSEC的PDPN诱导NF-κB信号诱导HSC活化,促进肝纤维化进展。
伦理学声明:临床研究于2020年8月12日经由上海中医药大学附属普陀医院伦理委员会审批,批号:PTEC-2020-32(Y)-1,符合临床研究伦理规范。动物实验于2022年6月30日由上海中医药大学附属普陀医院实验动物伦理委员会审批,批号:QWEC-A-202206008,符合实验室动物管理与使用准则。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:王知意、杨广越、张玮、赵鑫负责实验操作及资料分析,撰写论文;马文婷、刘旭凌、吴柳、浦娅琼参与收集数据,修改论文;刘成、陶乐负责课题设计,指导撰写文章并最后定稿。
