高敏PCR在HBV极低病毒载量的慢性乙型肝炎患者中检测的临床意义
2024-03-28邱功钦谢丹陈姿任欧阳石
邱功钦, 谢丹, 陈姿任, 欧阳石
广州医科大学附属第五医院 a.感染性疾病科, b.广东高校生物靶向诊治与康复重点实验室, 广州 510000
HBV感染仍然是一个严重的全球公共卫生问题。全球约有2.96亿人为慢性HBV感染,每年约有150万新发感染者,乙型肝炎每年约导致82万人死亡,其中大部分死于乙型肝炎肝硬化和肝细胞癌[1]。核苷(酸)类似物(nucleotide analogues,NAs)抗病毒治疗可抑制HBV的持续复制,从而减轻肝细胞炎症、坏死及肝纤维化程度,延缓和减少终末期肝病事件的发生,改善HBV感染者的生活质量及延长生存时间[2-4]。近年来发现,即使在长期接受NAs药物治疗的患者中,仍有部分患者血清HBV DNA处于间歇或持续性低水平检出阳性状态,即存在低病毒血症(low-level viremia,LLV)[5]。已有研究[6-12]报道LLV患者预后不良,短期有增加耐药的风险以及病毒学突破的风险,长期可能增加肝纤维化进展和肝癌发生风险,并使肝癌患者的总体生存率更低。但是之前由于PCR检测灵敏度的限制,很多应用普敏PCR检测HBV DNA<100 IU/mL的人群被视为核酸定量阴性,随着高灵敏的实时荧光定量PCR应用,HBV DNA定量在10~99 IU/mL的这部分人群被发现。本文将HBV DNA在10~99 IU/mL的这部分定义为极低病毒载量(very low viral load,VLVL)。目前国内外尚未见VLVL的相关研究报道。本研究聚焦NAs经治≥48周、经普敏PCR检查HBV DNA(检测下限100 IU/mL)结果为阴性(低于检测下限)的慢性乙型肝炎(CHB)患者,进一步行高敏HBV DNA检测(检测下限10 IU/mL),以发现CHB患者中的VLVL人群,揭示该人群的临床特点及影响因素,为临床及时调整治疗方案提供精准实验室依据,为实现CHB精准治疗提供有意义的临床参考。
1 资料与方法
1.1 研究对象 收集2019年9月—2022年2月就诊于本院感染科接受NAs治疗的CHB患者的临床资料。纳入标准:(1)符合我国《慢性乙型肝炎防治指南(2019年版)》[13]中CHB的诊断标准;(2)年龄≥18岁;(3)接受NAs疗程≥48周;(4)本院普敏PCR(检测下限为100 IU/mL)检测HBV DNA均为阴性(低于检测下限),进一步行高敏PCR法(检测下限为10 IU/mL)检测HBV DNA的患者。排除标准:(1)合并甲、丙、丁、戊型肝炎或HIV感染者;(2)合并失代偿期肝硬化、酒精性肝病、药物性肝损伤、自身免疫性肝病、遗传代谢性肝病、肝癌等其他肝病;(3)合并其他严重脏器疾病或其他恶性肿瘤;(4)既往接受或目前正在使用干扰素、免疫抑制剂、细胞毒性药物治疗;(5)妊娠期或哺乳期妇女;(6)NAs抗病毒治疗依从性不佳者;(7)临床资料严重缺失,病史不全者。
1.2 观察指标 收集一般资料,包括年龄、性别、身体质量指数(BMI)、是否合并乙型肝炎肝硬化、NAs治疗时间;实验室指标:收集患者高敏PCR法检测HBV DNA结果及同期的血清病毒学指标,包括血清定量乙型肝炎表面抗原(qHBsAg)、HBeAg和前基因组RNA(pgRNA);此外,收集肝肾功能、血脂、血常规、AFP指标;无创肝纤维化指标:肝硬度测定值(liver stiffness measurements,LSM)、血小板比率指数(aspartate aminotransferase to platelet ratio index,APRI)。
1.3 研究方法 根据高敏HBV DNA结果分为VLVL组(HBV DNA 10~99 IU/mL)和完全病毒学应答(complete virology response,CVR)组(HBV DNA<10 IU/mL或未检测到)。HBV DNA<10 IU/mL表示出现PCR扩增曲线,在线性检测下限10 IU/mL以下但无法准确定量。HBV DNA未检测到表示PCR扩增荧光曲线无抬头。普敏HBV DNA方法采用HBV核酸测定试剂盒(PCR-荧光探针法,中山大学达安基因有限公司),检测下限100 IU/mL,检测上限5×108IU/mL,灵敏度30 IU/mL。高敏HBV DNA检测方法采用HBV核酸检测试剂盒(PCR-荧光法,Cobas 6800/8800检测系统,罗氏诊断产品有限公司),检测下限10 IU/mL,检测上限1×109IU/mL,灵敏度2.4 IU/mL。HBV血清学标志物(qHBsAg、HBeAg)采用(Cobas e 601分析仪,罗氏诊断产品有限公司);AFP采用电化学发光法(罗氏801原装试剂,罗氏E801全自动电化学发光分析仪),pgRNA检测采用HBV pgRNA检测试剂盒(中国广东广州SUPBIO生物技术有限公司),检测下限200 拷贝/mL,检测结果<200 拷贝/mL为阴性,≥200 拷贝/mL为阳性。血常规、血生化等指标均在本院检验科完成。LSM测定采用瞬时弹性成像技术(应用Fibroscan设备)。APRI=[AST/AST的正常值上限×100]/血小板计数(×109/L)。
1.4 统计学方法 采用SPSS 25.0软件进行统计分析。符合正态分布的计量资料以表示,两组间比较采用成组t检验;非正态分布的计量资料以M(P25~P75)表示,两组间比较采用Mann-WhitneyU检验。计数资料两组间比较采用χ2检验或Fisher精确检验。采用受试者工作特征曲线(ROC曲线)评价相关血清病毒学指标对高敏HBV DNA高于检测下限的预测价值。采用二元Logistic回归分析探讨未实现CVR的影响因素。P<0.05为差异有统计学意义。
2 结果
2.1 分组情况 本研究共纳入106例患者,其中血清HBV DNA未检测到52例,HBV DNA<10 IU/mL 30例,即CVR组共82例,占比77.4%。VLVL组(HBV DNA 10~99 IU/mL)24例,占比22.6%。
2.2 一般资料比较 106例患者中位年龄33.0岁,男性76例,中位BMI为21.9 kg/m2,14例诊断为乙型肝炎肝硬化,NAs治疗中位时长2.7年。其中,VLVL组患者年龄比CVR组更小(P=0.004)(表 1)。
2.3 临床特征比较 在血清生化学指标方面,VLVL组ALT水平明显高于CVR组(P=0.017)。肝纤维化指标方面,VLVL组FIB-4评分稍低于CVR组(P<0.001)。在HBV血清学指标方面,VLVL组qHBsAg水平、HBeAg阳性率均明显高于CVR组(P值均<0.05);106例CHB患者中有52例行HBV pgRNA检测,VLVL组pgRNA阳性率亦明显高于CVR组(P<0.05)(表2)。

表1 VLVL组和CVR组一般资料比较Table 1 Comparison of general characteristics between VLVL group and CVR group
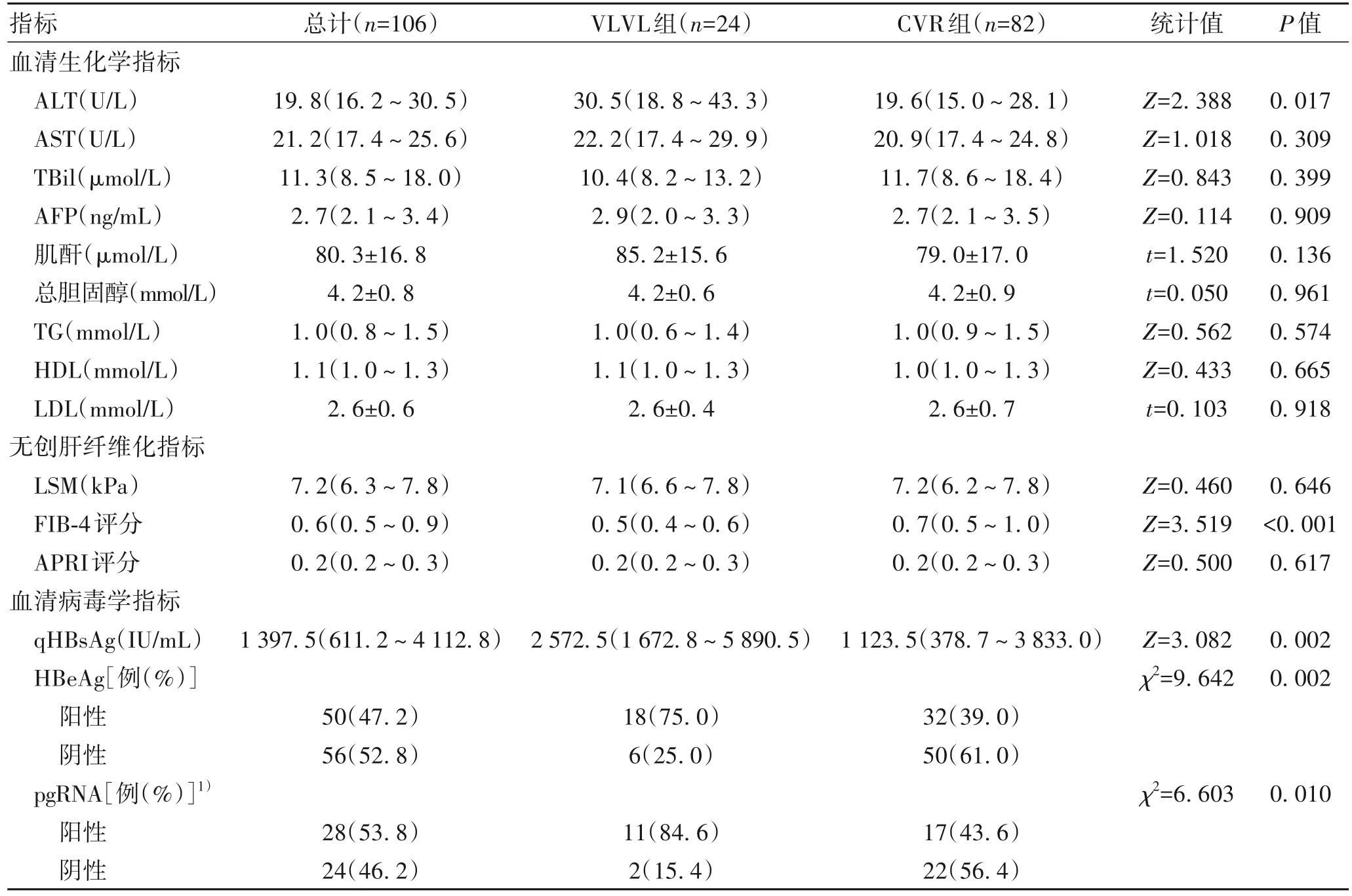
表2 VLVL组和CVR组临床特征比较Table 2 Comparison of clinical characteristics between VLVL group and CVR group
2.4 qHBsAg水平预测高敏HBV DNA高于检测下限的ROC曲线 将高敏HBV DNA检测结果10~99 IU/mL作为阳性事件,<10 IU/mL及未检测到作为阴性事件,应用ROC曲线分析qHBsAg水平预测高敏HBV DNA高于检测下限(>10 IU/mL)的价值。qHBsAg水平预测高敏HBV DNA高于检测下限(>10 IU/mL)的曲线下面积(AUC)为0.717(95%CI:0.615~0.818,P=0.002),当最佳cut-off值为1 214.5 IU/mL时,敏感度为95.5%,特异度为53.9%(图1)。
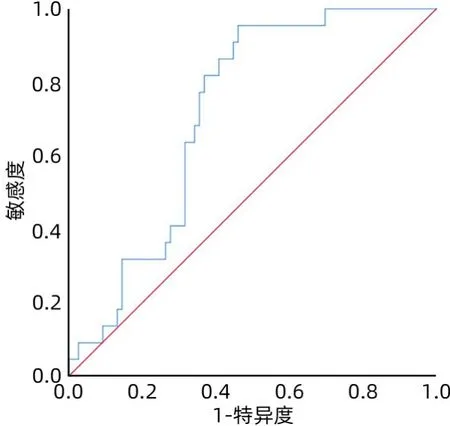
图1 qHBsAg水平预测高敏HBV DNA高于检测下限的ROC曲线Figure 1 ROC curve of qHBsAg titer prediction for highly sensitive HBV DNA above the lower detection limit
2.5 未实现CVR的影响因素分析 将单因素分析中具有统计学意义的指标(年龄、qHBsAg水平、HBeAg阳性)纳入Logistic回归分析,结果显示,HBeAg阳性(OR=3.654,P=0.027)和qHBsAg(OR=2.985,P=0.039)是未实现CVR的独立影响因素(表3)。

表3 二元Logistic回归分析未实现CVR的影响因素Table 3 Binary Logistic regression analysis of influencing factors of incomplete virology response
3 讨论
我国《慢性乙型肝炎防治指南(2022年版)》[2]中明确指出:对HBsAg阳性者,包括正在接受抗病毒治疗的CHB患者,应尽可能采用高灵敏且检测线性范围大的HBV DNA检测方法(定量下限为10~20 IU/ml)。同时也指出,CHB患者应用一线NAs治疗≥48周经高敏HBV DNA检测仍可检出者,建议调整NAs治疗方案或者联合干扰素治疗。由此可见HBV DNA定量检测是否“可检出”成为决定启动抗病毒治疗及判断治疗效果的重要指标。本研究回顾性收集了106例接受NAs治疗≥48周经普敏HBV DNA定量检测结果为低于检测下限的CHB患者,进一步行高敏HBV DNA检测,结果显示有超过50%的患者没有达到真正意义的CVR,其HBV DNA定量为10~99 IU/mL,并且这部分患者炎症损伤水平(尤其ALT水平)、qHBsAg水平、pgRNA阳性率以及HBeAg阳性率均显著高于CVR(HBV DNA>10 IU/mL)组。因此,高敏HBV DNA定量检测对于发现潜在慢性HBV感染VLVL患者具有重要意义,可作为HBV精准治疗策略的临床参考指标之一。临床医师不应忽视这部分患者,需及时行高敏HBV DNA检测。
有学者[5]提出NAs经治CHB患者发生LLV的可能机制与NAs药物作用机制的局限性以及NAs治疗时部分患者肝细胞的不活跃增殖状态相关,这部分患者通过换用或加用新的NAs药物可能难以彻底解决LLV问题,而近期的报道[14-15]均显示LLV亦有较高的炎症和纤维化进展风险。HBV感染者的ALT水平与肝脏炎症和纤维化程度密切相关[2]。已有研究[16-19]表明ALT在正常水平偏上限时,也会存在肝脏炎症和纤维化。本研究发现在普敏PCR检测中VLVL组往往会被归于“CVR”组,但经高敏PCR检测,实际患者仍然存在VLVL,而且其ALT水平显著高于CVR组,提示VLVL组因为病毒的存在而影响肝脏炎症和纤维化,提醒临床医生对于VLVL应重视。
qHBsAg水平作为临床上重要且常用的指标,不仅用于临床诊断,还可以反映HBV DNA的复制和预测疾病进展以及评估预后[20]。然而较少文献探究qHBsAg水平在NAs长期治疗CHB患者中VLVL的应用价值。本研究结果显示,VLVL组qHBsAg水平显著高于CVR组,且qHBsAg水平预测高敏HBV DNA高于检测下限(>10 IU/mL)的AUC为0.717,当最佳cut-off值为1 214.5 IU/mL时,敏感度为95.5%,特异度为53.9%。因此该指标具有一定的参考价值,在尚未开展高敏HBV检测的地区,若普敏HBV DNA结果显示低于检测下限,则可依据qHBsAg水平判断患者是否处于VLVL状态,以协助决策下一步治疗方案。
血清HBV pgRNA是共价闭合环状DNA(covalently closedcircular DNA,cccDNA)直接转录的产物,可以反映cccDNA的活性[21-23]。cccDNA是HBV前基因组RNA复制的原始模板,只有清除了细胞核内的cccDNA,才能彻底消除乙型肝炎患者病毒携带状态,以达到抗病毒的治疗目标[24]。尽管在本研究中,仅有52例(49%)患者行血清HBV pgRNA检测,但结果显示VLVL组pgRNA阳性率显著高于CVR组。提示VLVL状态的存在,是pgRNA无法彻底转阴的一个重要影响因素。
此外,本研究结果显示,HBeAg阳性和高qHBsAg水平是未实现CVR的独立影响因素。与Kim等[11]发现基线高HBsAg水平、HBeAg阳性均为CHB患者发生LLV的独立危险因素这一研究结论基本一致。这在疾病早期可以为临床医生的治疗方向提供参考。
值得注意的是,高敏HBV DNA检测结果报告包括“<10 IU/mL”“未检测到”这两种结果,已有学者[5,25]强调应该对此两种结果进行更为清晰地辨析,前者表示样本中有PCR扩增曲线、痕量DNA确实存在但无法准确定量,而后者表示未检测到目的基因。本研究曾尝试对“<10 IU/mL”“未检测到”进行独立分组,探讨这两种结果在临床特征方面有无差异,结果未见高敏HBV DNA“<10 IU/mL”与“未检测到”两组临床特征有统计学差异。有无必要对HBV DNA“存在但低于检测下限”和“未检测到”这两种结果进行区分,需要从临床和检验两个角度辩证看待,这两组的临床转归和长期预后有待进一步更大样本量的研究。
综上所述,对于普敏已达到所谓“CVR”的CHB患者,经高敏HBV DNA检测后,仍可发现部分患者实际上仍处于VLVL状态。对其临床特点分析发现,这部分VLVL患者炎症损伤水平、qHBsAg水平、pgRNA阳性率以及HBeAg阳性率均显著高于CVR组,提示临床工作中还需推广普及高敏HBV DNA检测,及早发现VLVL人群,及时调整治疗方案。
本研究也存在一定局限性。本研究属于单中心横断面研究,一方面后续可进一步长期追踪VLVL患者调整治疗策略后的肝脏炎症状态、纤维化程度以及pgRNA、qHBsAg变化情况;另一方面可进一步开展多中心更大样本量研究,以区分高敏HBV DNA“<10 IU/mL”与“未检测到”两种情况临床特征的差异。
伦理学声明:本研究方案于2023年3月28日经由广州医科大学附属第五医院伦理委员会审批,批号:GYWYL2023-60。
利益冲突声明:本研究不存在任何利益冲突。
作者贡献声明:邱功钦负责数据收集及分析,撰写论文,修改论文;谢丹、陈姿任负责修改和校对论文;欧阳石负责研究设计,拟定写作思路,指导撰写文章并最后定稿。
