茵陈蒿汤对自身免疫性肝炎小鼠肝细胞铁死亡的抑制作用及其机制分析
2024-03-28李竹蓉陈晨郭地吕思学武嘉文杨娜刘杨
李竹蓉, 陈晨, 郭地, 吕思学, 武嘉文, 杨娜, 刘杨
山西中医药大学基础医学院, 山西 晋中 030619
自身免疫性肝炎(AIH)是一种由自身抗体和自身反应性T淋巴细胞诱导的肝脏炎症,其特点是循环自身抗体升高、高丙种球蛋白血症和界面性肝炎,肝细胞免疫耐受性丧失,可进展为肝硬化甚至肝衰竭[1-4]。AIH主要发病人群为青少年及中老年女性。研究显示该病的发病率逐年上升。AIH在全世界的年发病率为1.37/10万人,其中亚洲人群的年发病率为1.31/10万人[5]。目前AIH的病因和发病机制尚不明确[6]。现行治疗AIH的策略是单独使用糖皮质激素或与硫唑嘌呤、免疫抑制剂组合。同时,为了保护肝脏、防止疾病的进展和肝功能的恶化,常规的治疗策略还包括保肝降酶等。然而,长期使用这些药物易使患者出现药物依赖性、耐药性及停药后复发率较高等问题,因此,亟需寻找安全有效的治疗方式[7]。
茵陈蒿汤出自医圣张仲景所作《伤寒杂病论》,该方由茵陈、栀子、大黄三味药组成,具有清热利湿、利胆退黄的功效。现代医学研究表明,茵陈蒿汤用于治疗AIH具有良好的临床疗效[8-9]。但有关茵陈蒿汤治疗AIH的基础实验研究较少,其生物学机制尚未完全阐释清楚。有研究表明,铁死亡参与多种疾病的发生发展过程。铁死亡是一种由铁依赖的脂质过氧化诱导的调节性细胞死亡形式。过量的铁会引发体内脂质过氧化,从而导致铁死亡。胱氨酸-还原型谷胱甘肽(GSH)-谷胱甘肽过氧化物酶4(GPX4)是经典的铁死亡抑制系统。在正常生理条件下,胱氨酸通过抗转运蛋白SLC7A11进入细胞参与GSH的合成。合成的GSH可以被GPX4消耗,进而将活性氧(ROS)转化为脂质醇抑制铁死亡,保护细胞免受氧化应激,维持膜脂质双分子稳态[10-11]。已有研究表明ROS诱导的氧化应激是多种肝脏疾病的潜在病理生理机制[12]。那么,茵陈蒿汤是否通过抑制铁死亡及其介导的氧化应激来改善AIH肝损伤,目前尚未见相关报道。因刀豆蛋白A(concanavalin A,Con A)诱导的免疫性肝损伤是一种典型且公认的AIH小鼠模型,其损伤过程非常类似于人类AIH的病理变化过程,故本文将采用Con A尾静脉注射制备免疫性肝炎小鼠模型,聚焦肝细胞铁死亡过程,探讨茵陈蒿汤对AIH小鼠肝细胞的保护作用机制,为将茵陈蒿汤用于AIH的临床治疗提供科学依据[13]。
1 材料与方法
1.1 主要仪器 A51119600全波长酶标仪(thermo scientific公司,美国),733BR4227显影仪(bio-rad公司,美国),374-706969C荧光酶标仪(thermo scientific公司,美国),041BR301185、041BR328905电泳仪及转膜仪(bio-rad公司,美国)等。
1.2 药物与试剂 茵陈蒿汤用量参考李冀等[14]主编《方剂学》:茵陈蒿18 g、栀子12 g、大黄6 g。茵陈蒿汤中茵陈(产地陕西,批号211026009),栀子(产地江西,批号211001),大黄(产地甘肃,批号210201)购自北京同仁堂。
GSH、AST、ALT、ROS、丙二醛(MDA)检测试剂盒(南京建成生物工程研究所,货号分别为A006-2-1、C010-2-1、C009-2-1、A003-1、E004-1-1),小鼠IFN-γ ELISA检测试剂盒(Bioswamp,货号MU30038),小鼠TNF-α ELISA检测试剂盒(Bioswamp,货号MU30030),Con A(索莱宝生物技术有限公司,货号C8110),ATP检测试剂盒(碧云天生物技术有限公司,货号S0027),铁离子检测试剂盒(Elabscience,货号E-BC-K772-M),GPX4单克隆抗体(Cell Signaling Technology,货号52455S),溶质载体家族7成员11(SLC7A11)多克隆抗体(Cell Signaling Technology,货号98051S),GAPDH抗体(Abways,货号AB0037),HRP-羊抗兔IgG(Abbkine,货号A21020)。
1.3 实验动物 8周龄SPF级雌性C57BL/6小鼠18只(19~25 g),购自斯贝福生物技术有限公司,动物生产许可证号:SCXK(京)2019-0010,动物使用许可证号:SYXK(晋)2020-0006。小鼠分笼饲养在室温20~25 ℃、湿度为55%环境中,自由饮水和饮食。
1.4 动物分组及给药剂量 小鼠适应性喂养1周,采用随机数字表法将小鼠分为3组:正常组、模型组、治疗组,每组6只。依据沈晗等[15]茵陈蒿汤煎煮工艺,依照人和动物体表系数折算法,计算所需的茵陈蒿汤药量,选用70 kg成人用量换算,茵陈蒿汤药量为4.68 g生药/kg,得到终药液浓度为0.47 g生药/mL,灌胃体积10 mL/kg,1次/d,持续2周;模型组和正常组以等体积生理盐水灌胃;模型组和治疗组于末次给药后2 h予Con A(15 mg/kg)行尾静脉注射造模,正常组尾静脉注射生理盐水。
1.5 取材 Con A尾静脉注射8 h后,采用戊巴比妥钠腹腔注射麻醉。取血后处死小鼠。血清-80 ℃保存备用。分离出肝脏、脾脏,生理盐水漂洗,用滤纸将肝、脾表面的生理盐水拭干,称重后部分组织于4%多聚甲醛内固定,其余部分-80 ℃保存备用。
1.6 检测指标及方法
1.6.1 肝脏、脾脏指数 测量小鼠处死前体质量及肝脏和脾脏的湿重。按照以下公式计算:脾脏指数=脾脏质量(mg)/体质量(g);肝脏指数=肝脏质量(mg)/体质量(g)。
1.6.2 血清转氨酶、炎症因子水平 检测各实验组小鼠血清ALT、AST、IFN-γ、TNF-α的含量。所有操作按照试剂盒说明书进行。
1.6.3 肝组织病理学检测 取肝组织右上叶放入4%多聚甲醛中固定,乙醇脱水、二甲苯透明、石蜡包埋、切片(片厚5 µm)。常规HE染色、中性树胶封片。光镜下观察肝组织坏死面积及淋巴细胞浸润程度。
1.6.4 肝组织中铁离子测定 准确称取肝组织重量,按重量(g)∶体积(mL)=1∶9的比例,称取20 mg肝组织后加入180 µL试剂一匀浆后,15 000×g离心5 min,取上清,用铁离子测定试剂盒,在593 nm波长处测定吸光度值,据说明书公式计算肝组织中铁离子含量。
1.6.5 测量肝组织GSH、MDA含量 准确称取组织重量,按重量(g)∶体积(mL)=1∶9的比例,加入9倍的生理盐水制成组织匀浆,离心取上清液待测。根据试剂盒说明书进行相关操作,分别在405 nm、532 nm波长处检测吸光度,计算肝组织内GSH、MDA含量。
1.6.6 测量肝组织中ROS含量 称取0.1 g组织,在PBS中剪碎漂洗后加入胰酶消化,尼龙网过滤,收集细胞,按1∶1 000的比例配制探针,加入探针混匀后37 ℃孵育45 min,PBS洗1遍,加入PBS重悬,使用荧光酶标仪在激发波长488 nm,发射波长525 nm处测定荧光度值,所有操作均按照说明书要求进行。
1.6.7 测量肝组织中ATP含量 称取20 mg肝组织,按说明书要求加入150 µL ATP检测裂解液匀浆。取上清加入ATP检测工作液,使用荧光酶标仪测定化学发光水平,按照说明书公式计算肝组织内ATP水平。
1.6.8 Western Blot法检测肝组织GPX4蛋白表达 根据裂解液说明书,按20 mg组织加入250 µL含1%蛋白酶抑制剂的RIPA裂解液进行组织匀浆,离心取上清。SDS-PAGE凝胶电泳后转移到PVDF膜上,5%脱脂牛奶封闭2 h,加一抗GPX4(1∶1 000)、SLC7A11(1∶1 000)4 ℃孵育过夜后,TBST清洗,室温孵育二抗GAPDH(1∶50 000)2 h,TBST清洗,加入ECL试剂,用显影仪成像。采用ImageJ软件分析条带灰度值。
1.7 统计学方法 使用SPSS 25.0分析数据,计量资料采用表示,3组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 茵陈蒿汤对小鼠肝脏、脾脏指数及肝功能的影响与正常组比较,模型组小鼠肝脏指数、脾脏指数均明显升高(P值均<0.01),与模型组相比,治疗组小鼠肝脏指数、脾脏指数均降低(P值均<0.01)。模型组血清ALT和AST水平较正常组均显著升高(P值均<0.01),治疗组小鼠血清ALT和AST水平较模型组均明显降低(P值均<0.01)(表1)。
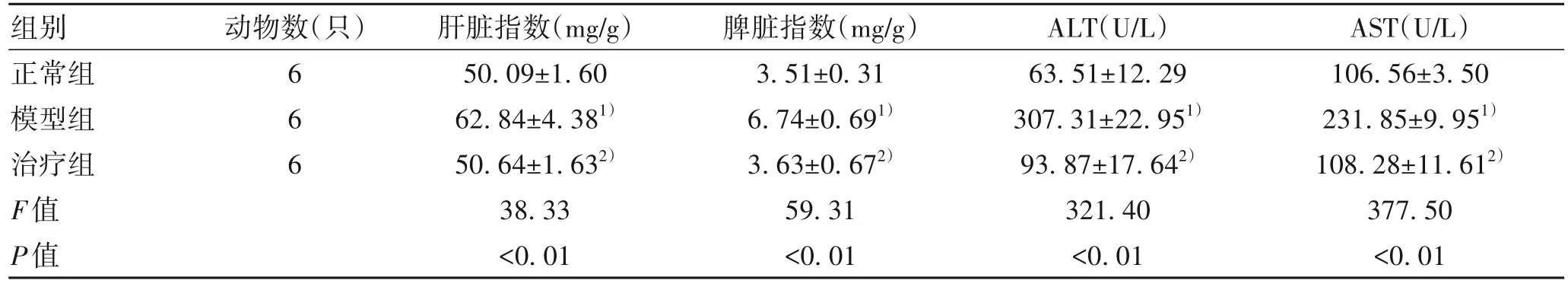
表1 茵陈蒿汤对小鼠肝/脾指数、血清ALT和AST水平的影响Table 1 Effect of Yinchenhao decoction on liver and spleen index, serum ALT and AST levels in mice
2.2 茵陈蒿汤对小鼠肝组织中ROS产生、Fe、MDA、GSH、ATP水平的影响 与正常组相比,模型组肝组织ROS产生量、Fe和MDA水平均显著升高(P值均<0.01),GSH和ATP水平显著降低(P值均<0.05)。与模型组相比,治疗组肝组织ROS产生量、铁离子和MDA水平显著降低(P值均<0.01),GSH和ATP水平显著升高(P值均<0.01)(表2)。
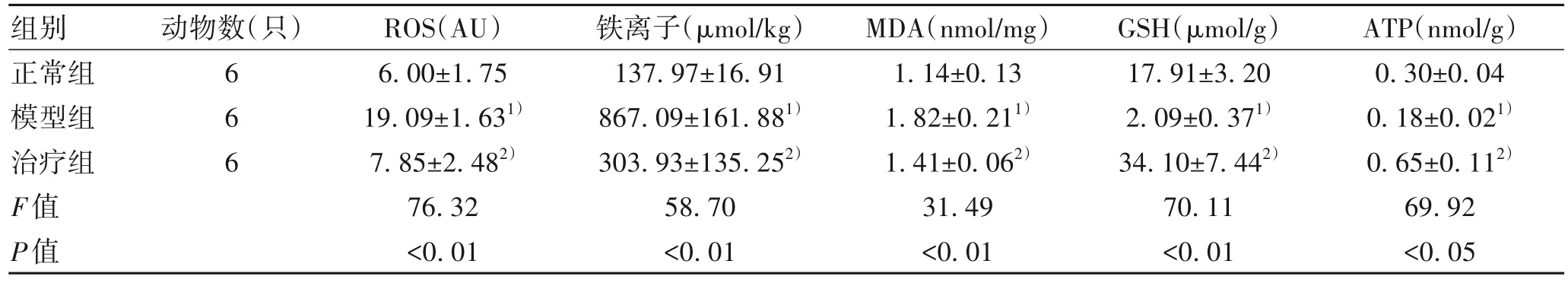
表2 茵陈蒿汤对小鼠肝组织中ROS产生、铁离子、MDA、GSH、ATP水平的影响Table 2 Effects of Yinchenhao decoction on ROS production, Fe, MDA, GSH and ATP levels in liver tissue of mice
2.3 茵陈蒿汤对小鼠肝组织形态学的影响 HE染色结果显示正常组肝组织完整,肝小叶清晰,肝细胞规则排列;在模型组中,出现大面积肝细胞变性、坏死,门管区炎细胞聚集等病理变化;茵陈蒿汤治疗组肝组织病变的程度显著改善,坏死面积较模型组明显减少,肝小叶尚清晰(图1)。
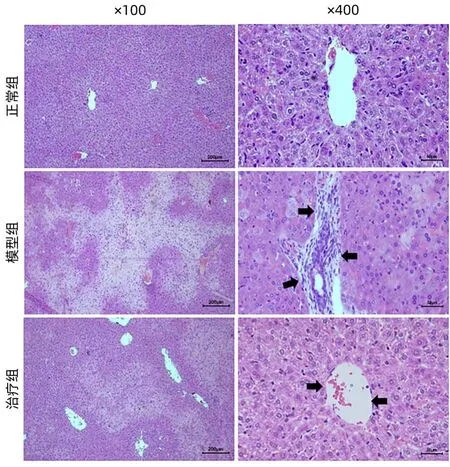
图1 茵陈蒿汤对小鼠肝组织形态学的影响(HE染色)Figure 1 Effect of Yinchenhao decoction on liver morphology of mice (HE staining)
2.4 茵陈蒿汤对小鼠血清炎症因子的影响 与正常组相比,模型组血清IFN-γ、TNF-α水平均升高(P值均<0.05);与模型组相比,治疗组IFN-γ、TNF-α水平明显降低(P值均<0.05)(表3)。

表3 茵陈蒿汤对Con A诱导肝损伤小鼠血清IFN-γ、TNF-α的影响Table 3 Effects of Yinchenhao decoction on serum IFN-γ and TNF-α production in mice with Con A induced liver injury
2.5 茵陈蒿汤对小鼠肝组织中GPX4和SLC7A11蛋白表达的影响 模型组GPX4和SLC7A11蛋白表达水平较正常组显著降低(P值均<0.01);与模型组相比,治疗组GPX4和SLC7A11蛋白表达水平均明显升高(P值均<0.01)(图2)。

图2 茵陈蒿汤对小鼠肝组织中GPX4和SLC7A11蛋白表达的影响Figure 2 Effect of Yinchenhao decoction on GPX4 and SLC7A11 protein expression in liver tissue of mice
3 讨论
AIH是一种慢性、难治性疾病,其发病与多种因素有关,AIH治疗主要目标是通过控制肝脏炎症反应,使血清ALT、AST、IgG水平恢复正常,肝组织内炎症消失[16-18]。根据《自身免疫性肝炎诊断和治疗指南(2021)》[19],临床目前仍主要采用泼尼松(龙)联合硫唑嘌呤或者单用泼尼松(龙)的非特异性疗法。该方案虽可显著改善大多数中重度AIH患者的肝生化指标,但至少有10%~15%的患者对上述治疗方案应答不佳,另有部分患者不能耐受药物的不良反应(如股骨头缺血性坏死、血细胞减少等)或停药后复发,因此亟需寻求更佳的治疗药物。研究[20-21]发现茵陈蒿汤可在病毒性肝炎、非酒精性脂肪性肝病中使升高的ALT、AST、TNF-α恢复至正常水平,可以降低血脂、血糖,改善肝脂肪代谢,降低炎性反应,减轻肝损伤。研究[22-24]表明其减轻肝损伤主要表现在改善脂质代谢、平衡肠道菌群和调节线粒体功能,其醇提物在抗炎及抗氧化、降低MDA含量等方面效果显著。现代研究认为,茵陈蒿汤中的主要成分有槲皮素、β-谷甾醇、大黄素、山奈酚等,而槲皮素、β-谷甾醇、大黄酸等成分具有免疫调节、抗炎、抗氧化、降脂和保肝等作用,可诱导细胞自噬对肝细胞起到保护作用[25-27]。本次实验发现,模型组小鼠血清ALT和AST水平升高;同时,在AIH病理进展中起重要作用的炎性细胞因子TNF-α、IFN-γ水平升高,提示Con A诱导的AIH实验小鼠存在肝脏炎症,而治疗组ALT、AST及TNF-α、IFN-γ水平均明显降低,提示茵陈蒿汤对Con A诱导的小鼠免疫性肝损伤具有潜在的保护作用。
铁死亡是一种调节性的细胞死亡形式,其特征是铁依赖性的脂质过氧化积累[28-29]。研究表明铁死亡与Xc-系统的功能密切相关。Xc-系统是位于细胞膜上的一种氨基酸转运蛋白,是由SLC7A11和SLC3A2两个亚基组成的异二聚体,是细胞中重要抗氧化系统的一部分。胱氨酸和谷氨酸通过Xc-系统中的胱氨酸/谷氨酸抗转运蛋白SLC7A11以1∶1的比例交换进出细胞,被吸收的胱氨酸在细胞中还原为半胱氨酸,参与GSH的合成[10]。GPX4是多种细胞类型中铁死亡的关键调节酶,具有抗氧化防御作用,可以通过消耗GSH将脂质ROS转化为脂质醇,从而保护细胞免受铁死亡[11]。当Xc-系统失衡时,超负荷游离铁累积可导致各种肝脏疾病,铁过载通过芬顿反应诱导ROS产生增多,导致氧化损伤和细胞死亡,从而诱发铁死亡[30]。肝脏是体内主要的储铁部位,当发生铁死亡时,肝脏内游离的铁离子增加会加重肝脏负荷,从而造成肝损伤。相关研究[31]表明,肾脏组织中由铁死亡引起的细胞死亡与GPX4基因缺失有关。GPX4对于预防脂质过氧化和铁死亡的有害影响至关重要,有研究[12]表明,铁死亡是AIH发病机制的启动剂或介质,并且AIH中铁死亡的发生受GPX4的调节。而GPX4的合成受胱氨酸转运蛋白SLC7A11的影响。通过建立免疫性肝炎小鼠模型,本研究发现模型小鼠肝组织中GPX4和SLC7A11蛋白表达水平显著降低,茵陈蒿汤治疗组小鼠肝组织中GPX4和SLC7A11蛋白表达水平显著升高,这些结果表明茵陈蒿汤可以调控Con A对小鼠肝组织Xc-系统的抑制作用。
脂质ROS的积累是铁死亡的重要标志物,Xc-系统受到抑制会导致胱氨酸的吸收减少从而影响GSH的合成,导致GPX4活性降低,细胞抗氧化能力下降,脂质ROS积累,高水平的ROS会对DNA、蛋白质和膜脂质造成氧化损伤,并促进脂质过氧化的发生,导致脂质过氧化的终产物MDA含量增加,最终发生氧化损伤和铁死亡[32]。本研究显示Con A显著增强了肝细胞内的ROS、铁离子的累积,并减少了GSH含量及SLC7A11和GPX4蛋白表达水平,提示Con A可能诱导肝组织发生铁死亡。茵陈蒿汤显著抑制了Con A诱导的肝脏内ROS产生的增加以及肝组织MDA含量的升高,使肝脏内GSH含量升高,表明茵陈蒿汤可能通过增强肝组织的抗氧化作用,从而抑制铁死亡的发生。
综上所述,本研究结果显示Con A注射后导致Xc-系统失衡,诱导小鼠肝组织发生铁死亡。茵陈蒿汤通过增加Xc-系统中GPX4和SLC7A11蛋白表达水平抑制铁死亡起到肝保护作用。因此,本研究结果表明茵陈蒿汤的肝保护作用机制与可能与增强GPX4和SLC7A11蛋白表达从而抑制铁死亡相关,为茵陈蒿汤临床治疗AIH的中医药现代化研究提供了数据支持和依据。由于人与动物的代谢酶、药物分布以及肠道吸收度等均有不同,中药的药代动力学在人体和动物之间可能存在一定差异,因此,本研究结果进行临床转化尚需进一步的研究工作。
伦理学声明:本研究方案于2021年9月29日经由山西中医药大学实验动物伦理委员会审批,批号:2019LL41。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:李竹蓉负责设计论文框架,起草论文及研究过程的实施;陈晨、郭地负责实验操作,数据收集;吕思学、武嘉文负责统计学分析;杨娜、刘杨负责论文修改;刘杨负责拟定写作思路,指导撰写文章并最后定稿。
