基于网络药理学和分子对接探讨扶正化纤方治疗特发性肺纤维化的机制
2024-03-28魏祎叶海燕赵国静宋欢孙英周佩夏王坤胡海波陆学超
魏祎,叶海燕,赵国静,宋欢,孙英,周佩夏,王坤,胡海波,陆学超
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一种慢性、进行性和不可逆的呼吸系统疾病,其特征是以肺泡上皮细胞损伤、成纤维细胞活化和胶原纤维大量沉积为特征的进行性肺部疾病[1-2]。IPF 死亡率较高,临床研究发现,其平均生存率为3~5 年[3]。吡非尼酮和尼达尼布是目前市场上仅有的2 种被批准用于治疗IPF 的药物[4-5]。然而吡非尼酮和尼达尼布不能延长患者的生存期,并且存在耐受性、不良反应等问题,因此迫切需要开发安全、有效的治疗药物。中医由于其独特的理论和悠久的实践历史,在世界范围内逐渐受到广泛关注。与现代医学不同,中医理论更注重的是辨证论治和整体论治。扶正化纤方由补骨脂、冬瓜子、茯苓、甘草、红景天、黄芪、款冬花、麦冬、三七、山茱萸、太子参、五味子、杏仁、薏苡仁及地龙组成,是全国名老中医周兆山教授提出的用于治疗IPF 的验方。根据本课题组前期随机、双盲实验研究发现,该方剂治疗IPF 有较好的临床疗效[6]。本课题组前期的动物实验研究发现,扶正化纤方可以减轻博来霉素诱导的IPF 小鼠模型肺组织炎症和胶原沉积[7]。
随着系统生物学研究领域的发展,“一个靶点、一种药物”的传统模式逐渐转变为“网络靶点、多组分疗法”模式。网络药理学是系统生物学和网络信息学相结合的综合性学科,可用于在系统层面上分析多组分药物对人体的影响,这有助于研究者找到药物有效活性成分的治疗靶点,提高药物的疗效,减少不良反应[8]。同时,中医整体观的指导思想、方剂配伍的整体协同机制与网络药理学倡导的药物研发模式相契合。分子对接是一种广泛应用于药物发现的基于计算机结构的方法,重点是对分子间相互作用开展研究分析,并对其中存在的亲和力及结合模式加以预测[9]。本研究基于网络药理学,探索扶正化纤方抗IPF 的分子机制,进行分子对接以验证活性化合物与关键靶点之间的亲和力,探索扶正化纤方治疗IPF 的潜力。
1 方法
1.1 药物有效成分与靶点的筛选 通过TCMSP数据库(https://tcmspw.com/tcmsp.php)、HERB 数据库(herb.ac.cn)检索补骨脂、冬瓜子、茯苓、甘草、红景天、黄芪、款冬花、麦冬、三七、山茱萸、太子参、五味子、杏仁、薏苡仁及地龙的成分。根据参考文献,将筛选条件设定为口服生物利用度(oral bioavailability, OB)≥30%,类药性(drug-likeness, DL)≥0.18[10]。并通过TCMSP 数据库寻找药物活性成分的对应靶点,TCMSP 数据库中未收录的药物通过HERB 数据库,查阅相关文献资料[11]补充检索,获取活性成分。通过PubChem 数据库、Swiss Target Prediction 数据库补充药物靶点。Uniport 数据库(https://www.uniprot.org/)用于靶点的校正,去掉非人类靶点,一共获得333 个靶点。
1.2 “特发性肺间质纤维化”疾病靶点的搜集 以“idiopathic pulmonary fibrosis”为关键词,在Gene-Cards 数据库(https://www.genecards.org/)中进行人类基因检索,并删除Score 值为0 的靶点。
1.3 交集靶点韦恩图及蛋白相互作用(protein-protein interaction, PPI)网络的构建 利用R 语言4.1.3 软件Venn 包筛选出药物活性成分对应的靶点与疾病的共有靶点,并绘制韦恩图。二者的交集靶点输入String 数据库(https://string-db.org/cgi/input.pl)构建PPI 网络图,结果文件输入Cytoscape软件进行可视化分析,根据Degree 值寻找核心靶点。同时利用Cytoscape 软件构建“药物-活性成分-靶点-疾病”的网络图。
1.4 基因本体(gene ontology, GO)富集分析与京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes, KEGG)富集分析 通过R 语言4.1.3软件将药物疾病共有靶点及疾病靶点进行GO 富集分析和KEGG 通路富集分析,安装并引用gglpot2包,分别进行图形绘制。
1.5 分子对接实验 根据药物活性成分的CAS 号从数据库中下载活性成分的3D 结构。从PDB(http://www.rcsb.org/)数据库下载关键蛋白。采用AutoDock Vina 1.1.2 进行对接。
2 结果
2.1 扶正化纤方中药物的有效活性成分与作用靶点 经汇总删重后,本研究筛选得到扶正化纤方中具有潜在作用的有效化学成分共174 个,根据Degree 值排名,排名前20 的活性成分见表1。扶正化纤方中药物的作用靶点有333 个。

表1 关键成分信息表
2.2 扶正化纤方作用靶点与IPF 的交集靶点筛选 筛选得到的扶正化纤方333 个靶点与IPF 疾病相关的3 509 个靶点,利用R 语言Venn 包寻找交集靶点。结果发现两者共有234 个靶点,可作为药物作用于疾病的预测靶点进行之后的通路富集分析。见图1。
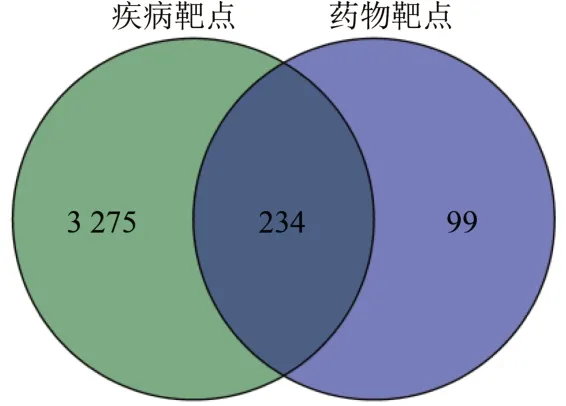
图1 扶正化纤方-特发性肺纤维化交集靶点韦恩图
2.3 扶正化纤方-IPF 交集靶点的PPI 网络构建 通过String 数据库构建PPI 网络,该网络中有234 个节点,4 292 条边,平均Degree 值为15.5;再将String 网站导出的PPI 网络导入Cytoscape 3.9.1软件,绘制PPI 网络图,见图2。此外,本研究还构建了“药物-活性成分-靶点-疾病”网络图,可以更加直观地观察药物活性成分与疾病靶点之间的作用关系,见图3。

图2 Cytoscape 软件绘制得到的PPI 网络图(节点颜色和大小根据Degree 值调整)

图3 药物-成分-靶点-疾病网络图

图4 扶正化纤方治疗IPF 的GO 功能富集分析以及KEGG 通路分析
2.4 扶正化纤方-IPF 交集靶点的拓扑分析 通过CytoNCA 工具进行拓扑分析,共筛选得到84 个关键靶点,排名前20 位的靶点见表2。结果发现,丝氨酸/苏氨酸蛋白激酶1(serine/threonine kinase 1,AKT1)、肿瘤坏死因子(tumor necrosis factor, TNF)、肿瘤蛋白P53(tumor protein 53, TP53)、血管内皮生长因子A (vascular endothelial growth factor A, VEGFA)等可能是扶正化纤方治疗IPF 的潜在核心靶点。

表2 排名前20 位扶正化纤方-IPF 交集核心靶点的拓扑分析
2.5 GO 功能与KEGG 通路富集分析 进一步分析扶正化纤方治疗IPF 的信号通路,其中GO 功能总共富集到2 669 条生物过程,225 项分子功能相关,95 项细胞组成相关。KEGG 通路总共富集到178 条信号通路。KEGG 通路富集分析表明扶正化纤方治疗IPF 主要涉及晚期糖基化终产物受体(advanced glycation end product-receptor for advanced glycation end-product, AGE-RAGE)信号通路、磷脂酰肌醇-3 激酶/蛋白激酶B (phosphatidylinositol 3-kinase/protein kinase B, PI3K/AKT)信号通路、白细胞介素(interleukin, IL)-17 信号通路。见表2。
2.6 分子对接结果 将表1 中Degree 值排名前6位的活性成分与关键靶点VEGFA、TP53、STAT3、CASP3、AKT1、TNF 进行分子对接和结合能力预测。结合能越小,表明受体与配体蛋白之间的亲和力越大,见图5。其中槲皮素(MOL000098)和TNF 结合能最小、β-谷固醇(MOL000358)和TNF 结合能为其次,进行可视化处理。见图6~7。

图5 活性成分-靶点结合能热图
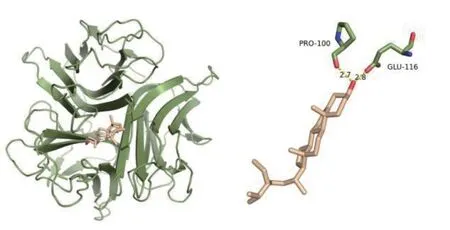
图7 β-谷固醇(MOL000358)和TNF 蛋白的结合能为-9.0 kcal/mol
3 讨论
IPF 的发病机制尚未完全阐明,炎症、氧化应激、自噬不足等是其重要发病机制之一。根据其病因、症状,可以将其归于中医学“肺痿”“肺痹”的范畴。基于多年临床经验,周兆山教授自拟扶正化纤方,全方共15 味药,方中黄芪补益肺气,太子参、麦冬、五味子三药合用,兼具补、润、敛之效,上述四药合用,大补肺之气阴;山茱萸、补骨脂收涩固脱,二药合用补助肾气以治其本;薏苡仁、茯苓、冬瓜子淡渗利湿,行水消肿;三七、红景天活血补血,调畅肺之气血;地龙通达肺络。该方已经在临床上用于IPF 的治疗,且取得良好的临床疗效[6]。
根据网络药理学结果显示,扶正化纤方作用于IPF 的主要活性成分有槲皮素、木犀草素、山柰酚、甘草查尔酮A 等。体外试验发现槲皮素可以减少肺组织胶原蛋白的沉积,降低肺纤维化模型大鼠肺泡灌洗液中促纤维化介质的浓度,如IL-13、TNF等[12-13]。富含胶原蛋白的细胞外基质(extracellular matrix, ECM)的异常沉积是IPF 的一个重要病理特征。据实验研究发现,木犀草素通过降低I 型胶原蛋白(collagen Ⅰ)、平滑肌肌动蛋白、钙黏蛋白E(Ecadherin)的表达,从而抑制ECM 重塑[14]。此外,有研究报道,木犀草素可以通过调控NLRP3/IL-1β/TGF-β1 信号轴,从抗炎、抗胶原沉积2 个方面共同发挥缓解IPF 的作用[15]。山柰酚可通过抑制mTOR信号通路,下调基质金属蛋白酶(matrix metalloproteinases, MMPs)家族中MMP-9 和MMP-2 的表达,发挥缓解ECM 过度沉积的作用[16]。甘草查尔酮A具有抗炎、抗氧化应激、免疫促进等多种生物活性。动物实验研究发现,甘草查尔酮A 可以通过抑制TGF-β1/Smad 信号通路阻止成纤维细胞活化,下调细胞外基质如collagen I 等表达[17],还可以调控ERK1/2/NF-κB 信号通路缓解肺组织炎症反应[18]。
本研究预测AKT1、TNF、TP53、VEGFA 等可能是扶正化纤方治疗IPF 的潜在核心靶点。AKT1 既可以调节炎症反应的关键转录因子NF-κB 的活性,减少炎性细胞因子的产生,又可以调节炎症相关的下游产物的活性,例如环氧合酶2。此外,AKT1 与TGF-β1 的激活密切相关。TNF-α则是典型的炎症因子。在肺纤维化患者的肺组织中可以检测到TP53 的高表达。研究表明,TP53 可以影响肺上皮细胞的上皮间充质转化(epithelial mesenchymal transition, EMT)过程,促进肺纤维化的发展[19]。VEGFA 在促进血管生成方面起着至关重要的作用,并已经被证明可以刺激成纤维细胞增殖、迁移和激活[20]。
KEGG 通路富集分析发现扶正化纤方的活性成分主要通过AGE-RAGE 信号通路、PI3K/AKT 信号通路、IL-17 信号通路等干预IPF。根据临床研究发现,IPF 患者存在AGE/RAGE 失衡,AGE 水平升高,RAGE 表达降低,AGE/RAGE 过度升高可导致纤维化进展加快和肺功能持续下降。AGE/RAGE 信号通路的激活也可介导EMT,进一步导致纤维化[21]。PI3K/AKT 信号通路也在IPF 发展过程中起着重要作用。越来越多的证据表明,TGF-β1 的过度表达与PI3K/AKT 信号通路激活密切相关,二者的相互作用促进了肺纤维化形成[22]。IL-17 由辅助T 细胞17(T helper cell 17, Th17)特异性分泌,参与多种慢性炎症疾病和自身免疫性疾病[23]。根据前期动物实验验证,IPF 小鼠模型中IL-17A 表达升高,IL-17A相关的信号通路被激活[7],应用IL-17A 拮抗剂可以抑制IPF 小鼠肺组织的慢性炎症和纤维化进程[24]。
本研究通过网络药理学对扶正化纤方治疗IPF的作用机制进行了全面、系统的分析,发现扶正化纤方具有复杂的活性成分,并可以通过多靶点、多系统、多通路发挥对IPF 的治疗作用,为治疗IPF 的新药研发提供了一定的科学依据。
