异位表达LncRNA PVT1/EIF4A1促进胃癌细胞增殖迁移的作用研究
2024-03-28黄景鸿张蕾张伟梁伟华蒋金芳郑志红潘泽民李冬妹
黄景鸿 张蕾 张伟 梁伟华 蒋金芳 郑志红 潘泽民 李冬妹


摘要:目的 探索長链非编码RNA 人浆细胞瘤转化迁移基因1(plasmacytoma variant translocation 1,PVT1)协同真核翻译起始因子4A1(human eukaryotic translation initiation factor4A1,EIF4A1)促进人胃癌细胞SGC-7901增殖与迁移能力的作用。方法 使用Western Blot检测EIF4A1、real time-PCR检测PVT1在胃癌细胞(SGC-7901、NCI-N87、MGC-803、BGC-823)和正常胃黏膜细胞(GES-1)中的表达量。单独或共同过表达胃癌细胞SGC-7901中的PVT1和EIF4A1,EIF4A1的蛋白表达量使用免疫印迹法检测,PVT1的表达水平使用real time-PCR检测,采用划痕实验和Transwell实验检验细胞的迁移能力,采用MTT实验和平板克隆形成法检验细胞的增殖情况,采用免疫印迹法检测E-cadherin,N-cadherin,smad3和TGF-β蛋白表达量。结果 以正常胃黏膜细胞作为对照,筛选有统计学差异的PVT1和EIF4A1的本底表达量低的胃癌细胞(P<0.05)。单独或共同过表达胃癌细胞中PVT1和EIF4A1后,共同过表达组平板克隆形成数为492±8.72,单独过表达PVT1组平板克隆形成数为251±1.53,单独过表达EIF4A1组平板克隆形成数为228±1.52,对照组平板克隆形成数为205±2.08。在MTT实验中,共同过表达组OD值高于单独过表达组和对照组。Transwell结果显示共同过表达组迁移细胞数为308±29.10,单独过表达PVT1组迁移细胞数为222±14.42,单独过表达EIF4A1组迁移细胞数为206±10.58,对照组迁移细胞数为169±18.04。划痕实验结果提示共同过表达组伤痕愈合速率高于单独过表达组和对照组。免疫印迹结果说明共同过表达组E-cadherin低于单独过表达组和对照组,共同过表达组N-cadherin、smad3和TGF-β高于单独过表达组和对照组。以上结果均具有统计学差异(P<0.05)。结论 过表达PVT1和EIF4A1可以协同促进SGC-7901细胞的增殖能力,并通过改变EMT相关蛋白的表达促进胃癌细胞SGC-7901的迁移能力。
关键词:胃癌;PVT1;EIF4A1;细胞增殖;细胞迁移
中图分类号:R34中图分类号文献标志码:A文献标识码
Study on the effect of ectopic expression of LncRNA PVT1/EIF4A1 on the
proliferation and migration of gastric cancer cells
HUANG Jinghong1,ZHANG Lei2,ZHANG Wei3,LIANG Weihua1,JIANG Jinfang1,
ZHENG Zhihong1,PAN Zemin1,LI Dongmei1*
(1 School of Medicine/Key Laboratory of Xinjiang Ministry of Education, Shihezi University, Shihezi,Xinjiang 832002, China;
2 The First
Affiliated Hospital, School of Medicine, Shihezi University, Shihezi,Xinjiang 832002, China;
3 Emergency General Surgery Department, Shihezi People′s Hospital, Shihezi,Xinjiang 832002, China)
Abstract: Objective Explore the effect of long non-coding RNA human plasmacytoma variant translocation 1 (PVT1) and human eukaryotic translation initiation factor4A1 (EIF4A1) on the proliferation and migration of gastric cancer (GC) cell SGC-7901. Methods Used Western Blot to detect EIF4A1 and real time-PCR to detect PVT1 in GC cells (SGC-7901, NCI-N87, MGC-803, BGC-823) and normal gastric mucosal cells (GES-1). Ectopic expressed PVT1 and EIF4A1 in GC cell SGC-7901 individually or together. Used Western Blot to detect the protein expression of EIF4A1. And used real time-PCR to detect the expression level of PVT1. Detected the migration ability of cells by the scratch test and the transwell assay. The proliferative ability of the cells was detected by the MTT and the clone formation assay. And the protein level of E-cadherin, N-cadherin, smad3 and TGF-β was detected by Western Blot. Results GC cells with low background expression of PVT1 and EIF4A1 were screened, and there was a statistical difference (P<0.05). After ectopic expression of PVT1 and EIF4A1 individually or jointly, the number of plate clone formation in the co-ectopic expression group was 492±8.72. The number of plate colonies formed in the PVT1 ectopic expression group alone was 251±1.53. And that in the EIF4A1 ectopic expression group and control group was 228±1.52 and 205±2.08 respectively. In MTT assay, the OD value of co-ectopic expression group was higher than that of individual ectopic expression group and control group. In the transwell assay, the number of migrated cells of the co-ectopic expression group was 308±29.10, and in the PVT1 ectopic expression group, EIF4A1 ectopic expression group and control group was 222±14.42, 206±10.58, and169±18.04 respectively. Cell scratch tests showed the wound healing rate in the co-ectopic expression group was higher than that in the individual ectopic expression group and the control group. The results of Western Blot showed that E-cadherin in the ectopic expression group was lower than that in the ectopic expression group and control group. N-cadherin, smad3 and TGF-β in the ectopic expression group were higher than those in the individual ectopic expression group and control group. All of these results were statistically significant (P<0.05). Conclusion Ectopic expression of PVT1 and EIF4A1 can promote the proliferation ability and migration ability of SGC-7901 cells by altering the expression of EMT related proteins.
Key words: gastric cancer;PVT1;EIF4A1;cell proliferation;cell migration
胃癌死亡率在世界肿瘤死亡率中排名第三[1],我国胃癌死亡率占世界40%[2],很多患者就诊时已经发展到中晚期,造成患者死亡的重要原因是癌细胞转移[3]。长链非编码RNA(long non-coding RNA,lncRNA)是一种调节性RNA,在组织中PVT1表达具有特异性。lncRNA 影响细胞分化、运动等生命过程,其机制涉及与蛋白质的相互作用[4],可以是指引核糖核蛋白体定位;结合并激活目标蛋白质;也可以和蛋白质互为分子支架协同发挥作用[5],由于lncRNA影响多基因表达,肿瘤发生发展又是多基因变异的复杂过程,因此对lncRNA和其关键分子的干预将起到网络式调节作用,在肿瘤靶向治疗中可能具有更加明显的效果,是比较理想的候选靶点,近年来已被广泛关注。
LncRNA 人浆细胞瘤转化迁移基因 1(plasmacytoma variant translocation 1,PVT1)在人类染色体8q24上[6],位于癌基因MYC上游的癌相关区域。PVT1在多种肿瘤中异常过表达,是近年来LncRNA相关研究的热点。PVT1可以直接调节RNA、DNA和蛋白质的表达[7]。PVT1在一些肿瘤中高表达能抑制肿瘤细胞的凋亡过程[8]。同时,PVT1可被EIF4A3稳定,从而促进肺癌的增殖与迁移侵袭能力[9]。此外,PVT1还起到了调控下游基因和途径的作用。例如在肺癌中,PVT1可将EZH2募集到LAST2启动子区域并抑制非小细胞肺癌患者LAST2的表达[10],PVT1也可通过与miR-128内源性竞争来调节血管内皮生长因子C的表达,从而促进肺癌细胞的增殖和转移行为[11]。与之类似的是:在胃癌细胞中,PVT1通过招募EZH2和STAT3来调节P15/P16和VEGFA的表达[12]。课题组在前期研究中发现,PVT1与胃癌的转移侵袭相关。真核翻译起始因子4A1(human eukaryotic translation initiation factor4A1,EIF4A1)可能被PVT1 招募结合并可能造成其下游的蛋白质的翻译失控[13-14]。
EIF4A1是RNA 解旋酶[15],可通过调控mRNA 5′端非翻译区参与翻译的起始阶段[16]。研究证明,翻译失调是肿瘤发生和发展中直接控制癌症基因选择性翻译和蛋白质合成的重要步骤[17],EIF4F翻译起始复合体在PI3K/Akt/mTOR信号通路、丝裂原活化蛋白激酶信号转导通路和依赖半胱天冬酶的细胞凋亡通路的调控下,作为翻译起始的关键节点,控制着许多癌基因的mRNA的翻译起始阶段[18]。EIF4A1作为EIF4F的重要组成部分,在胃癌的发生和发展过程和胃癌上皮间充质转化过程中发挥着重要作用,已证实在增殖活跃的细胞中,EIF4A1 的表达水平高[19],并且也观察到EIF4A1 与肿瘤的迁移侵袭有关[20],最近的研究表明EIF4A1在胃癌、结直肠癌、宫颈癌、乳腺癌和黑色素瘤等癌症中的表达呈现异常情况[21]。依赖于ATP的RNA解旋酶EIF4A1活性较低,其解旋酶功能很大程度上依赖于其结合伴侣的刺激,而单链RNA 的结合能够在很大程度上刺激EIF4A1的活性[22]。在本课题组前期研究中发现,EIF4A1和PVT1 在胃癌中表达水平上调且能相互作用,并与胃癌的进展相关[23]。但PVT1与EIF4A1通过何种机制参与胃癌發生发展,是今后研究的重要方向。
1 材料与方法
1.1 主要试剂
PVT1引物(F:5-TGAGAACTGTCCTTACGTGACC-3;R:5- AGAGCACCAAGAC TGGCTCT-3),N-cadherin抗体(Proteintech),E-cadherin抗体(Affinity),Smad3抗体(Affinity),TGF-β抗体(Affinity),EIF4A1抗体(Bioss),Lipofectamine 3000(Invitrogen)。
1.2 实验方法
1.2.1 细胞培养
胃癌细胞系SGC-7901、NCI-N87、MGC-803、BGC-823和GES-1在37℃下,5%二氧化碳浓度的培养箱中,在添加90% DMEM培养液和10%胎牛血清的培养基中培养。
1.2.2 实时荧光定量PCR反应(real-time PCR)
提取细胞中的总RNA,低温、无酶的提取环境。RNA根据逆转录检测试剂盒逆转录为cDNA后,再按反应体系进行加样,反应体系来源于real-time PCR试剂盒。RT-PCR反应程序设定为:程序循环40次,预热90 ℃反应时间 5 min,95 ℃反应时间为15 s、55℃反应时间为25 s、72 ℃反应时间为10 s。计算RNA的相对表达量的方法为2-△△Ct(Fold-change)。
1.2.3 蛋白质免疫印迹(Western Blot)
提取细胞中的总蛋白,按照蛋白液体量的1/3加入4×loading buffer。混匀后在100℃下金属浴10min。制备SDS-PAGE凝胶,电压80V电泳30min后设定电泳电压为110V,继续电泳1h。电转电压设定为110V,电转时间为60min。配制浓度为5%的脱脂奶粉常温封闭2h。一抗(1∶500)孵育12h,温度设定为4℃。3次TBST清洗(10min·次-1)。室温下二抗孵育2h,3次TBST清洗(10min·次-1),化学发光仪下,用ECL超敏发光液曝光。
1.2.4 转染质粒
采用pcDNA3.1载体于上海吉玛公司构建合成人PVT1和EIF4A1过表达质粒,即pcDNA3- PVT1过表达质粒和pcDNA3- EIF4A1过表达质粒,经测序正确后使用。转染过程为将6孔板提前一天接种胃癌细胞SGC-7901,待细胞密度达到70%~90%且均匀贴壁。
准备无菌EP管两支,减血清的DMEM培养基100μL加入两EP管中,一支加入6μlLipo3000;另一只加入2μg质粒与4 μLP3000 。两者静置10min后混合,轻轻混匀,静置15 min。将此混合液加入提前添加0.8mL减血清 DMEM培养基的六孔板中,转染48h后,更换普通培养基终止转染。
1.2.5 MTT 实验
在96孔板中每组设置5个复孔,每孔接种2 000个已转染细胞,常规培养5 d。0h为第一次加入MTT试剂的时间,每24h将20μL MTT 试剂加入孔内,孵育 4 h在37℃下,停止培养,使得MTT与细胞生长所产生的琥珀酸脱氢酶充分反应。孔中的液体吸弃,二甲基亚砜(DMSO)150 μL加入每孔,OD值在490nm下测定。
1.2.6 平板克隆形成实验
在6孔板中每孔接种1 000个已转染细胞后正常培养,每48h弃去旧培养基,添加新的培养基。培养细胞克隆生长14 d后,弃去孔内培养基终止培养。清洗细胞1次,固定液固定 30 min,染色液染色30 min,蒸馏水清洗、待干后镜下观察,计数细胞数超过50个的集落。
1.2.7 Transwell迁移实验
用PBS清洗已转染细胞,迁移小室中加入2×104个已转染细胞,添加纯DMEM培养基将小室内细胞浓度调整为2×104个/200μL。600μL完全培养基添加至24孔板下室。24h后,清洗迁移小室,固定液30min固定,染色液30 min染色,双蒸水漂洗去除染液,晾干,镜下观察,计数。
1.2.8 划痕实验
于6孔板转染24h后的细胞,用1 000μL枪头划三道均匀分布的竖线,PBS清洗去除孔内脱落的细胞,常规培养,以划痕时间为0h,每24h在相同位置显微镜下拍照,软件计算愈合面积。
1.2.9 统计学处理
使用 SPSS 25.0 统计学软件,四组(单独过表达PVT1、单独过表达EIF4A1、共同过表达PVT1和EIF4A1、NC)实验结果、real-time PCR的RNA相对表达量、Western Blot的蛋白扫描灰度值、平板克隆实验的细胞克隆计数结果、MTT实验的OD值、伤痕愈合实验的愈合面积、Transwell迁移实验的穿膜细胞数,均采用t检验比较,P值<0.05 具有统计学意义。
2 结果
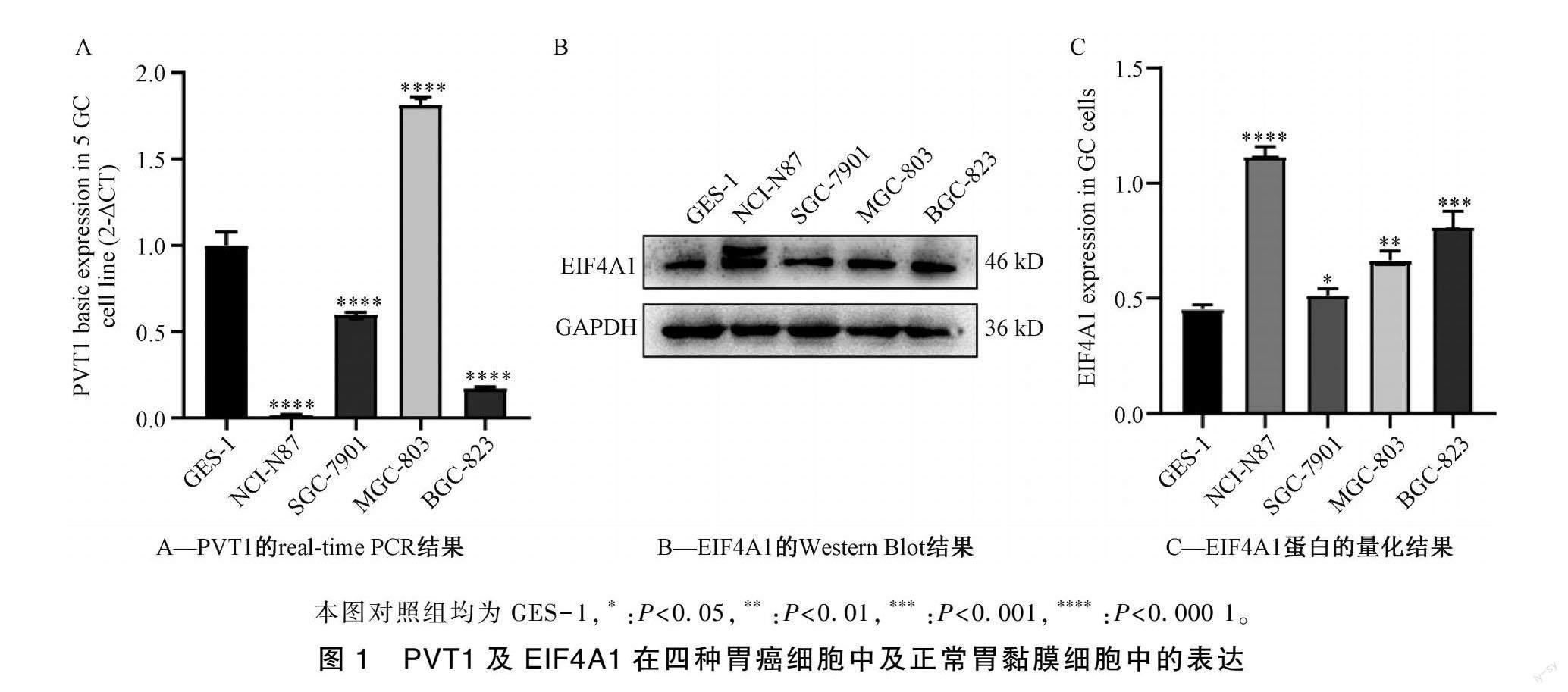
2.1 胃癌细胞及正常胃黏膜细胞中PVT1及EIF4A1的表达情况
Real-time PCR和Western blot分别检测SGC-7901、NCI-N87、MGC-803、BGC-823 4种胃癌细胞及正常胃黏膜细胞中PVT1和EIF4A1的表达量。结果显示:SGC-7901中PVT1的表达量显著低于GES-1细胞,而SGC-7901的EIF4A1表达量也显著低于其他3种胃癌细胞(P<0.05)(图1)。因此,选择SGC-7901开展后续实验研究。
2.2 检测单独或共同过表达PVT1和EIF4A1后的过表达效率
在SGC-7901胃癌细胞中单独或共同过表达PVT1和EIF4A1,转染成功后采用real-time PCR和Western blot分别检测PVT1和EIF4A1的表达量。结果显示:单独过表达PVT1组的PVT1在RNA水平上显著高于NC组(P<0.05)(图2A),单独过表达EIF4A1组的EIF4A1在蛋白水平上显著高于NC组(P<0.05)(图2B,图2C)。
共同过表达PVT1和EIF4A1组的PVT1在RNA水平上显著高于单独过表达PVT1组(P<0.05)(图2A),共同过表达PVT1和EIF4A1组的EIF4A1在蛋白水平上显著高于单独过表达EIF4A1组(P<0.05)(图2B,图2C)。
2.3 单独或共同过表达PVT1和EIF4A1对细胞增殖能力的影响
采用MTT法测定NC组、单独过表达PVT1组、单独过表达EIF4A1组和共同过表达PVT1和EIF4A1组的细胞活力,检测细胞增殖能力通过平板克隆实验。MTT实验结果:共同过表达组OD值高于单独过表达组和对照组(图3A),平板克隆实验结果:共同过表达组平板克隆形成数为492±8.72,单独过表达PVT1组平板克隆形成数为251±1.53,单独过表达EIF4A1组平板克隆形成数为228±1.52,对照组平板克隆形成数为205±2.08(图3B,图3C),以上差异均具有统计学意义(P<0.05)。
2.4 单独或共同过表达PVT1和EIF4A1对细胞迁移能力的影响
用划痕实验和Transwell迁移实验检测单独或共同过表达PVT1和EIF4A1后SGC-7901细胞的
迁移能力,Transwell迁移实验结果:共同过表达组穿膜细胞数为308±29.10,单独过表达PVT1组迁移 细胞数为222±14.42,单独过表达EIF4A1组的迁移细胞数为206±10.58,对照组迁移细胞数为169±18.04(图4A,图4B)。伤痕愈合实验结果显示:共同过表达组伤痕愈合速率高于单独过表达组和对照组(图4C,图4D)。以上结果均具有统计学意义(P<0.05)。
A:Transwell迁移实验结果; B:Transwell迁移实验量化结果; C:划痕实验结果; D:划痕实验量化结果注:本图中共同过表达组与单独过表达组进行对比,单独过表達组与对照组进行对比,*:P<0.05,**:P<0.01,***:P<0.001,****:P<0.000 1。图4 细胞迁移能力检测
2.5 单独或共同过表达PVT1和EIF4A1后E-cadherin,N-cadherin,smad3和TGF-β蛋白表达水平
用Western Blot检测单独或共同过表达PVT1和EIF4A1后E-cadherin,N-cadherin,smad3和TGF-β蛋白表达水平,结果显示:共同过表达组E-cadherin的表达量低于单独过表达组和对照组,共同过表达组N-cadherin、smad3和TGF-β的表达量高于单独过表达组和对照组。以上结果均具有统计学意义(P<0.05)(图5)。
3 讨论
根据最新的癌症统计数据,癌症死亡率近年来持续下降,但它仍然是全球第二大死亡原因[24],基因水平的变化包括基因突变、扩增、缺失、DNA甲基化和插入突变。肿瘤发生的重要因素是抑癌基因失活和癌基因异常激活[25]。总基因组中,非编码基因占的比例约为98%,这些基因负责绝大多数肿瘤的发生[7]。LncRNA可以同时与同一空间中的多个因子结合,整合抑制效应元件和活性效应元件的信息而发挥作用。LncRNA可以充当诱饵,直接与蛋白质、信使RNAs和miRNAs结合,大量证据表明,LncRNA的诱饵功能在肿瘤的发生、发展和转移中起着不可替代的作用[26]。
在本研究中发现,LncRNA PVT1 很有可能是胃癌中刺激激活EIF4A1的RNA伴侣,激活的EIF4A1促进下游转移相关蛋白的表达,从而从多基因表达变异的角度促进癌细胞的迁移侵袭。我们通过在低表达PVT1和EIF4A1的胃癌细胞中单独或共同过表达PVT1和EIF4A1的表达情况,发现单独过表达PVT1或EIF4A1的胃癌细胞相较于未过表达的胃癌细胞,明显提升了细胞的迁移和增殖能力,Western blot结果显示:N-cadherin、TGF-β和 smad3蛋白表达升高,E-cadherin蛋白降低。说明单独过表达PVT1或EIF4A1能够促进胃癌细胞增殖与迁移。而共同过表达PVT1和EIF4A1后,结果显示共同过表达组相较于单独过表达组能够进一步提升胃癌细胞的增殖与迁移的功能,Western blot结果也显示:相较于单独过表达PVT1或EIF4A1,N-cadherin、TGF-β和smad3蛋白表达进一步升高,E-cadherin蛋白进一步降低,说明PVT1和EIF4A1能够协同更进一步促进胃癌细胞的增殖与迁移作用。这可能是因为两个因子能够调控共同的下游基因或蛋白,前文中已经提到PVT1常通过与c-Myc相互作用促进癌症的发展。Ren等[13]发现,PVT1的表达与c-Myc有关,并且它们具有相同的表达趋势。在敲低PVT1的胃癌细胞中,c-Myc的表达也下调。而c-Myc在胃癌的发生发展中是一个重要的分子。Zhao等[27]发现,在胰腺癌中,c-Myc基因表达的调控高度依赖于EIF4A1。EIF4A1缺失可显著降低c-Myc和EMT标记物的表达水平。过表达的EIF4A1通过c-Myc/miR-9轴促进EMT相关蛋白N-cadherin蛋白表达上升,E-cadherin蛋白表达下降。此外,EIF4A1或c-Myc的缺失显著降低了EMT的水平和体内外的转移,反之亦然。c-Myc可能是为癌细胞提供成功转移所需的必要特征的因素之一,广泛参与EMT过程。Cowling和他的同事进行的实验表明,c-Myc可以直接下调乳腺癌细胞株中的E-cadherin,E-cadherin的下调是EMT的主要指标[28] 。
骨桥蛋白(Osteopontin,OPN)是一种受MYC正向调节的细胞因子和整合素结合配体,有研究表明,在乳腺癌中,OPN通过诱导EMT促进转录因子的表达而促进癌细胞脱离和血管内侵入,这些转录因子包括Twist、Snail、Slug和MMPs[29]。MMP2被报道能够裂解潜伏期相关的TGF-β,释放活性的TGF-β。MMP2在小窝蛋白缺失的小鼠中过度表达,这导致与TGF-β激活相关的侵袭性乳腺肿瘤表型增加[30]。本研究结果显示,TGF-β在单独过表达PVT1或EIF4A1的表达量高于NC组,共同过表达PVT1和EIF4A1的TGF-β表达量显著高于单独过表达组。说明PVT1和EIF4A1能够单独或协同促进TGF-β的表达。据此我们推测PVT1和EIF4A1能够共同促进c-Myc的表达,进而促进MMP2的表达,最终影响TGF-β使其表达增加。
Smads是一组将细胞外信号直接传递到细胞核的蛋白质。smad3主要介导TGF-β亚家族成员的信号转导,共同调节因子Smad4是TGF-β和骨形态发生蛋白信号通路的中枢调节因子。smad3已经被证明在许多类型的癌症过度增加,并可能在肿瘤的发生发展中中起致癌作用。例如,Yamazaki等[31]证明smad3可以促进胰腺癌细胞的侵袭和迁移。TGF-α/smad3信号的激活可以诱导宫颈癌细胞系的迁移和侵袭,提示smad3在宫颈癌转移中起重要作用。PVT1能够降低miR-140-5p的表达,而smad3可能是miR-140-5p的下游靶点,因此我们认为PVT1能够通过降低miR-140-5p的表达而促进smad3的表达情况。而EIF4A1调控smad3的机制目前尚未明确,今后仍需继续探索。
综上,本研究发现单独或共同过表达PVT1和EIF4A1能够促进胃癌细胞的增殖与迁移能力,说明了PVT1和EIF4A1有很大的潜力共同作为胃癌的治疗靶点。这与前人的观点不谋而合[34]。而根据本实验结果,我们推测:在胃癌细胞中,PVT1和EIF4A1互作后通过共同影响下游因子c-Myc,促进转录因子MMP2的表达,进而增强TGF-β/smads信号通路中相关蛋白的表达。同时,PVT1也可通过miR-140-5p直接影响TGF-β/smads信号通路中smad3的表達。以上机制进而导致EMT的发生以及EMT相关蛋白如N-cadherin的表达,同时降低上皮细胞相关蛋白E-cadherin的表达,增强胃癌细胞增殖与迁移的能力。然而PVT1和EIF4A1是否会通过以上机制持续影响EMT进程,亦或受到其他哪些分子或因子影响表达,仍是今后需要探索的方向。
參考文献(References)
[1] BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424.
[2] HU X, ZHAO F, YU H, et al. GC-PROM: validation of a patient-reported outcomes measure for Chinese patients with gastric cancer[J]. BMC Cancer, 2020, 20(1): 41.
[3] TAN Y E, WANG P L, YIN S C, et al. Thirty-year trends in clinicopathologic characteristics and prognosis after gastrectomy for gastric cancer: A single institution in Northern China[J]. J Cancer, 2020, 11(5): 1056-1062.
[4] KOPP F, MENDELL J T. Functional classification and experimental dissection of long noncoding RNAs[J]. Cell, 2018, 172(3): 393-407.
[5] KAZIMIERCZYK M, KASPROWICZ M K, KASPRZYK M E, et al. Human long noncoding RNA interactome: detection, characterization and function[J]. Int J Mol Sci, 2020, 21(3):1027.
[6] LIN A, HU Q, LI C, et al. The LINK-A lncRNA interacts with PtdIns(3,4,5)P(3) to hyperactivate AKT and confer resistance to AKT inhibitors[J]. Nat Cell Biol, 2017, 19(3): 238-251.
[7] LI R, WANG X, ZHU C, et al. lncRNA PVT1: a novel oncogene in multiple cancers[J]. Cell Mol Biol Lett, 2022, 27(1): 84.
[8] HE Y, JING Y, WEI F, et al. Long non-coding RNA PVT1 predicts poor prognosis and induces radioresistance by regulating DNA repair and cell apoptosis in nasopharyngeal carcinoma[J]. Cell Death Dis, 2018, 9(2): 235.
[9] QIU M, CHEN M, LAN Z, et al. Plasmacytoma variant translocation 1 stabilized by EIF4A3 promoted malignant biological behaviors of lung adenocarcinoma by generating circular RNA LMNB2[J]. Bioengineered, 2022, 13(4): 10123-10140.
[10] SHIGEYASU K, TODEN S, OZAWA T, et al. The PVT1 lncRNA is a novel epigenetic enhancer of MYC, and a promising risk-stratification biomarker in colorectal cancer[J]. Mol Cancer, 2020, 19(1): 155.
[11] PAN Y, LIU L, CHENG Y, et al. Amplified LncRNA PVT1 promotes lung cancer proliferation and metastasis by facilitating VEGFC expression[J]. Biochem Cell Biol, 2020, 98(6): 676-682.
[12] ZHAO J, WU J, QIN Y, et al. LncRNA PVT1 induces aggressive vasculogenic mimicry formation through activating the STAT3/Slug axis and epithelial-to-mesenchymal transition in gastric cancer[J]. Cell Oncol (Dordr), 2020, 43(5): 863-876.
[13] REN X, CAO D, YANG L, et al. High Expression of long non-coding RNA PVT1 predicts metastasis in Han and Uygur patients with Gastric cancer in Xinjiang, China[J]. Sci Rep, 2019, 9(1): 548.
[14] REN X, LI Y, YANG L, et al. Expression levels and the prognostic value of long non-coding RNA PVT1 in serum of Han and Uygur gastric cancer patients in Xinjiang, China[J]. Translational Cancer Research, 2019, 8(1): 51-58.
[15] TAUBER D, TAUBER G, KHONG A, et al. Modulation of RNA condensation by the DEAD-Box protein eIF4A[J]. Cell, 2020, 180(3): 411-426, e416.
[16] DIGREGORIO M, LOMBARD A, LUMAPAT P N, et al. Relevance of translation initiation in diffuse glioma biology and its therapeutic potential[J]. Cells, 2019, 8(12):796.
[17] WALDRON J A, TACK D C, RITCHEY L E, et al. mRNA structural elements immediately upstream of the start codon dictate dependence upon eIF4A helicase activity[J]. Genome Biol, 2019, 20(1): 300.
[18] BLAGDEN S P, WILLIS A E. The biological and therapeutic relevance of mRNA translation in cancer[J]. Nat Rev Clin Oncol, 2011, 8(5): 280-291.
[19] RAZA F, WALDRON J A, QUESNE J L. Translational dysregulation in cancer: eIF4A isoforms and sequence determinants of eIF4A dependence[J]. Biochemical Society Transactions, 2015, 43(6): 1227-1233.
[20] JOYCE C E, YANEZ A G, MORI A, et al. Differential regulation of the melanoma proteome by eIF4A1 and eIF4E[J]. Cancer Res, 2017, 77(3): 613-622.
[21] SOYLEMEZ Z, ARIKAN E S, SOLAK M, et al. Investigation of the expression levels of CPEB4, APC, TRIP13, EIF2S3, EIF4A1, IFNg, PIK3CA and CTNNB1 genes in different stage colorectal tumors[J]. Turk J Med Sci, 2021, 51(2): 661-674.
[22] SHEN L, PELLETIER J. General and target-specific DExD/H RNA helicases in eukaryotic translation initiation[J]. Int J Mol Sci, 2020, 21(12):4402.
[23] 王曉露. LncRNA PVT1与翻译起始因子EIF4A1互作促进胃癌转移的作用和机制研究[D]. 石河子:石河子大学, 2022.
WANG X L. Study on the interaction and mechanism of LncRNA PVT1 and translation initiation factor EIF4A1 in promoting gastric cancer metastasis[D]. Shihezi University, 2022.
[24] SIEGEL R L, MILLER K D, FUCHS H E, et al. Cancer statistics, 2022[J]. CA Cancer J Clin, 2022, 72(1): 7-33.
[25] RANSOHOFF J D, WEI Y, KHAVARI P A. The functions and unique features of long intergenic non-coding RNA[J]. Nat Rev Mol Cell Biol, 2018, 19(3): 143-157.
[26] LEE S, KOPP F, CHANG T C, et al. Noncoding RNA NORAD regulates genomic stability by sequestering PUMILIO proteins[J]. Cell, 2016, 164(1-2): 69-80.
[27] ZHAO Y, WANG Y, CHEN W, et al. Targeted intervention of eIF4A1 inhibits EMT and metastasis of pancreatic cancer cells via c-MYC/miR-9 signaling[J]. Cancer Cell Int, 2021, 21(1): 670.
[28] COWLING V H, COLE M D. E-cadherin repression contributes to c-Myc-induced epithelial cell transformation[J]. Oncogene, 2007, 26(24): 3582-3586.
[29] ZHAO H, CHEN Q, ALAM A, et al. The role of osteopontin in the progression of solid organ tumour[J]. Cell Death Dis, 2018, 9(3): 356.
[30] JENKINS G. The role of proteases in transforming growth factor-beta activation[J]. Int J Biochem Cell Biol, 2008, 40(6-7): 1068-1078.
[31] YAMAZAKI K, MASUGI Y, EFFENDI K, et al. Upregulated SMAD3 promotes epithelial-mesenchymal transition and predicts poor prognosis in pancreatic ductal adenocarcinoma[J]. Lab Invest, 2014, 94(6): 683-691.
[32] FAN Q, QIU M T, ZHU Z, et al. Twist induces epithelial-mesenchymal transition in cervical carcinogenesis by regulating the TGF-β/Smad3 signaling pathway[J]. Oncology Reports, 2015, 34(4): 1787-1794.
[33] CHANG Q Q, CHEN C Y, CHEN Z, et al. LncRNA PVT1 promotes proliferation and invasion through enhancing Smad3 expression by sponging miR-140-5p in cervical cancer[J]. Radiol Oncol, 2019, 53(4): 443-452.
[34] TRAVERSA D, SIMONETTI G, TOLOMEO D, et al. Unravelling similarities and differences in the role of circular and linear PVT1 in cancer and human disease[J]. Br J Cancer, 2022, 126(6): 835-850.
(責任编辑:编辑唐慧)
