范可尼贫血症通路影响肿瘤耐药、化疗增敏的研究进展
2024-03-26杨淑贤余克富孙阿宁史卫忠赵志刚
杨淑贤,余克富,孙阿宁,史卫忠,赵志刚
首都医科大学附属北京天坛医院 药学部,北京 100070
范可尼贫血症是一种罕见的人类遗传疾病,已有1 000例患者被报道,最初是瑞士儿科医生Guido Fanconi于1927年首次发现并描述的[1]。据估计,范可尼贫血症的患病率仅为1~5人/百万,常常在5~10岁发病,儿童携带的概率约为1人/36万[2]。范可尼贫血症的基本特征是染色体的不稳定性,表现为自发断裂增多,尤其是在DNA交联剂如顺铂、丝裂霉素C等诱导下断裂明显高于正常人,这一特征也被认为是诊断范可尼贫血症的金标准。此外,范可尼贫血症患者也常伴有癌症易感性、骨髓衰竭和发育异常3大特征[3]。范可尼贫血症通路的发现与范可尼贫血症密切相关。迄今为止,研究者们已经确定出了22个范可尼贫血症基因,包括FANCA、FANCB、FANCC、FANCD1、FANCD2、FANCE、FANCF、FANCG、FANCI、FANCJ、FANCL、FANCM、FANCN、FANCO、FANCP、FANCQ、FANCR、FANCS、FANCT、FANCU、FANCV、FANCW,其中1个范可尼贫血症基因发生突变就会发生范可尼贫血症[4]。范可尼贫血症基因编码的蛋白质和相关蛋白构成范可尼贫血症通路,它们相互合作,调节感知,共同抵抗DNA损伤。由于其中的几个基因也编码乳腺癌易感基因(BRCA)产物,因此也被成为“FABRCA通路”[5-6]。研究表明,范可尼贫血症通路在内源性DNA损伤的检测与修复中发挥重要作用,并且范可尼贫血症途径与肿瘤发生、肿瘤耐药、化疗药物增敏等密切相关[7]。基于以上,本文归纳了范可尼贫血症通路组成及其参与DNA损伤修复过程,讨论了范可尼贫血症通路的调控、对肿瘤耐药、化疗敏感性的影响,并总结了靶向范可尼贫血症通路的小分子抑制剂,为癌症干预提供新思路。
1 范可尼贫血症通路组成及其参与DNA损伤修复过程
范可尼贫血症基因编码的蛋白和相关蛋白构成了范可尼贫血症通路。当细胞在DNA交联剂或紫外线照射作用下导致DNA损伤时,范可尼贫血症通路会被激活,从而对损伤的DNA进行修复,其过程主要包括4个部分(图1)。第1部分是损伤感知模块,位于范可尼贫血症通路上游的FANCM与FAAP24在DNA结合辅助因子MHF1、MHF2的协助下首先识别DNA损伤位点,并帮助募集下游的范可尼贫血症蛋白[8-10]。第2部分是形成范可尼贫血症核心复合体,该复合体是由八蛋白复合物(FANCA,-B,-C,-E,-F,-G,-L,-M)和辅蛋白(FAAP20、FAAP100)形成的,有E3泛素连接酶活性(该酶的活性由FANCL、RING E3连接酶完成)[11]。第3部分是形成FANCI-FANCD2异源二聚体(I-D2复合体),上述范可尼贫血症核心复合体可发挥E3泛素连接酶活性,在DNA损伤位置募集FANCD2、FANCI,继而单泛素化FANCD2、FANCI蛋白,形成单泛素化的I-D2复合体[12-13]。第4部分是DNA损伤修复,单泛素化的I-D2复合体定位于DNA损伤位点,并与下游的范可尼贫血症蛋白如FANCD1,-O,-R,-U,-Q,-P相互作用,一起完成DNA修复过程,进行DNA损伤应答[14]。整个过程中,单泛素化的FANCI-FANCD2异源二聚体也能够被去泛素化酶USP1去泛素化,周而复始,不断完成并进行新的修复过程[15]。

图1 范可尼贫血症通路参与的DNA损伤修复Fig.1 Involvement of Fanconi anemia pathway in DNA damage repair
值得注意的是,如果FANCD2/FANCI复合体不发生单泛素化,将不会有后续的DNA修复过程,因此FANCD2的单泛素化(FANCD2-S转变为FANCD2-L)被认为是范可尼贫血症通路激活的最核心环节[16-17]。核心复合体中的FANCDL亚基是1个E3泛素连接酶,分别单泛素化FANCD2蛋白的K561位点和FANCI蛋白的K523位点,以响应DNA损伤或复制应激[18-20]。也有研究表明FANCI的磷酸化是FANCD2单泛素化的触发因子,FANCI在S/TQ集群域的磷酸化是触发FANCD2单泛素化的1个分子开关[21]。此外,FANCD2的单泛素化也已被证明受ATR-ATRIP激酶和E2酶UBE2T/FANCT的调控[22]。除了泛素化作用外,去泛素化作用在范可尼贫血症通路的调节中也同等重要[23]。有研究表明,FANCI/FANCD2的去泛素化由USP1-UAF1复合体特异性催化。USP1属于泛素特异性蛋白酶类去泛素化酶,USP1与泛素结合,并催化其从与之结合的蛋白质中去除,USP1本身的活性很小,因此需要USP1相关因子1(UAF1)活化以提高催化作用[24]。只有泛素化、去泛素化以循环的方式正常运行,才能使FANCD2循环,不断用于新的修复反应。
2 范可尼贫血症通路的调控
范可尼贫血症通路主要受到2种机制的调控。第1种是泛素化调控。泛素化是一种重要的蛋白质共价键修饰方式,通过复杂的酶级联反应进行,包括泛素活化酶(E1)、泛素结合酶(E2)、泛素蛋白连接酶(E3)。在范可尼贫血症通路中,E1酶UBA1、E2酶UBE2T(又称FANCT)和E3连接酶(FANCL)共同负责FANCD2、FANCI的单泛素化过程[25-26]。具体步骤包括:泛素首先被E1泛素活化酶(通常是UBA1)激活,并与之形成巯基酯键;然后它被转移到E2泛素结合酶(UBE2T)的催化半胱氨酸上(再次作为巯基酯中间体);最后泛素在E3泛素连接酶(FANCL)的帮助下从E2酶转移到FANCD2和FANCI蛋白的赖氨酸上,即可对特异性赖氨酸位点K561、K523进行泛素化[27]。见图2。
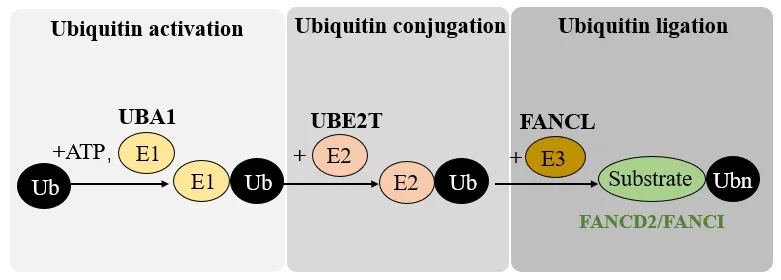
图2 泛素化的3步酶促过程Fig.2 Three-step enzymatic process of ubiquitination
第2种是ATR激酶介导的范可尼贫血症蛋白磷酸化。ATR是一种检查点蛋白激酶,当细胞内出现DNA单链断裂时,ATR即被激活,激活的ATR可磷酸化FANCD2的Thr691、Ser717位点,从而促进FANCD2的单泛素化[28]。另外,ATR也能够磷酸化FANCI,使I-D2复合体定位于DNA损伤位点处,FANCI与叉状DNA相结合后,I-D2复合体的构形也随之发生改变,暴露FANCD2的泛素化位点,从而使FANCD2更容易被泛素化[22]。也有研究表明在应激反应期间,范可尼贫血症核心复合物的多个成分可被ATR磷酸化激活,并指出ATR介导的FANCA Ser1449位点的磷酸化和chk1介导的FANCE Thr346、Ser374位点的磷酸化是范可尼贫血症通路功能完整所必需的[29-30]。因此ATR激酶介导的磷酸化对范可尼贫血症通路的激活至关重要。
3 范可尼贫血症通路对肿瘤耐药的影响
癌症细胞对诱导DNA损伤的化疗药变得耐药的一种方法是获得更高的DNA损伤修复能力,而范可尼贫血症通路作为DNA损伤修复通路之一,在肿瘤细胞对DNA交联剂(如顺铂、丝裂霉素等)的耐药中发挥重要作用。范可尼贫血症通路的基因改变和沉默可增加肿瘤细胞对DNA交联剂的敏感性,范可尼贫血症通路被激活则导致化疗耐药的产生[31-32]。研究表明范可尼贫血症基因表达升高在癌症中是普遍的,并经常被发现与化疗耐药相关,如A549细胞衍生的顺铂耐药细胞株A549/DR与亲本和其他非小细胞肺癌细胞株相比,表现出多个范可尼贫血症基因上调和FANCD2单泛素化升高,而敲除范可尼贫血症基因则使A549/DR细胞对顺铂治疗再次敏感[33]。也有研究表明在腺癌细胞系中,破坏范可尼贫血症核心复合物蛋白FANCC、FANCG可消除FANCD2单泛素化作用,并使肿瘤细胞对奥沙利铂、美法仑等药物敏感,减少耐药[34],同时,范可尼贫血症通路被激活也与多发性骨髓瘤、胰腺癌对美法仑的耐药性有关[35-36]。除了DNA交联剂外,范可尼贫血症途径还可使神经胶质瘤对顺铂等DNA烷基化剂产生抗性[37]。除了范可尼贫血症介导的耐药外,还观察到范可尼贫血症通路相关蛋白如FANCA与癌症患者的不良预后、生存相关[38-39]。这些研究数据强调了在范可尼贫血症通路表达和功能升高而出现化疗耐药性的情况下,开发靶向范可尼贫血症通路药物的必要性,利用抑制范可尼贫血症通路的小分子药物和化疗药物联合治疗是克服耐药性的新趋势。因此,通过调控范可尼贫血症通路使癌细胞对化疗药敏感,将推动对抗化疗耐药新策略的发展。
4 范可尼贫血症通路对化疗敏感性的影响
范可尼贫血症通路是细胞对DNA交联剂耐药所必需的,抑制范可尼贫血症通路的调节因子或激活因子可使癌细胞对这些药物的敏感性增加,因此,基于范可尼贫血症通路开发的小分子抑制剂可在临床上作为化疗增敏剂用于癌症治疗。
范可尼贫血症途径涉及到多种酶(泛素连接酶、泛素结合酶、去泛素化酶、激酶)和许多蛋白质-蛋白质或蛋白质-DNA相互作用,所有这些成分都是范可尼贫血症通路小分子抑制剂的潜在靶点,尽管对范可尼贫血症通路的抑制可以在多个分子上发生,但FANCD2单泛素化一直是药物干预的主要目标[40]。Jacquemont研究小组以可抑制FANCD2核内焦点形成为判断标准,对超过16 000种化学物质进行体外筛选,鉴定出15个有望靶向范可尼贫血症通路的分子,这些化合物包括蛋白酶体抑制剂(姜黄素、compound 5929407、硼替佐米、MG-132等)、蛋白激酶C(PKC)抑制剂(H-9、Go6976)、细胞周期检查点激酶1(Chk1)抑制剂(7-羟基星形孢菌、SB218078)、细胞周期蛋白依赖性激酶(CDK)抑制剂(罗斯科维汀)、热休克蛋白(HSP)90抑制剂(坦螺旋霉素)和其他成分(氯喹)[41]。其中硼替佐米抑制蛋白酶体或耗尽蛋白酶体亚基,可抑制FANCD2单泛素化,此外,它还可以通过抑制NF-κB信号通路下调FANCD2基因的表达,并增强美法仑对骨髓瘤细胞的细胞毒性,因此,硼替佐米已是复发/难治性多发性骨髓瘤和套细胞淋巴瘤的标准治疗药物[42]。近年来硼替佐米的使用扩大到了联合疗法,如硼替佐米联合顺铂用于范可尼贫血症基因正常表达的卵巢癌细胞时,二者表现出协同作用,它可增加卵巢癌细胞对顺铂的敏感性[43]。
另外,源于植物的天然产物姜黄素的研究较多,姜黄素可抑制FANCD2单泛素化,并通过范可尼贫血症通路相关性方式使卵巢癌细胞对顺铂敏感,提示姜黄素对顺铂的敏化作用主要通过范可尼贫血症通路抑制发生[32]。为了将姜黄素开发为顺铂增敏剂,姜黄素联合顺铂使用的体内外、分子机制研究也正在进行。此外,姜黄素的类似物如EF24、4H-TTD也已被证明可抑制FANCD2的激活,并增加顺铂的敏感性[44]。另外,pevonedistat被证明能削弱FANCD2的激活,使癌细胞对DNA损伤诱导剂更敏感[45]。1项研究表明咖啡因可通过抑制FANCD2的单泛素化调控DNA修复过程,增强顺铂对肝癌的抗癌效果[46]。Burkitt研究小组将顺铂与范可尼贫血症通路抑制剂苯丁酸酯联合使用,发现二者联合使用诱导了更大程度的头颈部癌细胞凋亡,证实了苯丁酸酯对顺铂有增敏作用,苯丁酸酯通过下调BRCA1抑制FA/BRCA通路,提高头颈部癌细胞对顺铂的敏感性[47]。可见针对范可尼贫血症通路中的蛋白,特别是FANCD2蛋白是一个比较可行的抗肿瘤靶点。另外,阻断FANCD2蛋白的泛素-去泛素化循环也可导致范可尼贫血症通路的抑制。近年来,一些针对USP1-UAF1去泛素化酶复合体抑制剂已经被开发出来。小分子抑制剂(哌咪清、GW7647)以及更具选择性的抑制剂ML323均可抑制FANCD2去泛素化作用,增强顺铂对化疗耐药癌细胞的细胞毒性[48-49]。抑制USP1-UAF1复合体也会通过增加USP1的另一底物单泛素化PCNA的水平来损害跨损伤DNA合成,这表明抑制USP1-UAF1复合体可以同时针对范可尼贫血症通路中的两个主要步骤[50]。因此USP1抑制剂也可以在治疗癌症方面发挥作用。
值得指出的是,阐明上述候选抑制剂的具体机制将是开发具有特异性、有效性的范可尼贫血症抑制剂的关键。为进一步了解范可尼贫血症通路的调控作用,需要精确分析每种药物对范可尼贫血症通路中各个步骤的作用,以确定它们的特定靶点,这些分析将包括体外ATR激酶检测、体外UBE2T和FANCL自泛素化检测、范可尼贫血症核心复合物的形成评估等。此外,对范可尼贫血症通路相关蛋白的结构解析可为药物设计、候选抑制剂的靶点确定提供有用的信息[51-52]。总体来讲,针对范可尼贫血症通路的药物开发仍处于早期阶段,因此目前还没有被大家广泛接受的范可尼贫血症特异性抑制剂存在。
5 结语与展望
范可尼贫血症是一种罕见的遗传疾病,由目前已知的22个范可尼贫血症基因中的其中1个突变引起。这些基因编码的蛋白质和其他范可尼贫血症相关的蛋白质参与1个生化途径,被称为范可尼贫血症通路。范可尼贫血症通路在DNA链间交联修复和基因组完整性维持中起着核心作用,在DNA链间交联识别和修复过程中,范可尼贫血症通路稳定了复制叉,一旦修复损伤,复制就可以重新开始。
范可尼贫血症通路的完整性决定了对产生DNA链间交联的化疗药物的敏感性或耐药性。癌细胞对DNA损伤药物(如交联剂顺铂)的反应,无论是敏感还是耐药,都取决于DNA修复途径的状态。如果范可尼贫血症通路被激活,顺铂耐药可能在初始治疗后就发生,范可尼贫血症通路在交联剂敏感和耐药中的重要作用确定了范可尼贫血症通路作为癌症治疗的特定靶点。通过评估范可尼贫血症通路功能状态可以识别出对交联剂敏感的特异性肿瘤。此外,靶向阻断范可尼贫血症通路可恢复交联剂对耐药肿瘤的敏感性,还可与交联剂、辐射、多聚ADP核糖聚合酶(PARP)抑制剂等多种化疗药物联合治疗,提高疗效[53]。针对DNA修复途径的增敏剂与常规化疗联合应用的疗法为癌症的治疗带来了巨大的希望。在未来,随着对范可尼贫血症通路的作用和机制的更深入了解,以及对该通路特异性抑制剂的识别,范可尼贫血症通路的靶向调节将在许多化疗方案中发挥重要作用。
利益冲突所有作者均声明不存在利益冲突
