槟榔碱改善脂多糖诱导的BV2细胞神经炎症及作用机制
2024-03-26孙源王丹阳孙晶范蓓宋洪波刘新民卢聪王凤忠
孙源 ,王丹阳,孙晶,范蓓,宋洪波,刘新民,卢聪*,王凤忠*
1.中国农业科学院 农产品加工研究所,北京 100193
2.福建农林大学 食品科学学院,福建 福州 350002
3.宁波大学 新药技术研究院,浙江 宁波 315000
近年来,研究发现神经炎症参与了多种神经退行性疾病的发生,如抑郁症、帕金森综合征、阿尔茨海默病等[1]。研究证明,神经炎症是神经退行性疾病发病的重要因素之一[2]。大量研究表明,当免疫细胞被激活后,可产生多种致炎因子,如肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-6、一氧化氮(NO)、诱导型一氧化氮合酶(iNOS)等,炎症因子在脑内堆积过多则能引起脑内神经元死亡,造成不可逆转的神经炎症[3-4]。由此可见,致炎细胞因子对激活免疫细胞以及正反馈调控炎症介质的分泌是必不可少的,而这些作用又与神经退行性疾病的发生及发展密切相关。因此,如何有效控制神经炎症的发生或是减轻神经炎症能够为中枢神经系统疾病提供有效的改善方法。BV2小胶质细胞是一类先天固有的免疫细胞,占脑细胞总数的10%~15%,与外周巨噬细胞和淋巴细胞作用类似,能够作为脑的免疫屏障抵抗疾病和外界刺激[5]。研究表明,小胶质细胞介导的神经炎症在神经退行性疾病中发挥着核心作用[6]。正常状态下小胶质细胞处于静息状态,当脑内产生感染或损伤时,小胶质细胞被激活,启动机体免疫系统的自我修复,感染及损伤恢复后小胶质细胞又处于静息状态[7]。如果外界刺激因子及脑感染、损伤不断激活小胶质细胞,则会打破免疫系统的免疫应答反应[8],释放出TNF-α、IL-6、IL-1β、iNOS等炎性因子,导致神经系统严重损伤,产生神经炎症。脂多糖(LPS)是革兰阴性细菌外膜的中心组分,LPS诱导BV2小胶质细胞激活是常用的一种体外神经炎症模型[9],常用于天然活性成分的筛选及基于抗炎发挥神经保护功效有效组分的机制探索。
槟榔具有驱虫、改善消化功能、神经保护、改善心血管系统、镇痛、抗炎、抗病毒、抗氧化、抗菌等作用[10],其中槟榔碱被视为槟榔发挥生物活性的主要活性成分,在槟榔果中占比0.3%~0.6%[11]。现代药理学研究表明,槟榔碱具有抗炎[12]、抗抑郁[13]、改善神经系统[14-16]、抑制病毒蛋白活性[17]等多种功效。张伟等[18]研究发现,槟榔碱能抑制氧化型低密度脂蛋白诱导的小鼠巨噬细胞TNF-α、IL-6、细胞间黏附分子1(ICM-1)mRNA的表达,减轻细胞炎症。吴江涛[19]在研究中指出,槟榔碱的抗炎机制与阻碍核因子-κB(NF-κB)信号通路、抑制细胞产生促炎因子有关。为充分揭示槟榔碱对神经炎症反应的改善效果及调控机制,本研究采用LPS诱导小鼠BV2小胶质细胞所致神经炎症模型探究槟榔碱的神经保护作用及分子机制,以期为槟榔碱这一活性组分的药用价值提供数据支持,并为槟榔的开发利用奠定理论基础。
1 材料
1.1 细胞
BV2小胶质细胞购自武汉尚恩生物技术有限公司。
1.2 试剂
BV2完全培养基(武汉尚恩生物技术有限公司);槟榔碱(上海源叶生物科技有限公司,质量分数≥98%,货号B74705-50 mg);磷酸盐缓冲液(PBS)购于Hyclone;BCA试剂盒(货号P0012)、RIPA裂解液(货号G2002)购于碧云天生物技术公司;DMSO(货号D8371-50 mL)、CCK-8(货号CA1210-500)细胞活性检测试剂盒购于索莱宝科技有限公司;PVDF膜0.45 μm(货号IPVH00010)购于Millipore公司、Trizol美国Invitrogen公司;MMLV逆转录酶、dNTP(10 mmol/L)、Premix Taq™、TB Green®Premix Ex Taq™ II(Tli RNaseH Plus)、DL2000 DNA Marker、RNase-free H2O、50×TAE购于宝生物工程(大连)有限公司;DNase I、6×Loading Dye、RNase Inhibitor、RL 6 000 RNA购于Marker美国Fermentas公司;琼脂糖购于西班牙Biowest公司;甲醛(分析纯)、异丙醇(分析纯)、氯仿(分析纯)、无水乙醇(分析纯)、10×MOPS购于北京化学试剂公司;GelRed染色试剂购于美国Biotium公司;Real Time PCR 384孔板购于瑞士Roche公司。
1.3 仪器
Herocell 180细胞培养箱(上海润度生物科技有限公司);低温冷冻离心机(德国Sigma公司);spectra MAX190酶标仪(Molecular devices);超微量核酸/蛋白分析仪(英国BioDrop μLite);电泳仪(美国伯乐Bio-Rad);EUV-LDUV凝胶成像系统(韩国KoreaBiotech公司);Mupid 2plus电泳槽(日本TAKARA公司);垂直电泳仪、转印电泳仪(Tanon公司);扫描仪(EPSON公司)。2720型PCR仪(美国ABI公司);DHG-9240A鼓风干燥箱(上海一恒公司);Roche LightCycler®480II实时荧光定量PCR系统(瑞士Roche公司);Olympus BX53倒置光学显微镜(日本Olympus公司)。
2 方法
2.1 细胞培养
BV2细胞用含10%胎牛血清、1%青-链霉素的完全培养基,置于37 ℃、5% CO2培养箱中培养。待细胞密度达60%~70%时进行传代。取对数生长期的细胞进行后续实验。
2.2 模型制备
取对数生长期的BV2细胞进行铺板。以5×104/mL接种于96孔板中,每孔100 μL,每组设置5个复孔,待细胞贴壁后培养12 h。弃除原有培养基,空白组换上等量培养基,LPS组换上含有LPS对应浓度(0.01、0.1、1、10、20 μg/mL)的培养基,继续培养24 h后用于后续实验[20]。
2.3 实验分组
LPS和槟榔碱用细胞级DMSO溶解后分装储存在-20 ℃,避免反复冻融。取对数生长期的BV2细胞进行铺板,将细胞分为空白组、模型组、槟榔碱(10、20、40 μmol/L)组。铺板12 h后,弃除原培养基,空白组和模型组换上等量培养基,槟榔碱组则换上含有对应浓度槟榔碱(10、20、40 μmol/L)的培养基进行预保护,换液2 h后,模型组和槟榔碱组加入含相应质量浓度LPS的培养基,空白组则加入等量培养基,LPS造模浓度从2.2项中得出。
2.4 CCK-8法检测细胞活力
取对数生长期的BV2细胞进行铺板。以5×104个/mL接种于96孔板中,每孔100 μL,每组设置5个复孔,待细胞贴壁后培养12 h。分别检测LPS、槟榔碱、槟榔碱+LPS对BV2细胞活力的影响。再每组处理24 h后,每孔加入CCK-8工作液10 μL,继续孵育2 h后,450 nm测定吸光度(A)值。
细胞存活率=A加药-A空白/A对照-A空白
2.5 分光光度法检测NO含量
取对数生长期的BV2细胞进行铺板。以5×104个/mL接种于24孔板中,每孔500 μL,每组设置3个复孔,待细胞贴壁后培养12 h。按照2.3项下方法处理细胞,按照试剂盒操作方法,检测细胞中NO含量。
2.6 ELISA检测相关炎症因子
取对数生长期的BV2细胞进行铺板。以5×104个/mL接种于6孔板中,每孔2 000 μL,每组设置4个复孔,待细胞贴壁后培养12 h。按2.3项下处理细胞,离心收集上清,按照ELISA试剂盒说明书测定细胞上清液中TNF-α、IL-6、IL-1β、IL-10水平。
2.7 qPCR分析相关mRNA表达
取对数生长期的BV2细胞进行铺板。以5×104个/mL接种于6孔板中,每孔2 000 μL,每组设置4个复孔,待细胞贴壁后培养12 h。按照2.3项下分组处理细胞,用Trizol提取样品RNA,最后加入100 μL无RNase的水,溶解RNA。按照RNA提取试剂盒说明书提取总RNA,用NanoDrop定量,并按照说明书将其逆转录为cDNA。后按照文献报道方法[20]进行处理。使用β-actin作为内参基因,采用分析数据,qPCR所用引物见表1。
2.8 Western blotting法检测相关蛋白表达
2.8.1 细胞蛋白提取 按2.3项下分组处理细胞24 h后,1 000 r/min离心5 min,收集细胞沉淀,使用预冷的RIPA蛋白裂解液裂解细胞,置于-4 ℃充分裂解30 min,并每隔5 min振荡30 s。裂解结束后12 000 r/min,4 ℃,5 min。取上清,进行蛋白定量。
2.8.2 蛋白浓度测定及样品制备 按照BCA蛋白定量试剂盒使用说明操作,测定蛋白浓度。绘制标准曲线图并计算蛋白浓度。(1)根据所测目的蛋白的相对分子质量,配制8%~10%分离胶;(2)将待测蛋白样品以30 μg/孔上样;(3)电泳:浓缩胶恒压90 V,约20 min;分离胶恒压120 V,通过预染蛋白Marker来确定电泳停止时间;(4)转膜:去除浓缩胶、保留分离胶,裁剪合适大小的0.45 μm孔径的PVDF膜,转膜300 mA恒流,60 min;(5)封闭:取出的PVDF膜完全浸没于5% BSA-TBST中,水平摇床孵育1 h;(6)一抗孵育:5% BSA-TBST稀释一抗,磷脂酰肌醇激酶单克隆抗体(PI3KP85)、p-蛋白激酶B(Akt)、Akt、p-p65、环氧化酶2(COX2)、Toll样受体4(TLR4)、甘油醛-3-磷酸脱氢酶(GAPDH)稀释比例1∶1 000,p65、iNOS稀释比例1∶500,4 ℃水平摇床孵育过夜。次日,用TBST洗膜3次,每次10 min;(7)二抗孵育:5%BSA-TBST稀释二抗,山羊抗兔IgG(H+L)HRP 1∶10 000室温孵育1 h后TBST洗膜3次,每次10 min;(8)胶片曝光:ECL滴加到膜的蛋白面,反应3~5 min后曝光2 min,显影2 min,定影。
2.9 统计学分析
SPSS 26.0和GraphPad Prism 8.0做数据分析及绘图。Image-PRO做灰度分析。多组间比较采用单因素方差分析(one-way ANOVA),LSD法验证两两比较的显著性。
3 结果
3.1 不同质量浓度LPS对BV2细胞存活率及NO含量的影响
如图1所示,与空白组相比,在LPS作用BV2细胞24 h后,LPS各浓度组并未对BV2细胞存活率产生影响。而在0.01、0.1 μg/mL LPS作用BV2细胞24 h后,NO含量显著下降(P<0.05、0.01),分析原因可能是LPS浓度过低或是由于操作误差空白组细胞量多于其他组,然而LPS 1、10、20 μg/mL组细胞中NO含量显著升高(P<0.001)。为确保成功建立模型的同时减少LPS对细胞的影响,后续实验选择1 μg/mL LPS进行造模处理。
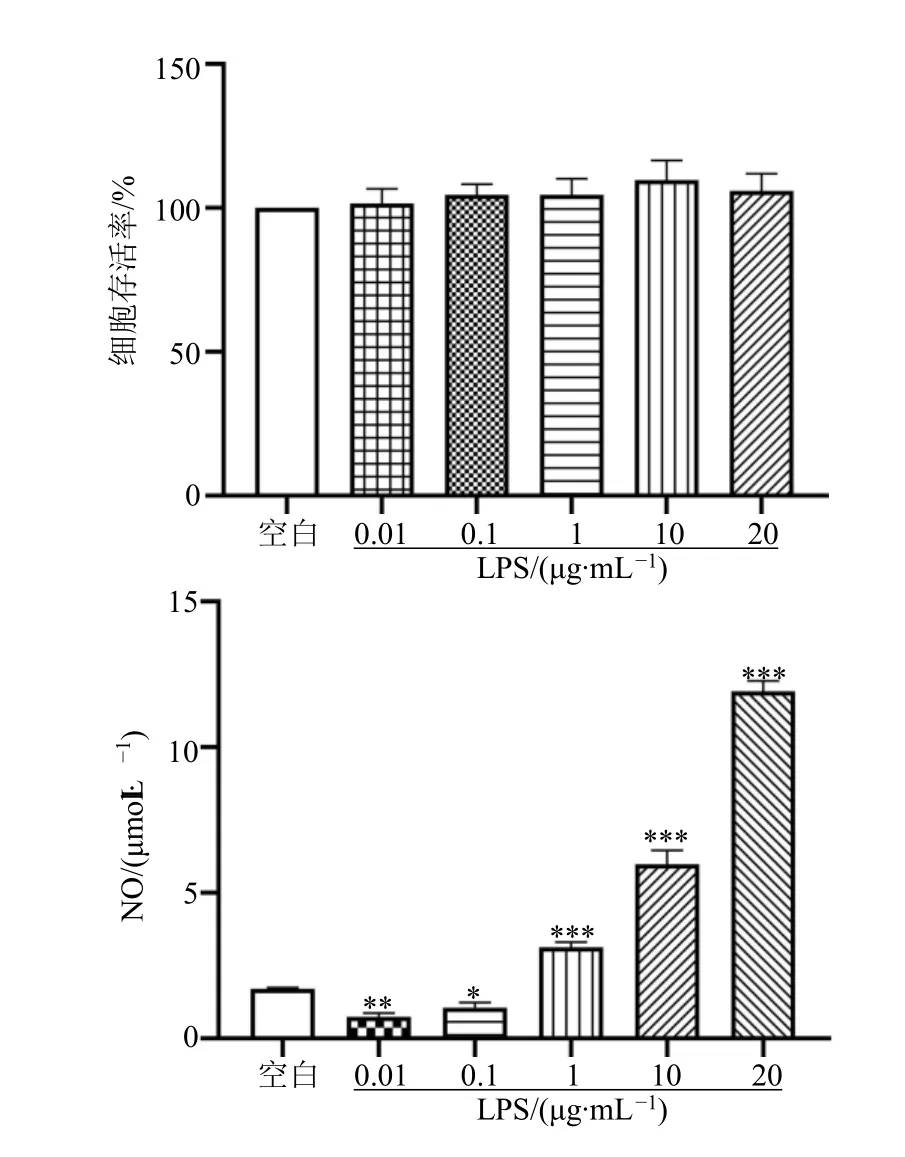
图1 LPS对BV2细胞存活率和NO含量的影响(,n=5)Fig.1 Effect of LPS on BV2 cell viability rate and NO content (,n=5)
3.2 不同浓度槟榔碱对BV2细胞存活率和LPS诱导的BV2细胞存活率的影响
如图2所示,与空白组相比,在槟榔碱作用BV2细胞24 h后,槟榔碱10、20、40 μmol/L组细胞存活率无明显差异,可见此浓度范围内槟榔碱对BV2细胞没有毒性作用。因此选择10、20、40 μmol/L的槟榔碱与LPS共同作用对BV2存活率影响实验。
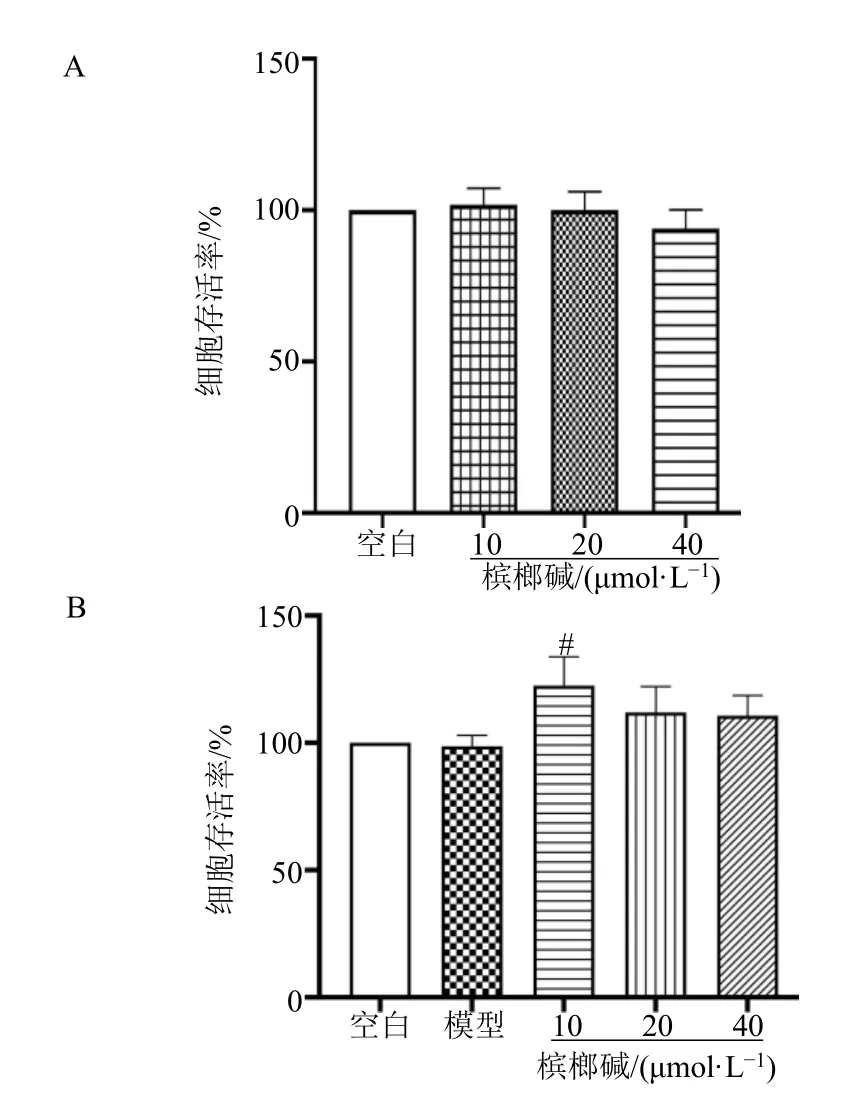
图2 槟榔碱对BV2细胞存活率(A)和槟榔碱对LPS诱导的BV2细胞存活率(B)的影响(,n=5)Fig.2 Effects of arecoline on BV2 cell viability rate (A) and arecoline on LPS induced BV2 cell viability rate (B) (,n=5)
与模型组相比,槟榔碱10 μmol/L组细胞存活率呈显著上升趋势(P<0.05),而槟榔碱20、40 μmol/L组细胞存活率并未有显著性影响。本课题组此前研究发现槟榔碱在一定浓度范围内能促进细胞增殖,分析导致槟榔碱10 μmol/L组细胞存活率显著上升的原因可能是孔板边缘效应导致培养液挥发所致。
3.3 槟榔碱对LPS诱导的BV2细胞NO含量的影响
如图3所示,与空白组相比,模型组BV2细胞中NO含量显著增加(P<0.001)。与模型组相比,不同浓度的槟榔碱组预处理使BV2细胞NO含量显著降低(P<0.001)。结果表明,槟榔碱可以在一定程度上抑制LPS诱导的NO释放。
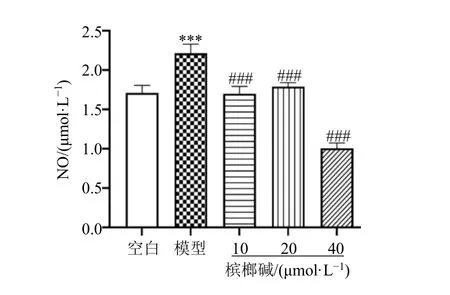
图3 槟榔碱对LPS诱导的BV2细胞NO含量的影响(,n=5)Fig.3 Effect of arecoline on LPS induced content of NO in BV2 cells (,n=5)
3.4 槟榔碱对LPS诱导的BV2细胞TLR4/NF-κB信号通路相关蛋白的影响
与空白组相比,BV2细胞经LPS处理后TLR4、p-p65/p65、iNOS、COX2蛋白水平显著升高(P<0.001),而槟榔碱组干预显著逆转了此现象(P<0.05、0.01、0.001),且呈浓度相关性。此结果表明槟榔碱可能通过调控TLR4/NF-κB信号通路来减轻LPS诱导的BV2细胞炎症,见图4。
3.5 槟榔碱对LPS诱导的BV2细胞PI3K/Akt信号通路相关蛋白的影响
与空白组相比,模型组BV2细胞PI3K、p-Akt/Akt蛋白水平显著升高(P<0.001);与空白组相比,槟榔碱10、40 μmol/L组可显著降低PI3K蛋白水平(P<0.01、0.001),槟榔碱20、40 μmol/L组p-Akt/Akt蛋白水平出现显著下降(P<0.001)。此结果表明在槟榔碱可能通过调控PI3K/Akt信号通路来减轻LPS诱导的BV2细胞炎症,见图5。
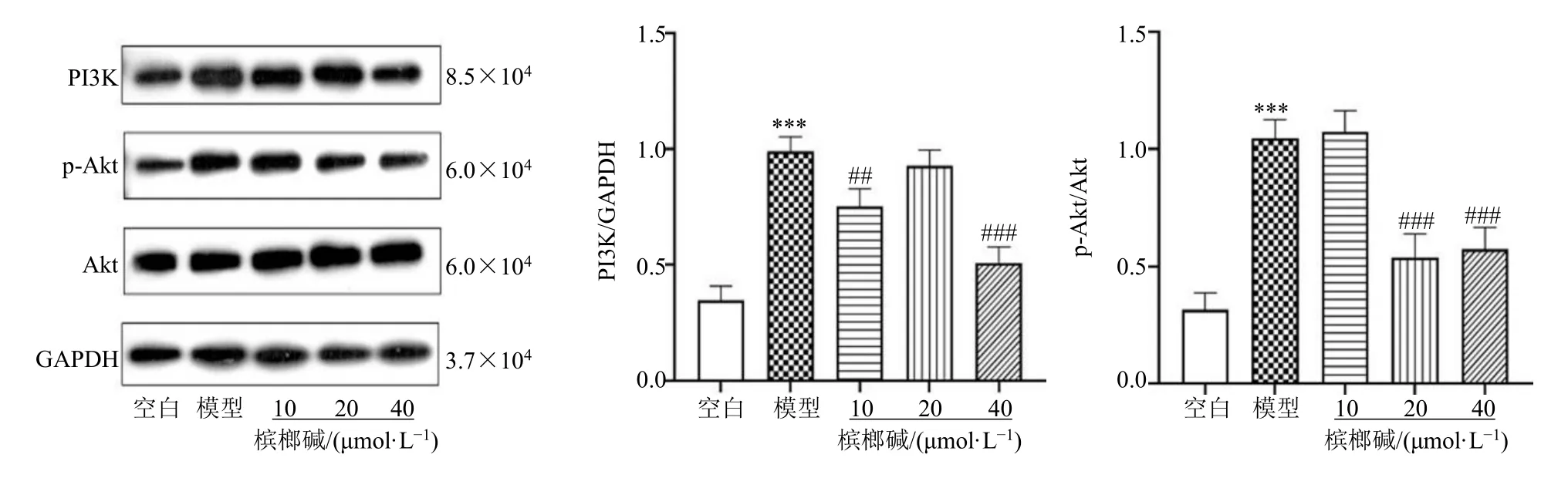
图5 槟榔碱对LPS诱导的BV2细胞PI3K/Akt信号通路相关蛋白的影响(,n=3)Fig.5 Effect of arecoline on PI3K/Akt signaling pathway-related proteins induced by LPS in BV2 cells (,n=3)
3.6 槟榔碱对LPS诱导的BV2细胞炎症因子的影响
采用qPCR和ELISA实验测定槟榔碱对LPS诱导的BV2细胞炎症因子的影响。qPCR结果显示,模型组BV2细胞中炎症因子TNF-α、IL-6、IL-1β、iNOSmRNA相对表达量显著增加(P<0.001),槟榔碱各剂量组BV2细胞中炎症因子的mRNA相对表达量显著下降(P<0.05、0.01、0.001)。ELISA结果显示,模型组TNF-α、IL-6、IL-1β水平显著增加,IL-10水平显著降低(P<0.05、0.01、0.001);槟榔碱各剂量组TNF-α、IL-6、IL-1β水平显著降低,IL-10水平显著升高(P<0.01、0.001),见图6。

图6 槟榔碱对LPS诱导的BV2细胞炎症因子的影响(,n=5)Fig.6 Effect of arecoline on LPS induced release of inflammatory factors in BV2 cells (,n=5)
4 讨论
本研究结果表明,槟榔碱可显著抑制LPS诱导BV2细胞中NO的释放,降低细胞中COX2、iNOS、TLR4蛋白及TNF-α、IL-6、IL-1βmRNA的表达,表明槟榔碱具有显著的抗炎作用,对LPS诱导的BV2细胞神经炎症具有显著改善效果,这与文献报道一致[18-19]。此外,本研究还发现LPS诱导提高了PI3K与p-Akt蛋白水平,而槟榔碱干预则能显著降低PI3K、p-Akt蛋白水平。当Akt被激活时,随之激活了下游促炎趋化因子NF-κB,大量炎症因子释放,聚集于炎症组织细胞,加重炎症反应[21]。推测槟榔碱通过抑制Akt磷酸化,阻止NF-κB的激活,降低炎症因子TNF-α、IL-6、IL-1β的释放,发挥抗炎作用。
TLR4在小胶质细胞中广泛表达[22],其可通过外源性和内源性受体,结合相应炎症因子,完成炎症信号的传导,激发细胞炎症反应。多项研究表明,TLR4在炎症调节中起着关键作用[9,23]。LPS能够结合BV2小胶质细胞膜上的TLR4受体,上调TLR4蛋白表达,激活下游MyD88依赖性信号通路传递炎症信号,进一步激活NF-κB,从而诱导了炎症反应[24-25]。激活的NF-κB随之进入细胞核,与特定DNA有序结合,促进炎症因子(TNF-α、IL-6、IL-1β)表达,加剧炎症反应,严重损伤细胞组织。此外,分布在神经元内的NO也是机体促进细胞炎症的重要介质[26],激活的小胶质细胞可表达大量iNOS,导致细胞产生大量NO,而iNOS和COX2是NF-κB通路下游的2个靶点,大量游离NO的产生和NF-κB通路的激活也会使得iNOS和COX2高度表达,一并加重细胞炎症[27]。本研究结果表明,在LPS诱导损伤的BV2小胶质细胞炎症模型中,TLR4和p65,炎症蛋白COX2和iNOS的表达显著上升,提示小胶质细胞BV2中p65核转位,下游炎症通路被激活。后续实验中也发现模型组中TNF-α、IL-6、IL-1β蛋白表达增多,细胞炎症加剧。而槟榔碱能够显著抑制TLR4和p65,炎症蛋白COX2和iNOS表达、抑制了p65的核转位以及下游NF-κB炎症通路的过度激活。
此外,PI3K是一种脂质激酶,可诱导Akt磷酸化[28],调节各种细胞内的下游信号如细胞增殖、凋亡、自噬和分化,从而减轻细胞炎症[29]。研究表明,PI3K/Akt信号通路可以调控包括IL-6、IL-1β和TNF-α在内的多种炎症因子[30]。当PI3K/Akt信号通路被激活后,可抑制TLR4的表达,从而减轻下游NF-κB炎症通路的激活,下调炎症因子IL-6、IL-1β、TNF-α的释放,炎症反应得到缓解[31]。本研究发现,LPS诱导可明显促使BV2小胶质细胞中PI3K与p-Akt过表达,提示炎症通路被激活,与之对应的qPCR结果中显示,炎症因子IL-6、IL-1β、TNFα的释放增加,细胞中炎症反应加剧。当槟榔碱预处理后,小胶质细胞BV2中PI3K与p-Akt含量显著下降,并且通路下游炎性因子IL-6、IL-1β、TNFα的释放得以抑制,提示炎症反应减弱。结果表明,槟榔碱可通过调节TLR4/NF-κB、PI3K/Akt信号通路抑制神经炎症反应发挥改善功效。
利益冲突所有作者均声明不存在利益冲突
