基于网络药理学和分子对接探讨木糖-邻苯三酚结合物对脓毒症相关急性肾损伤的作用机制
2024-03-26谢静岚洪阁刘天军
谢静岚,洪阁,刘天军
1.天津中医药大学,天津 301617
2.中国医学科学院 北京协和医学院 生物医学工程研究所 天津市生物医学材料重点实验室,天津 300192
脓毒症是机体对感染产生的炎症反应失调而引起的生理学和器官功能损害的临床综合征,常见于基础疾病严重或抵抗力差的患者,如严重创伤、烧伤、重症肺炎和外科大手术等[1-2]。脓毒症的发病率和死亡率都很高,可累及多个器官,其中肾脏是脓毒症的易损器官之一,严重脓毒症患者中约有一半的病例会发生急性肾损伤[3-4]。脓毒症相关急性肾损伤临床上主要表现为肾脏功能突然下降,肌酐和尿素氮水平增加,肾小球滤过率(GFR)和尿量减少,严重时甚至出现酸碱平衡失调、电解质紊乱和各种全身并发症[5-7]。脓毒症相关急性肾损伤的发病机制较为复杂,国内外学者大多认为其与免疫炎症反应、微循环功能障碍和代谢重编程等有关[8-11]。目前,临床上尚无切实可靠的脓毒症相关急性肾损伤治疗方法,常规干预措施主要以对症支持为主,如液体复苏、血液净化、药物升压和肾脏替代等。最近有研究表明,脓毒症相关急性肾损伤的发生与肾小管上皮细胞中过量的活性氧有关,不少抗氧化剂在缓解实验性脓毒症相关急性肾损伤中显示出积极的作用,如N-乙酰半胱氨酸、烟酰胺腺嘌呤二核苷酸、表没食子儿茶素没食子酸酯等[12-15]。
植物中的多酚类化合物具有很强的抗氧化活性,其可以清除活性氧自由基,防止组织器官被氧化损伤。本实验室前期将小分子糖与多羟基酚反应合成了一系列植物多酚类似物,体外抗氧化研究结果显示木糖-邻苯三酚结合物(XP)具有良好的自由基清除能力,可以显著抑制过氧化氢诱导的人血管内皮细胞损伤[16]。随后,尝试将XP用于预防各种内源性或外源性毒性物质导致的大鼠急性肾损伤,发现其可以明显减轻顺铂、碘海醇或脂多糖引起的肾功能下降和病理学损伤,机制与减少肾小管细胞凋亡、维持线粒体结构与功能、抑制氧化应激有关,但其具体的作用靶点和机制尚不清楚[17]。
因此,本研究采用网络药理学和分子对接相结合的方法寻找XP改善脓毒症相关急性肾损伤的核心靶点,并分析核心靶点所涉及的炎症信号通路,最后通过动物实验验证XP对炎症通路的影响和肾脏保护作用机制,以期为临床上脓毒症相关急性肾损伤的防治提供新思路。
1 材料
1.1 药品
XP(白色固体粉末,本实验室自行合成,经HPLC面积归一化法检测质量分数>98%),化学结构式见图1,相对分子质量为384.33。
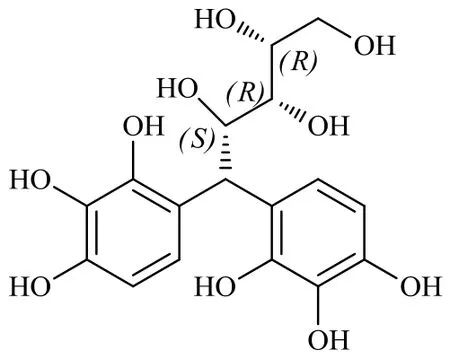
图1 XP的化学结构式Fig.1 Chemical structure of XP
1.2 实验动物
SD大鼠40只,雄性,SPF级,6周龄,体质量(200±20)g,购于北京华阜康生物科技股份有限公司,许可证号SCXK(京)2019-0008,饲养于清洁级实验动物房,温度(25±2)℃,环境相对湿度(50±5)%,12 h/12 h昼夜交替光照,期间正常饮食、饮水。动物实验方案由中国医学科学院放射医学研究所实验动物伦理委员会批准(批准号IRMDWLL-2023245)。
1.3 实验试剂和仪器
脂多糖(LPS,美国Sigma公司,批号0000153963);地塞米松磷酸钠注射液(天津金耀集团湖北天药药业股份有限公司,批号52212261);生理盐水(石家庄四药有限公司,批号2301191907);苏木素、伊红染液(北京中杉金桥生物技术有限公司,批号150916、150917);戊巴比妥钠(美国Merck公司,批号P11011);血清肌酐(CRE)检测试剂盒(深圳迈瑞生物医疗电子股份有限公司,批号141123003);血尿素氮(BUN)检测试剂盒(厦门英科新创科技股份有限公司,批号2103300907);大鼠中性粒细胞明胶酶相关脂质运载蛋白NGAL酶联免疫吸附检测试剂盒(浙江慧珩生物科技有限公司,批号EYX-DD02377);大鼠肾损伤分子(KIM-1)酶联免疫吸附检测试剂盒(上海羽朵生物科技有限公司,批号YDX1123);BCA蛋白质浓度检测试剂盒(北京索莱宝科技有限公司,批号PC0020);磷脂酰肌醇-3-激酶(PI3K)一抗、蛋白激酶B(Akt)一抗、p-AKT一抗(万类生物,批号WL02240、WL0003b、WLP001a);p-PI3K一抗(武汉爱博泰克生物科技有限公司,批号AP0854);全自动生化分析仪(深圳迈瑞生物医疗电子股份有限公司,型号BS-360S)。
2 方法
2.1 XP药物靶点的预测和脓毒症相关急性肾损伤疾病靶点的获取
通过Swiss Target Prediction数据库(http://www.swisstargetprediction.ch)和PharmMapper数据库(http://lilab-ecust.cn/pharmmapper/submitfile.html)预测XP的药物靶点;以“lipopolysaccharide induced acute kidney injury”为关键词,在GeneCards(https://www.genecards.org)、Drug Bank(https://go.drugbank.com)、OMIM(https://omim.org)数据库中检索脓毒症相关急性肾损伤的相关靶点,合并3个数据库的检索结果,去重后得到脓毒症相关急性肾损伤的疾病靶点;运用Venny 2.1.0在线网站(https://bioinfogp.cnb.csic.es/tools/venny)将药物靶点和疾病靶点取交集,绘制韦恩图,再用Uniprot数据库(https://www.uniprot.org/id-mapping)进行靶点信息校正,即得XP防治脓毒症相关急性肾损伤的潜在靶点。
2.2 基因本体(GO)功能及京都基因与基因组百科全书(KEGG)通路富集分析
将XP防治脓毒症相关急性肾损伤的潜在靶点导入DAVID数据库(https://david.ncifcrf.gov)进行GO功能和KEGG通路富集分析,设置生物种类为“homo sapiens”,P<0.05。选取排名前10位的GO功能和KEGG通路条目,利用微生信在线分析平台(https://www.bioinformatics.com.cn)绘制GO功能柱形图和KEGG通路气泡图。
2.3 蛋白相互作用(PPI)网络的构建及核心靶点的筛选
将XP防治脓毒症相关急性肾损伤的潜在靶点导入STRING数据库(https://cn.string-db.org)构建PPI网络,删除游离靶点,再导入Cytoscape 3.9.1软件进行网络可视化分析。根据degree值大小,选取排名前10位蛋白作为XP防治脓毒症相关急性肾损伤的核心靶点。
2.4 分子对接
采用ChemBioDraw软件绘制XP的2D结构,并导入Schrödinger软件用LigPrep模块进行结构优化和3D结构转换,保存成sdf格式;检索PDB数据库(https://www.rcsb.org)下载核心靶点的3D结构,并导入Schrödinger软件用Protein Preparation Wizard模块进行加氢、去水、氢键优化和能量最小化,保存成pdb格式;使用Schrödinger软件的Glide模块完成XP和核心靶点的分子对接,对接模式为柔性对接,对接精度为标准对接(SP),计算对接得分(docking score),并以对接结合能小于-6.0 kJ/mol作为配体和受体结合较好的判定标准,最后在PyMOL软件中进行分子对接结果的可视化分析。
2.5 动物实验验证
2.5.1 脓毒症相关急性肾损伤模型构建、分组及给药 将40只雄性SD大鼠适应性饲养1周后,随机分为对照组、模型组、地塞米松(3 mg/kg[18])组和XP组(200 mg/kg[19],溶于生理盐水),每组10只。除对照组外,其余各组大鼠均ip 10 mg/kg LPS溶液构建脓毒症相关急性肾损伤模型[20-22]。从造模前7 d开始,XP组ig给药,1次/d,连续给药7 d;对照组和模型组同时给予等体积的生理盐水,1次/d;而地塞米松组于造模前1 h单次ip地塞米松磷酸钠注射液[23]。
2.5.2 取材 造模后用代谢笼收集4 h内各组大鼠的尿液,24 h后收集各组血液样本,最终使用3%的戊巴比妥钠进行麻醉,脊椎脱臼处死,收集大鼠肾脏并称质量。
2.5.3 肾功能指标评估 收集血液,离心取上清,利用全自动分析仪测定大鼠血清中CRE和BUN的水平;收集尿液,使用ELISA试剂盒检测尿液中KIM-1和NGAL的水平。
2.5.4 肾组织病理学观察 收集肾组织放置于4%多聚甲醛中固定24 h,肾组织脱水、石蜡包埋、4 μm切片、苏木素-伊红(HE)染色,用树脂封片。风干后于显微镜下观察大鼠肾脏病理情况并拍照。
2.5.5 蛋白免疫印迹法检测大鼠肾脏组织中PI3K、p-PI3K、Akt、p-Akt蛋白的表达 用组织匀浆器将组织肾脏研磨至均匀液体,4 ℃、12 000×g离心30 min,取上清液,并用BCA试剂盒检测蛋白浓度,使用5%的浓缩胶和10%的分离胶经SDS-PAGE电泳分离蛋白,一抗稀释比例为1∶1 000,且按照说明书进行稀释,4 ℃过夜,洗膜,曝光并置于凝胶成像系统仪显影,最终使用Image J软件进行Western blotting条带灰度分析。
2.6 统计学分析
使用GraphPad Prism 9.5.1软件进行统计分析和图形绘制。采用单因素方差分析(Oneway ANOVA)进行组间比较。
3 结果
3.1 XP作用于脓毒症相关急性肾损伤的潜在靶点
通过检索2.1项下所述数据库进行筛选,将结果转换为标准基因名,并经去重合并后,得到XP药物作用靶点167个;脓毒症相关急性肾损伤疾病靶点共4 423个。最后利用Venny 2.1.0取交集得到XP作用于脓毒症相关急性肾损伤的潜在靶点111个,见图2。

图2 XP-脓毒症致急性肾损伤Venn图Fig.2 Venn diagram of XP and sepsis associated acute kidney injury
3.2 GO功能及KEGG通路富集分析结果
将上述潜在靶点上传至DAVID数据库后,进行GO功能富集分析,获得生物过程(BP)共271条(P<0.05),主要包括炎症反应、细胞凋亡过程的负调控、对外源性刺激的反应、蛋白质磷酸化、对脂多糖的反应、蛋白激酶B信号传导的正调控等;细胞组分(CC)共60条,主要包括膜的组成、细胞外分泌体、线粒体、内膜结合细胞器等;分子功能(MF)共100条,主要包括ATP结合、酶结合、蛋白质丝氨酸/苏氨酸/酪氨酸激酶活性等,见图3。KEGG富集分析结果共获得119条生物学通路,可得潜在靶点主要涉及的途径有代谢途径、癌症途径、PI3K/Akt信号通路、促分裂原活化蛋白激酶(MAPK)信号通路、Rap1信号通路、叉头框蛋白O(FoxO)信号通路等,见图4。

图3 GO功能富集分析图Fig.3 GO functional enrichment analysis
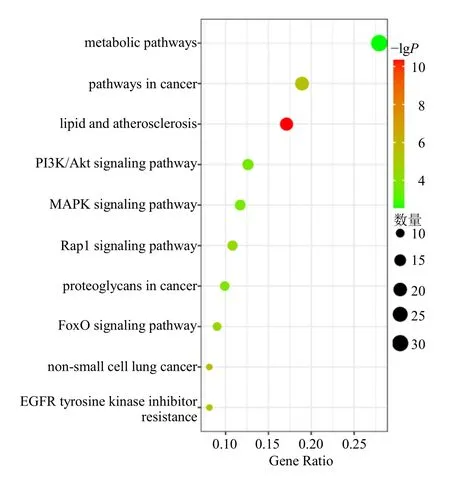
图4 KEGG通路富集分析图Fig.4 KEGG pathway enrichment analysis
3.3 潜在靶点PPI网络图
PPI网络见图5,共含有111个节点,节点颜色越深,degree值越大;742条边,代表靶点蛋白之间的相互关联。利用Cytoscape 3.9.1插件centiscape 2.2分析了PPI网络图,根据degree值降序排列,选择排名前10位节点作为核心靶点,分别为白蛋白(ALB)、Akt1、甘油醛-3-磷酸脱氢酶(GAPDH)、半胱氨酸蛋白酶(CASP3)、酪氨酸激酶(SRC)、雌激素受体1(ESR1)、热休克蛋白90α家族A类成员1(HSP90AA1)、哈维大鼠肉瘤病毒癌基因同源物(HRAS)、细胞周期蛋白D1(CCND1)、人丝裂原活化蛋白激酶1(MAPK1)。

图5 XP-脓毒症相关急性肾损伤交集靶点PPI网络Fig.5 Target PPI network of XP -sepsis associated acute kidney injury
3.4 分子对接分析结果
使用Schrödinger软件包将XP分别与核心靶点进行分子对接,对接结果见表1,发现XP与核心靶点的结合能均具有较好的结合活性,其数值均小于0,这表明XP与核心靶点可自发结合。分子对接的结合能越小,表明小分子配体和蛋白受体之间互作的可能性越大,可通过影响靶蛋白的结构变化,进而调控相应的信号通路。使用PyMol软件进行可视化处理,可发现结合过程中能够形成氢键,而氢键可以提供分子间特异性识别,这对生物体内的分子识别和信号传导起到重要作用;还可形成ππ堆积相互作用,增加了结合稳定性,见图6。验证了核心靶点均可能在XP作用于脓毒症相关急性肾损伤中发挥重要作用。
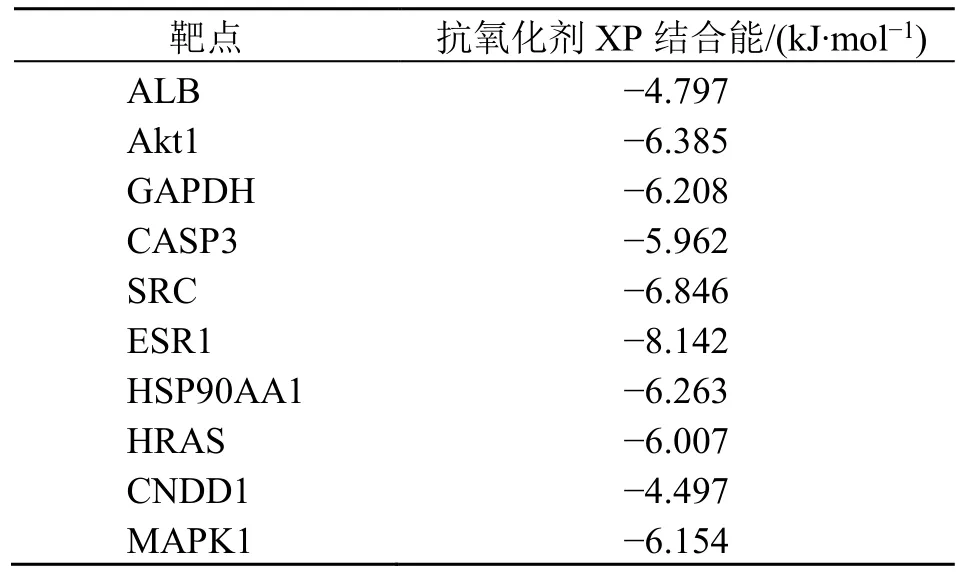
表1 XP与核心靶点分子对接结果Table 1 Molecular docking of XP with core targets

图6 XP与核心靶点分子对接可视化Fig.6 Visualization of docking between core targets and XP
3.5 动物实验验证
3.5.1 XP对脓毒症相关急性肾损伤大鼠肾功能的影响 如图7所示,与模型组比较,XP组和地塞米松预处理组CRE、BUN、KIM-1、NGAL水平均显著降低(P<0.001)。

图7 XP对脓毒症相关急性肾损伤大鼠肾功能损伤的影响(,n=10)Fig.7 Effect of XP on sepsis associated acute kidney injury kidney function damage in rats (,n=10)
3.5.2 XP对脓毒症相关急性肾损伤大鼠肾脏组织的影响 对照组肾小管结构完整,肾小管上皮细胞均一排列在外周,未见明显异常;模型组可见肾小管结构出现严重空泡化,紊乱松散,刷状缘丢失,肾小管上皮细胞脱落形成碎片,肾间质水肿扩张、充满大量炎性细胞。XP组和地塞米松预处理组可明显改善肾小管上皮细胞空泡化、脱落及肿胀,减少了炎性细胞浸润,见图8。

图8 XP对脓毒症相关急性肾损伤大鼠肾形态学的影响(×400)Fig.8 Effect of XP on kidney morphology in sepsis associated acute kidney injury rats (×400)
3.5.3 XP对脓毒症相关急性肾损伤大鼠肾组织PI3K/Akt通路的影响 与模型组比较,XP组和地塞米松预处理组的p-PI3K、p-Akt蛋白表达明显升高(P<0.01、0.001),见图9。
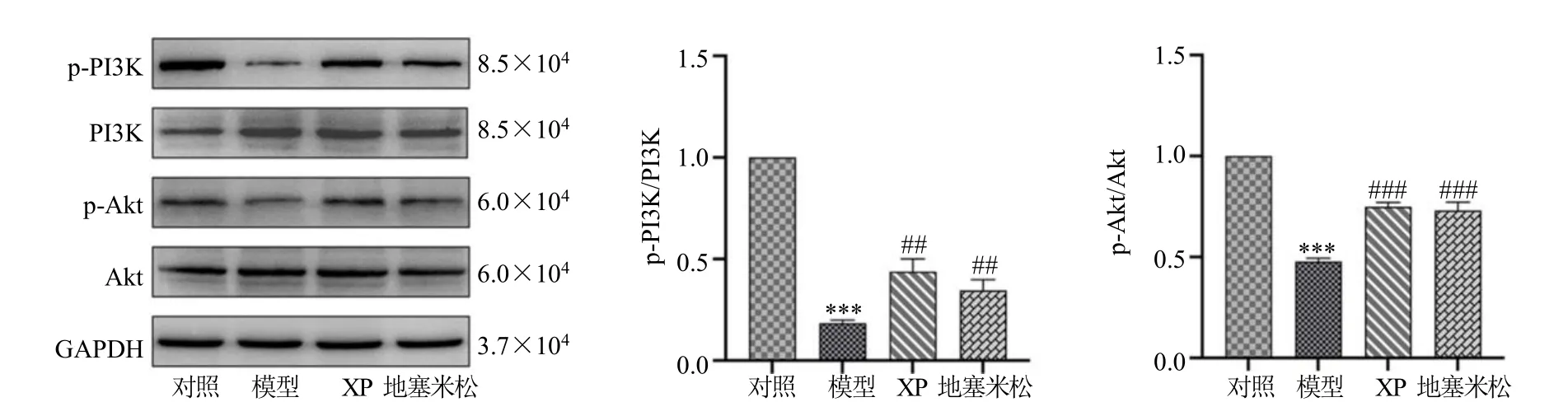
图9 XP对脓毒症相关急性肾损伤大鼠肾脏PI3K/Akt通路活性的影响(,n=10)Fig.9 Effect of XP on the activity of PI3K/AKT pathway in the kidneys of sepsis associated acute kidney injury rats (,n=10)
4 讨论
脓毒症是一种发病率和死亡率都很高,由感染引起的全身炎症反应的综合征,肾脏是主要受影响的器官之一[24]。在脓毒症期间,由于缺氧、氧化反应不完全等,自由基的产生急剧增加,从而抗氧化系统机制严重受损[25-26],因此抗氧化剂在预防和治疗脓毒症相关急性肾损伤上可作为一种有效的治疗策略。有研究表明绿茶中主要活性成分之一表没食子儿茶素没食子酸酯已经显示出通过清除活性氧(ROS)相关的治疗来发挥肾保护作用[27],而本课题组前期通过将醛醣或酮糖与多酚反应,得到表没食子儿茶素没食子酸酯的一系列类似物,发现XP对肾损伤的缓解具有明显疗效。XP是由D-木糖与焦性没食子酸偶联得到的,其化学结构与表没食子儿茶素没食子酸酯最为相似,且具有优异的水溶性,制备简单且无需催化剂,绿色环保,但在对脓毒症相关急性肾损伤的作用机制有待阐明。本研究利用网络药理学通过对数据库的整合,结合分子对接及实验验证深入挖掘XP治疗脓毒症相关急性肾损伤的潜在靶点和作用机制。
KEGG分析中,潜在靶点富集在PI3K/Akt信号通路上的数目较多。PI3K/Akt信号通路可参与炎症、氧化应激等多种病理过程,是调控炎症反应的经典通路,已被证实为脓毒症相关急性肾损伤的治疗靶点[28],并且有研究表明可以通过激活PI3K/Akt信号减轻炎症和凋亡,促进增殖达到治疗脓毒症相关急性肾损伤的效果[29-31]。GO生物过程分析表明XP改善脓毒症相关急性肾损伤的潜在靶点与蛋白质磷酸化、蛋白激酶B信号传导、蛋白激酶活性等有关;表明可能与PI3K/Akt蛋白激酶的活性有关。经PPI网络筛选得ALB、Akt1、GAPDH、CASP3、SRC、ESR1、HSP90AA1、HRAS、CCND1、MAPK1可能为XP改善脓毒症相关急性肾损伤的核心靶点,且分子对接结果显示XP与核心靶点均能够自发结合,其中富集在PI3K/Akt通路中的核心靶点Akt1与XP的结合能最小,为-6.385 kJ/mol,显示出较强烈的结合能力。Akt1是Akt的异构体之一,而Akt是PI3K下游的磷酸化激酶,Akt被PI3K/Akt通路激活后,可以抑制κB激酶的Thr23位点磷酸化,可影响κB激酶参与了细胞凋亡和炎症的基因调节,对于靶向和控制生物合成及代谢途径,包括细胞存活、增殖、自噬和凋亡都很重要[32]。Liu等[33]和Zhang等[34]分别在影剂急性肾损伤和LPS所致急性肾损伤模型中发现通过激活PI3K/Akt可减轻肾功能障碍并降低了氧化应激水平、上皮细胞的凋亡水平及减少了肾小管损伤,此外,还可通过PI3K/Akt信号通路来诱导自噬去除受损的线粒体以减少氧化应激水平[35]。因此,本研究选择PI3K、p-PI3K、Akt、p-Akt蛋白表达验证PI3K/Akt信号通路在XP对脓毒症相关急性肾损伤保护作用中的影响。
实验结果表明,脓毒症相关急性肾损伤的大鼠模型经XP处理后,可明显缓解大鼠肾功能障碍。另外,LPS诱导引起剧烈的炎症反应能够产生和释放大量的促炎细胞因子,导致肾小管上皮细胞的损伤,这被认为是脓毒症相关急性肾损伤主要触发因素之一[34,36-37]。本研究通过对大鼠肾脏进行HE染色可观察到XP减轻了肾脏炎症细胞的浸润,减少了肾小管上皮细胞的脱落及凋亡。最后利用蛋白免疫印迹法检测肾脏组织中PI3K、p-PI3K、Akt、p-Akt蛋白的表达,结果显示XP可显著升高PI3K和Akt蛋白的磷酸化水平。
综上所述,XP防治脓毒症相关急性肾损伤关键蛋白可能是Akt1,并且可能通过增加PI3K、Akt的磷酸化,激活了PI3K/Akt信号通路,缓解了肾功能障碍、减轻肾小管上皮细胞的炎症及凋亡,起到了肾脏保护作用。
利益冲突所有作者均声明不存在利益冲突
