抗中性粒细胞胞浆抗体与系统性红斑狼疮患者疾病活动度的相关性
2024-03-26宋萧怡许程洁张航烽王甲甲
宋萧怡 许程洁 张航烽 王甲甲
1四川省医学科学院·四川省人民医院(电子科技大学附属医院)临床医学检验中心 (成都 610072);2电子科技大学医学院 (成都 610054)
抗中性粒细胞胞浆抗体(anti-neutrophil cytoplasmic antibody,ANCA)是以中性粒细胞及单核细胞胞浆成分为靶抗原的自身抗体[1]。ANCA作为原发性血管炎(ANCA-associated vasculitis,AAV)重要的血清学诊断依据,其诊断AAV的敏感度和特异度均高于90%[2-3]。随着临床研究的深入,ANCA逐渐被发现于系统性红斑狼疮(systemic lupus erythematosus,SLE)患者血清中,有研究[4-5]显示,SLE患者ANCA阳性率高达30% ~ 40%,但关于ANCA对SLE患者的诊断价值一直缺乏系统评价,且已有的研究报道仍存在争议[6-7]。本研究结合系统性红斑狼疮疾病活动性指数(systemic lupus erythematosus disease activity index,SLEDAI)[8]对SLE患者进行分组,探讨ANCA及相关实验室检测指标、临床特征在不同疾病活动状态下的SLE患者中的差异,为临床医生对患者病情作出准确判断,制订精准治疗方案提供理论依据。
1 资料与方法
1.1 研究对象与分组该研究为回顾性研究。将于2018年1月至2021年12月在四川省人民医院就诊的SLE患者1 025例纳入本研究,其中女894例,男131例。
纳入标准如下:(1)符合2019年美国风湿病协会修订的SLE诊断标准[8],(2)首次诊断为SLE;(3)病程少于6个月;(4)无糖皮质激素或免疫抑制药物使用史;(5)无感染疾病史及肿瘤病史。
排除标准如下:(1)合并其他自身免疫性疾病;(2)合并精神类疾病;(3)严重心、肝、肾功能不全;(4)处于妊娠或哺乳期女性;(5)临床资料不全。患者的年龄、性别、临床症状等信息均从患者的病史中获得。
通过SLEDAI评估患者疾病的活动程度,SLEDAI评分≥ 5被认为是一种活动性SLE。本研究经医院伦理委员会批准(伦理号:2022年第176号),所有受试者均知情同意。
1.2 方法收集实验室指标检测结果,其中免疫球蛋白(IgM、IgG、IgA)、血清补体C3/C4、β2-微球蛋白(β2-microglobulin,β2-MG)采用免疫比浊法在西门子BNII上检测;血红蛋白,白细胞,血小板计数采用Sysmex XN9000全自动血细胞分析仪检测;肌酐、尿素采用罗氏Cobas8000全自动生化分析仪检测;尿红细胞、白细胞计数采用Sysmex UF500i全自动尿液分析仪检测;ANCA采用间接免疫荧光法在欧蒙Sprinter XL上检测,结果判读采用欧蒙Star Ⅲ plus荧光显微镜进行;抗MPO、PR3、dsDNA、核小体和组蛋白抗体的检测采用免疫印迹法在欧蒙EUROBlotOne全自动免疫印迹仪检测,抗dsDNA抗体的定量检测采用化学发光法在浩欧博Smart 6500上检测。血清IL-2、IL-4、IL-6、IL-10、TNF-α和IFN-γ水平的检测采用ELISA法(R&D)。所有标本检测均严格按照标准操作规程进行,标本检测当日质控均在控。
1.3 统计学方法所有数据均采用SPSS 22.0进行分析。符合正态分布的计量资料以(±s)表示,两样本比较采用独立样本t检验;计数资料用例(%)表示,组间比较采用χ2检验。P< 0.05为差异有统计学意义。
2 结果
2.1 两组SLE患者临床特征的比较本研究纳入1 025例新发SLE患者,根据其疾病活动状态分为两组:非活动组(SLEDAI评分=0 ~ 4分,n= 750),活动组(SLEDAI评分≥ 5分,n= 275)。两组患者在年龄、性别等方面均差异无统计学意义。对两组患者的临床特征进行比较,结果发现活动组患者肾、肺、皮肤、关节炎表现的发生率明显高于非活动组(均P< 0.05)。两组患者在神经精神疾病、浆膜炎和血液学表现的发生率差异无统计学意义(P> 0.05)。见表1。

表1 两组患者临床特征比较Tab.1 Difference of demographic data between the two groups in SLE patients 例(%)
2.2 两组SLE患者ANCA及自身抗体的分布在两组患者中,最常见的ANCA表达模式是核周型ANCA(perinuclear ANCA,p-ANCA),且活动组患者p-ANCA的阳性率显著高于非活动组(P< 0.05)。所有患者仅有5例表现为胞浆型ANCA(cytoplasmic ANCA,c-ANCA)。25例患者对髓过氧化物酶(myeloperoxidase,MPO)有反应,但所有患者均对蛋白酶3(proteinase 3,PR3)无反应。由于抗dsDNA、抗核小体和抗组蛋白抗体与SLE的发病密切相关,本研究对两组患者上述自身抗体的差异进行分析,结果发现,抗dsDNA抗体,抗核小体抗体的阳性率在两组间差异显著(P< 0.05)。同时,活动组SLEDAI评分明显高于非活动组,以上证据均证实了活动组患者的疾病活动状态。见表2。
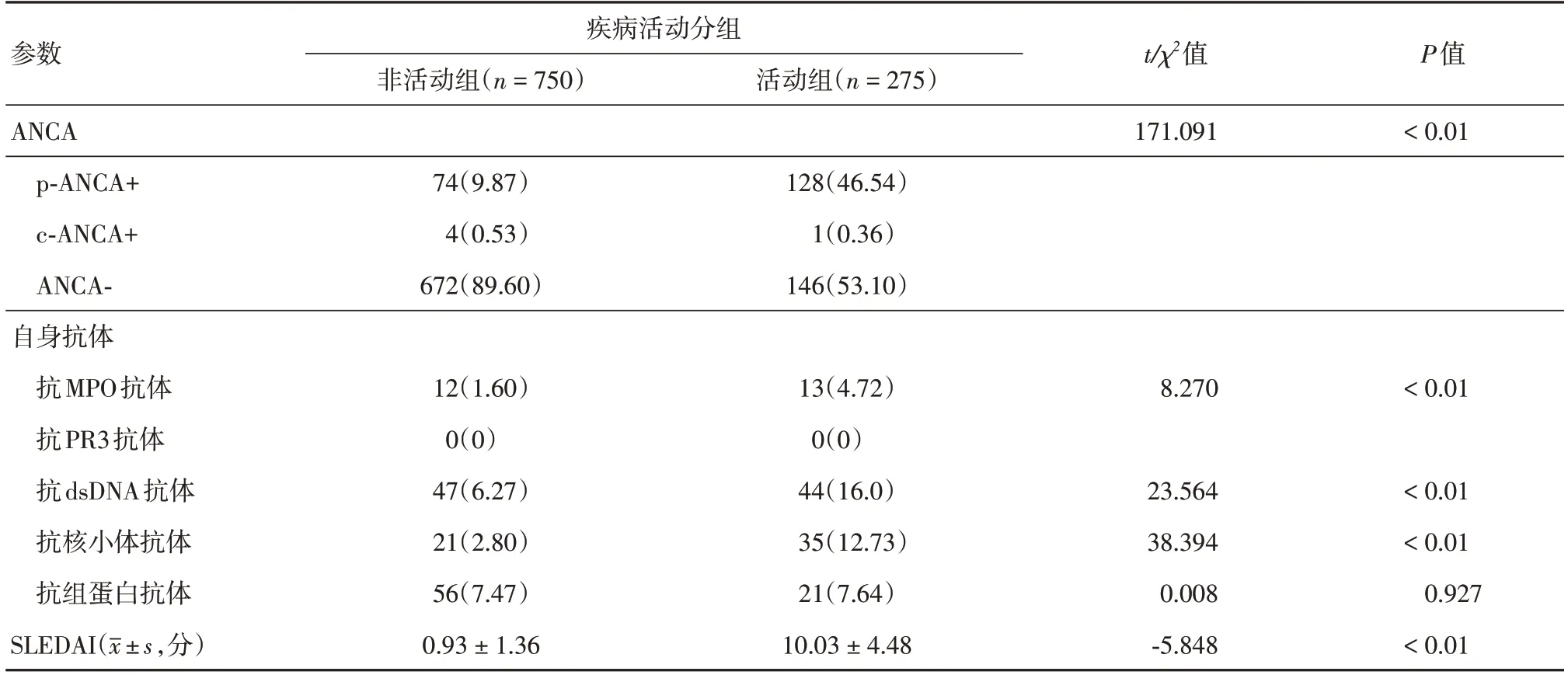
表2 两组SLE患者ANCA及自身抗体的分布Tab.2 Distribution of ANCA and autoantibody in SLE patients 例(%)
2.3 SLE患者实验室指标和SLEDAI评分的比较根据ANCA的表达情况,将患者分为p-ANCA+与p-ANCA-亚组,结果显示,p-ANCA+亚组患者血清β2-MG水平明显高于p-ANCA-亚组(P< 0.05),相反,p-ANCA+亚组患者血清白蛋白、C3、C4水平明显低于p-ANCA-亚组(P< 0.01、P< 0.05、P< 0.05);同时,活动组患者p-ANCA+亚组的抗dsDNA抗体水平和SLEDAI评分均高于p-ANCA-亚组(P< 0.01);两组间其他指标均未发现明显差异。然而,非活动组患者p-ANCA+和p-ANCA-亚组间所有指标均未发现明显差异。见表3。
表3 活动组SLE患者实验室指标和SLEDAI评分的比较Tab.3 Difference of laboratory tests and SLEDAI scores in active SLE patients ±s
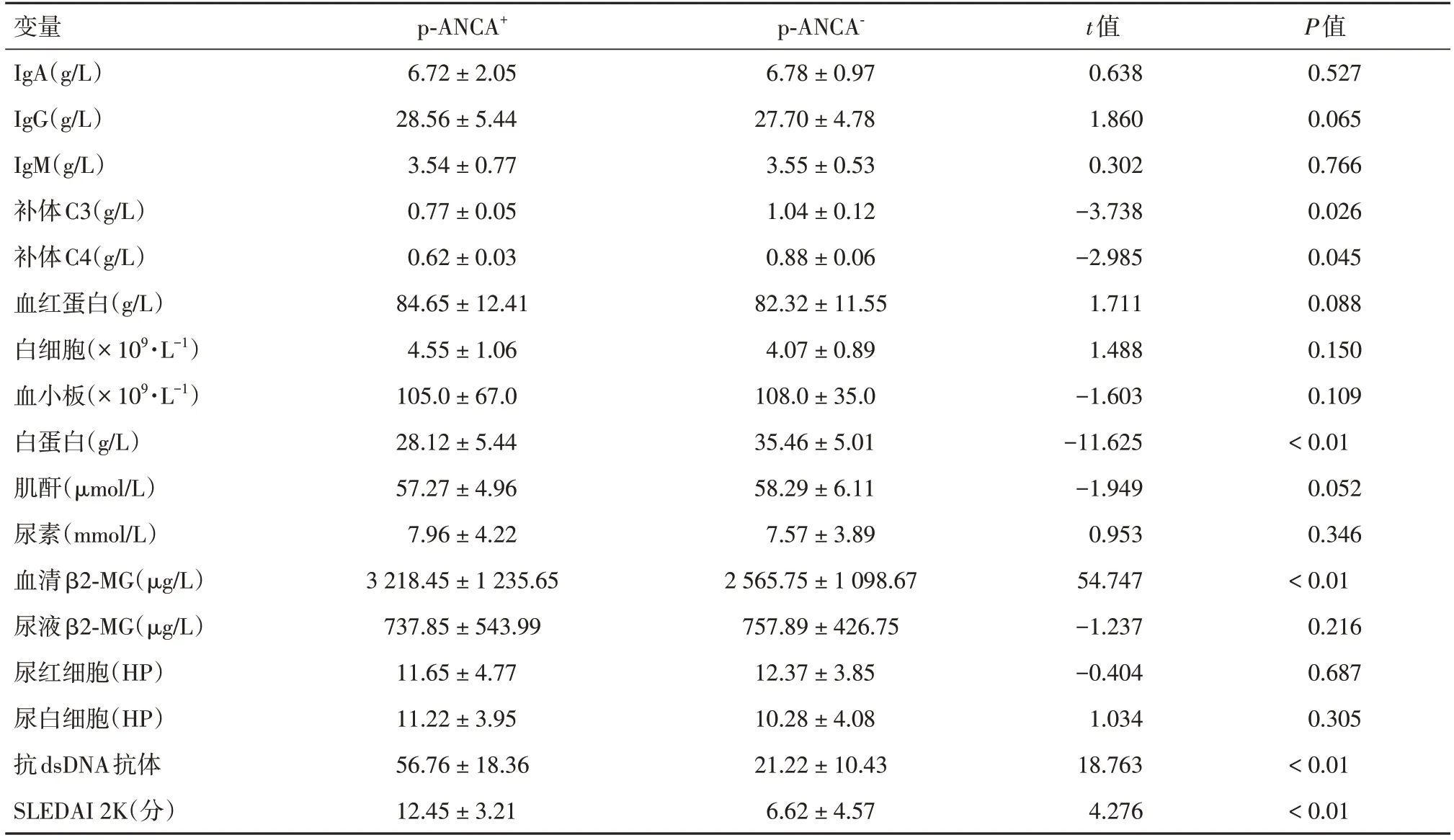
表3 活动组SLE患者实验室指标和SLEDAI评分的比较Tab.3 Difference of laboratory tests and SLEDAI scores in active SLE patients ±s
变量IgA(g/L)IgG(g/L)IgM(g/L)补体C3(g/L)补体C4(g/L)血红蛋白(g/L)白细胞(× 109·L-1)血小板(× 109·L-1)白蛋白(g/L)肌酐(μmol/L)尿素(mmol/L)血清β2-MG(μg/L)尿液β2-MG(μg/L)尿红细胞(HP)尿白细胞(HP)抗dsDNA抗体SLEDAI 2K(分)p-ANCA+6.72 ± 2.05 28.56 ± 5.44 3.54 ± 0.77 0.77 ± 0.05 0.62 ± 0.03 84.65 ± 12.41 4.55 ± 1.06 105.0 ± 67.0 28.12 ± 5.44 57.27 ± 4.96 7.96 ± 4.22 3 218.45 ± 1 235.65 737.85 ± 543.99 11.65 ± 4.77 11.22 ± 3.95 56.76 ± 18.36 12.45 ± 3.21 p-ANCA-6.78 ± 0.97 27.70 ± 4.78 3.55 ± 0.53 1.04 ± 0.12 0.88 ± 0.06 82.32 ± 11.55 4.07 ± 0.89 108.0 ± 35.0 35.46 ± 5.01 58.29 ± 6.11 7.57 ± 3.89 2 565.75 ± 1 098.67 757.89 ± 426.75 12.37 ± 3.85 10.28 ± 4.08 21.22 ± 10.43 6.62 ± 4.57 t值0.638 1.860 0.302-3.738-2.985 1.711 1.488-1.603-11.625-1.949 0.953 54.747-1.237-0.404 1.034 18.763 4.276 P值0.527 0.065 0.766 0.026 0.045 0.088 0.150 0.109< 0.01 0.052 0.346< 0.01 0.216 0.687 0.305< 0.01< 0.01
2.4 两组SLE患者血清细胞因子的比较在非活动组中,p-ANCA+与p-ANCA-组患者血清IL-2、IL-4、Il-6、IL-10、TNF-α、IFN-γ水平差异均无统计学意义(P> 0.05)。在活动组中,p-ANCA+亚组患者血清IL-6水平差异有统计学意义(P< 0.05)。见表4。进一步分析IL-6在SLE患者疾病活动中的作用,不同SLEDAI评分的患者IL-6水平见图1,随SLEDAI评分的增加,IL-6水平也明显升高。
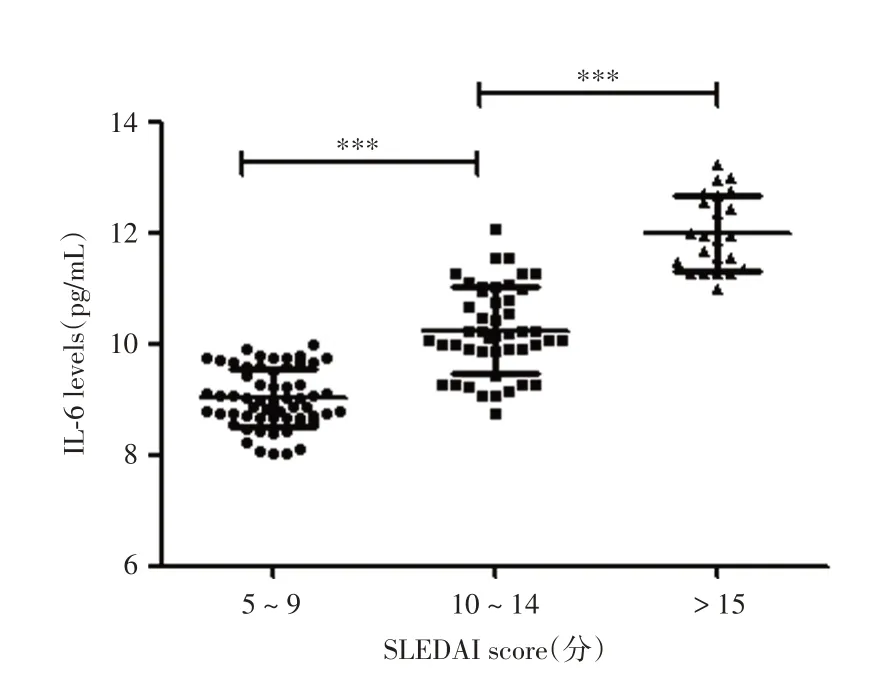
图1 p-ANCA+亚组患者SLEDAI评分与IL-6水平的相关性Fig.1 IL-6 levels of patients with different SLEDAI scores of p-ANCA+ subgroups in the active group
表4 两组SLE患者血清细胞因子的比较Tab.4 Difference of cytokine levels between the two groups in SLE patients ±s,pg/mL
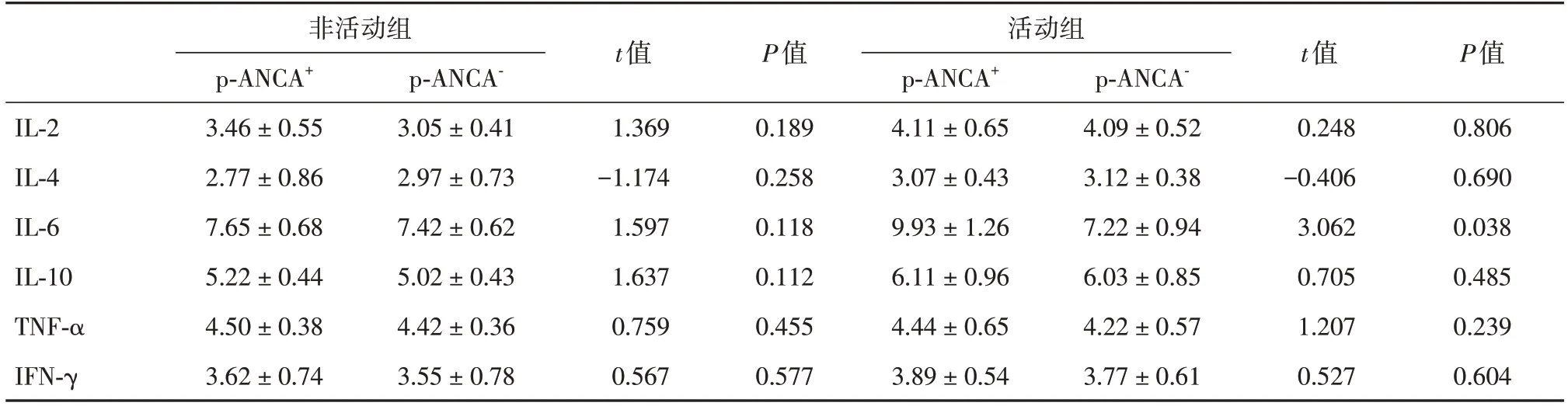
表4 两组SLE患者血清细胞因子的比较Tab.4 Difference of cytokine levels between the two groups in SLE patients ±s,pg/mL
非活动组p-ANCA+3.46 ± 0.55 2.77 ± 0.86 7.65 ± 0.68 5.22 ± 0.44 4.50 ± 0.38 3.62 ± 0.74 t值P值t值P值IL-2 IL-4 IL-6 IL-10 TNF-α IFN-γ p-ANCA-3.05 ± 0.41 2.97 ± 0.73 7.42 ± 0.62 5.02 ± 0.43 4.42 ± 0.36 3.55 ± 0.78 1.369-1.174 1.597 1.637 0.759 0.567 0.189 0.258 0.118 0.112 0.455 0.577活动组p-ANCA+4.11 ± 0.65 3.07 ± 0.43 9.93 ± 1.26 6.11 ± 0.96 4.44 ± 0.65 3.89 ± 0.54 p-ANCA-4.09 ± 0.52 3.12 ± 0.38 7.22 ± 0.94 6.03 ± 0.85 4.22 ± 0.57 3.77 ± 0.61 0.248-0.406 3.062 0.705 1.207 0.527 0.806 0.690 0.038 0.485 0.239 0.604
2.5 活动组SLE患者临床特征的比较为进一步确定p-ANCA是否参与活动组患者不同临床特征的发生,对p-ANCA+与p-ANCA-亚组患者的不同临床特征进行比较(表5),结果发现,p-ANCA+亚组的狼疮性肾炎(lupus nephritis,LN)的发生率明显高于p-ANCA-亚组(P< 0.05)。进一步对SLE患者的肾脏病理情况,包括LN的分型、肾组织的活动指数(activity index,AI)和慢性指数(chronicity index,CI)进行分析,结果显示,活动组患者p-ANCA+和p-ANCA-亚组在LN分型、AI和CI方面差异均无统计学意义(P> 0.05)。
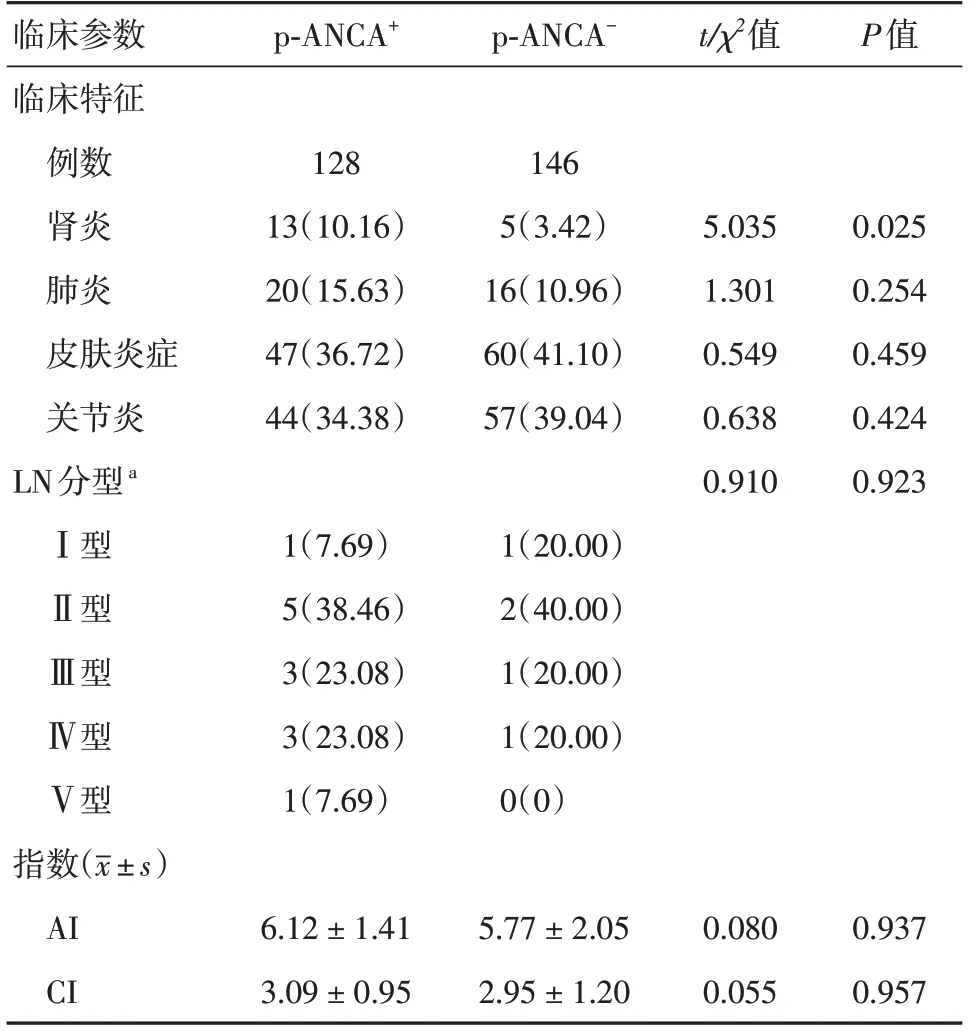
表5 活动组SLE患者临床特征的比较Tab.5 Difference of clinical characteristics in active SLE patients 例(%)
3 讨论
作为血管炎的一种重要的生物标志物,ANCA与小血管炎的相关性已得到充分报道[9]。然而,并非所有AAV患者ANCA均表现为阳性,且ANCA在其他自身免疫性疾病中也有报道[10-12],如SLE、炎症性肠病和原发性硬化性胆管炎等。事实上,血管炎是SLE患者常见的临床表现,但ANCA在SLE疾病中的临床价值仍缺乏系统性的评价。有研究[13]认为,SLE患者的ANCA阳性与疾病活动性和严重程度相关。LACETERA等[14]的报道显示,ANCA阳性的LN患者通常疾病状态更为严重,需要及时的诊治以防止不可逆的肾脏损伤的发生。本研究结果显示,活动组SLE患者血清ANCA阳性率明显高于非活动组,这与以往的大多数研究一致。但也有研究[15]认为,ANCA与SLE活动不存在相关性,造成结果差异的主要原因可能是患者的选择标准不一致。
本研究结果显示,无论是活动组还是非活动组患者,ANCA阳性的主要表达模式为p-ANCA,但大多数病例并未检测到抗MPO或抗PR3抗体。由于不同的ANCA类型和靶抗原与不同的临床疾病相关,如抗MPO抗体的荧光模型以p-ANCA为主,主要与显微镜下多血管炎有关[16];与乳铁蛋白,人类白细胞弹性蛋白酶、杀菌/渗透性增加蛋白、β-葡萄糖醛酸酶等靶抗原相关的疾病包括SLE、类风湿关节炎、炎症性肠病等[17-18]。因此推测SLE患者血清p-ANCA的存在可能与MPO/PR3之外的其他次要或未知靶抗原有关。
在本研究中,活动组患者抗dsDNA、抗核小体抗体阳性率及SLEDAI评分显著升高,间接证实了活动组患者的疾病活动状态。为进一步分析p-ANCA在SLE疾病活动中的作用,将两组SLE患者进一步细分为p-ANCA+、p-ANCA-亚组。结果发现,与p-ANCA-亚组相比,活动组患者p-ANCA+亚组白蛋白、C3、C4水平明显降低,而β2-MG水平显著升高。白蛋白是血浆中最丰富的循环蛋白,它的合成受到生长激素、胰岛素和皮质醇等激素的刺激,同时受到促炎因子的抑制,包括IL-6和TNF-α[19]。血清白蛋白、C3、C4水平的降低可能反映了SLE患者肾脏的损伤和严重程度[20],从以上结果可以推断,p-ANCA可能参与了SLE患者的肾脏损伤。血清β2-MG升高已在许多自身免疫性疾病、感染性疾病中被报道[21]。β2-MG被肾脏清除,肾病患者将表现出更高的血清β2-MG水平。此外,β2-MG已被证明是SLE疾病活动的标志物[22],本研究也显示β2-MG与p-ANCA和SLE疾病活动状态有关。这些发现为p-ANCA参与肾脏损害提供了证据。本研究中有1例患者ANCA检测结果为c-ANCA,由于例数过少,后续病理分析结果并未统计进去。虽然p-ANCA与SLE患者LN的发生密切相关,但p-ANCA与肾组织中LN的分型、AI和CI均无明显的相关性,这与SAID的研究[23]结果不一致。事实上,p-ANCA与各血清学指标、临床特征间的关系是复杂的,采用更大的样本量作进一步的研究可能有助于更好地了解p-ANCA在LN发生中的作用。然而,在非活动组SLE患者中,无论是机体的体液免疫指标,还是机体的血细胞计数、肝肾功能等指标,在p-ANCA+、p-ANCA-亚组间均未发现明显差异,且目前仍未发现有类似报道,这可能是由活动组、非活动组患者p-ANCA特异性的靶抗原不同造成的。
IFN-α与SLE关系密切[24],然而IL-6在SLE中的作用仍存在争议[25]。大多数研究表明,血清IL-6水平可作为疾病活动的标志物,并可能是SLE患者肾脏病变的特异性指标[25]。本研究发现,活动性SLE患者的血清IL-6水平显著升高,且随SLEDAI评分的增加而显著升高,这可能部分解释了SLE患者的疾病活动状态。
综上所述,p-ANCA可能有疾病活动性增高的风险,在SLE患者临床诊疗中应重视ANCA及相关实验室指标的检测。但本研究仍存在一定的局限性,如病例选择的标准、纳入研究的样本量、靶抗原不明确等,因此,仍需进一步扩大样本量、明确靶抗原以系统性阐明p-ANCA在SLE疾病活动中的作用。
