非均相Fenton 降解甲基橙染料废水流化床实验
2024-03-25郭蓉蓉白建军张林琳
郭蓉蓉,刘 欣,陈 爽,白建军,张林琳
(1.中国石油大学(华东)化学化工学院,重质油国家重点实验室,山东青岛 266580;2.中国石化胜利石油管理局有限公司供水分公司,山东东营 257045)
我国印染废水排放量占每年工业废水总排放量35%以上,因其色度高、水量大、COD 高、成分复杂等原因,难以被高效处理,是我国水环境的重要污染源[1-4]。其中甲基橙作为酸性偶氮染料在印染行业中应用广泛,但在还原厌氧条件下会产生毒性强的芳香胺,严重影响人体健康[5-8]。
传统Fenton 氧化法在有机工业废水应用中,可将有机污染物分子降解为低毒或无毒的小分子物质,甚至直接降解成H2O 和CO2[9-11]。但Fenton 反应需要在pH=3~4 的酸性溶液中进行[12-14],降解能力受pH 值影响,·OH 的生成和利用率低;反应中易产生铁泥[15],增加后期处理成本;加药量大[16-17],未反应完全的铁离子会加深出水色度[18-20]。将Fenton 反应应用于流化床反应器中,氧化过程中产生Fe3+以羟基氧化铁晶体(FeOOH)的形式负载在载体表面,减少或抑制铁泥生成[21-24]。方绪亮等[25]研究Fenton 流化床对环氧聚酯废水处理效果,反应效率较静态实验提高30%~50%,污泥产量降低50%;储金宇等[26]研究Fenton 流化床处理偶氮染料废水,反应45 min 后COD 去除率可达84.00%。以上研究都表明Fenton 流化床在印染废水处理中具有很大的潜力。
非均相Fenton 氧化是将Fe2+固定在载体上作为催化剂,通过自身氧化还原实现Fe3+到Fe2+的再生,流化过程中催化剂不断迁移、翻滚和流动,有利于催化剂与染料分子充分接触,提高对染料废水的处理能力。鉴于此,本文应用β-FeOOH/SiO2在流化床装置中对甲基橙染料废水进行处理,操作条件温和,在降解过程中不需要外加酸碱调节体系pH 值,减少降解过程中铁泥的生成量。
1 实验部分
1.1 实验试剂及仪器
甲基橙(CP)、亚甲基蓝(三水)(AR)、叔丁醇(CP)、FeCl3(CP)、H2O2(AR,质量分数30%)购于国药集团化学试剂有限公司;罗丹明B(AR)购于上海阿拉丁生化科技股份有限公司;石英砂(AR)购于天津市巴斯夫化工有限公司。
傅里叶变换红外光谱仪(VERTEX 70 型,德国Bruker 公司);X 射线衍射仪(X' Pert PROMPD,荷兰PANalytical B.V.公司);透射电子显微镜(JEM-2100 UHR,日本JEOL 公司);紫外-可见分光光度计(752N,上海INESA 分析仪器有限公司);台式分光光度计(DR 3900,哈希公司);总有机碳分析仪(TOC-V,日本岛津公司)。
1.2 β-FeOOH/SiO2 的制备
FeCl3溶液60 ℃下水解,将得到的沉淀物离心、洗涤、干燥,得到β-FeOOH 备用;于烧杯中加入蒸馏水、β-FeOOH 固体粉末于室温(25±5)℃下搅拌均匀。按β-FeOOH 与SiO2质量比1∶1 加入120~200 目的SiO2粉末,加入适当蒸馏水,搅拌5 h 得到均匀分散的悬浮液。于水热反应釜中,90 ℃下反应8 h,将得到的沉淀物进行离心、洗涤、干燥,得到β-FeOOH/SiO2,表征见2.1。
1.3 检测方法
1.3.1 浓度测定 甲基橙染料废水进水、出水均使用0.22 μm 滤膜过滤后,采用紫外-可见分光光度计测定甲基橙浓度。水样经0.45 μm 滤膜过滤后,采用邻二氮菲吸光光度法测定体系中的Fe2+、Fe3+含量、草酸钛钾分光光度法[27-28]测定体系中的H2O2含量。
1.3.2 β-FeOOH/SiO2粒径大小的测定 使用筛分法测定β-FeOOH/SiO2粒径大小[29],将β-FeOOH/SiO2依次通过不同孔径的标准筛,经筛分后称量不同粒径范围β-FeOOH/SiO2的质量并计算各自的质量分。β-FeOOH/SiO2平均粒径的计算公式见式(1)。
式中:dps-平均粒径,mm,xi-各分段质量分数;di-各级筛孔直径。
1.4 实验装置设计及流程图
流化床主体部分采用亚克力材质,有效反应体积约为0.140 0 dm3,底座的材质为有机玻璃,底座下端是体积为0.012 6 dm3的缓冲区。图1 为流化床实验装置流程图。β-FeOOH/SiO2平均粒径为0.064 5 mm,加入流化床中,流化床床层高度为1.6 cm。配制1 000 mL,250 mg/L 甲基橙染料废水置于储罐-1 中,加入H2O2溶液,搅拌均匀,匀速进入流化床,与β-FeOOH/SiO2接触,进行流化床实验。

图1 流化床实验装置流程图
2 结果与讨论
2.1 β-FeOOH/SiO2 TEM 表征
对负载后的β-FeOOH/SiO2进行TEM 表征分析(图2)。结果表明,β-FeOOH/SiO2样品无单个SiO2微球,边缘粗糙,说明β-FeOOH 与SiO2单体之间无明显间隙,β-FeOOH/SiO2复配良好(图2a);β-FeOOH/SiO2高分辨率透射电子显微镜HRTEM 图像见图2b。从图2b 中可测得晶面条纹间距为5.2,与β-FeOOH(200)面的晶面间距吻合。β-FeOOH/SiO2的傅里叶变换红外光谱(FT-IR)表征见图13c,与图2a、2b 相比,1 175 cm-1处吸收峰向低波数移动,由于Fe3+的半径大于Si4+的半径,导致Fe-O 的键长大于Si-O 的键长,键力常数减小,发生吸收带红移,表明β-FeOOH 中的铁成功负载在SiO2表面上形成Si-O-Fe 键。

图2
2.2 β-FeOOH/SiO2 催化作用机理
2.2.1 β-FeOOH/SiO2催化机制分析 为探讨·OH 在甲基橙染料废水降解中的作用,加入叔丁醇t-BuOH作对照实验,t-BuOH 为自由基捕获剂可以与·OH 生成惰性中间介质,终止·OH 链反应。实验结果见图3,加入t-BuOH 捕获·OH,甲基橙染料废水去除率下降,产生不完全抑制,即·OH 不是甲基橙染料废水去除的唯一因素。比较β-FeOOH/SiO2与β-FeOOH 对甲基橙染料废水降解效果发现,SiO2负载β-FeOOH 后对甲基橙染料废水去除率显著上升,可见SiO2加入改变β-FeOOH/SiO2的结构,造成空位、边缘缺陷,为β-FeOOH 提供附着位点,增加表面活性位,并保留了SiO2的过滤截留能力[30],提高β-FeOOH/SiO2比表面积及吸附能力,进而利用静电吸附作用去除水中的甲基橙染料废水[31],有利于对甲基橙染料废水的降解。

图3 t-BuOH 对β-FeOOH/SiO2 降解甲基橙染料废水的抑制
2.2.2 β-FeOOH/SiO2中铁离子催化作用机制 为进一步确认β-FeOOH/SiO2催化机制,构建Fe2++H2O2均相体系作为对照组,Fe2+初始浓度为35.000 0 mg/L,讨论β-FeOOH/SiO2中铁离子催化作用机制。Fe2++H2O2、β-FeOOH/SiO2+H2O2降解甲基橙染料废水过程中的溶出铁情况见表1。SELLERS[28]指出当溶液中的总铁离子浓度低于3.900 0 mg/L 时,溶出铁对H2O2的催化分解作用可忽略,以异相催化为主导。由表1 可知,β-FeOOH/SiO2+H2O2降解甲基橙染料废水过程中,溶出铁最高值为3.533 0 mg/L,说明体系中的溶出铁对H2O2的催化分解作用非常有限。
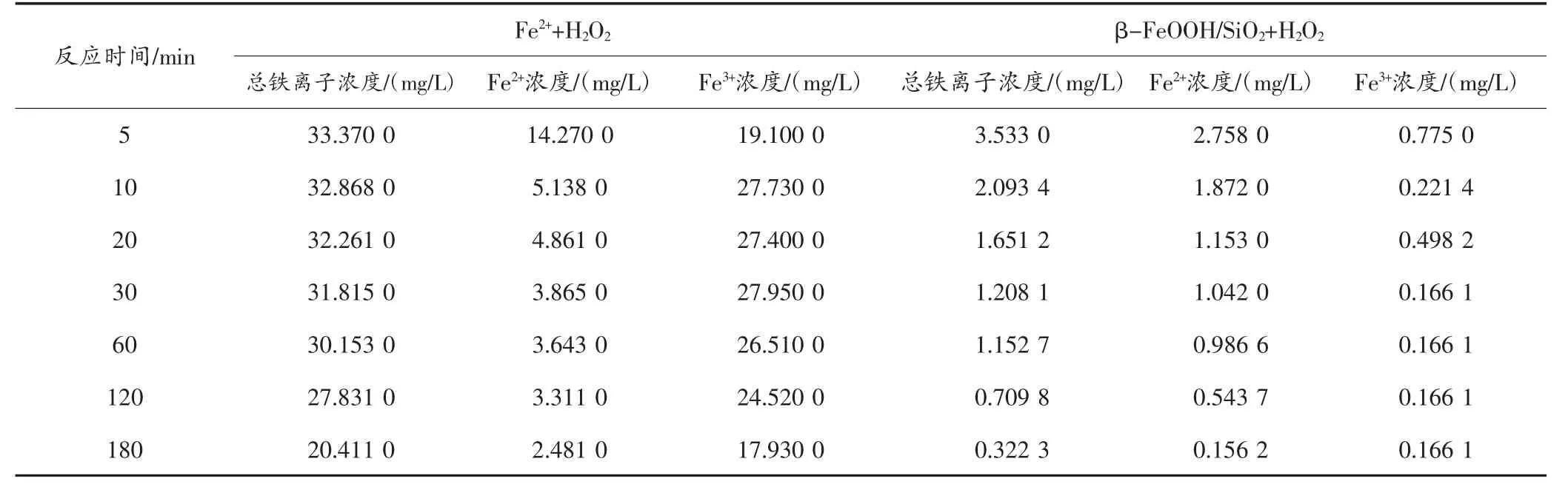
表1 Fe2++H2O2、β-FeOOH/SiO2+H2O2 中溶出铁情况
图4 对比了H2O2、Fe2++H2O2以及β-FeOOH/SiO2+H2O2对甲基橙染料废水的降解效果,发现铁离子对甲基橙染料废水的降解有促进作用,由于β-FeOOH/SiO2中溶出铁作用可忽略,所以起催化作用的主要物质为β-FeOOH/SiO2表面上键合态的铁,即β-FeOOH/SiO2+H2O2降解甲基橙染料废水的过程中遵循表面络合催化机理。
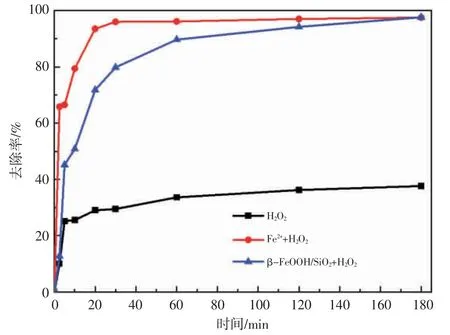
图4 不同体系对甲基橙染料废水的降解
2.2.3 ·OH 生成机制探究 为考察·OH 生成机制,设置Fe2++H2O2均相体系作为对照实验。
图5 对比了H2O2、Fe2++H2O2、β-FeOOH/SiO2+H2O2中H2O2分解率随时间变化的趋势,实验发现,20 min内β-FeOOH/SiO2促进H2O2分解可达100%,说明β-FeOOH/SiO2表面键合态的铁促进H2O2分解产生·OH。
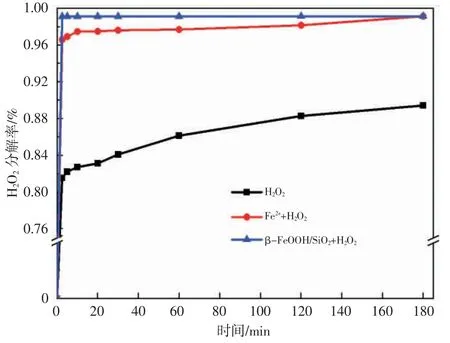
图5 H2O2 分解率随时间变化趋势
图6 对比了H2O2与β-FeOOH/SiO2+H2O2中甲基橙染料废水去除率随时间变化的趋势,实验发现,单独H2O2作用对甲基橙染料废水的去除率低于40.00%,加入β-FeOOH/SiO2后甲基橙染料废水去除率提高至90.00%以上。β-FeOOH/SiO2提供固-液接触面,通过选择性吸附使水中的H2O2以及甲基橙分子在固-液相界面发生富集,进而催化H2O2产生·OH 进攻甲基橙分子。

图6 甲基橙染料废水去除率随时间变化趋势
2.3 流化床处理甲基橙染料废水条件优化[32]
2.3.1 β-FeOOH/SiO2添加量对甲基橙染料废水去除率的影响 β-FeOOH/SiO2提供固-液接触面,选择性吸附使水中的H2O2以及甲基橙分子在固-液相界面发生富集,Fe2+催化H2O2产生·OH 进攻甲基橙分子。β-FeOOH/SiO2添加量不同对甲基橙染料废水去除效果有影响,见图7。当β-FeOOH/SiO2添加量为3.75 g/L,83 min 后甲基橙染料废水的去除率达100%,随着β-FeOOH/SiO2吸附饱和,甲基橙染料废水去除率开始下降。当β-FeOOH/SiO2添加量增大至5.00 g/L 时,41 min后甲基橙染料废水去除率均在99.00%以上,77 min 后甲基橙染料废水去除率达到100%直至β-FeOOH/SiO2失活。当β-FeOOH/SiO2添加量增大至7.5 g/L 时,41 min后甲基橙染料废水去除率为99.74%,逐渐下降至81.98%直至β-FeOOH/SiO2失活,由于β-FeOOH/SiO2添加量过大,H2O2快速分解产生的·OH 相对过剩,发生自身的淬灭。β-FeOOH/SiO2添加量增加,溶出铁增加,不利于水体色度指标的控制,壁面效应影响也增大。综合考虑甲基橙染料废水去除率、溶出铁的影响,选择β-FeOOH/SiO2添加量为5.00 g/L。
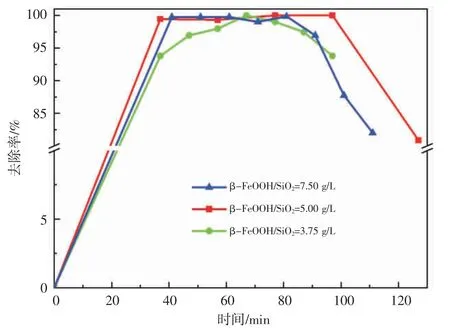
图7 β-FeOOH/SiO2 添加量对甲基橙染料废水去除率的影响
2.3.2 H2O2添加量对甲基橙染料废水去除率的影响H2O2作为Fenton 体系中的氧化剂可与铁离子进一步催化产生·OH,不同H2O2添加量,甲基橙染料废水去除率随时间变化情况见图8。
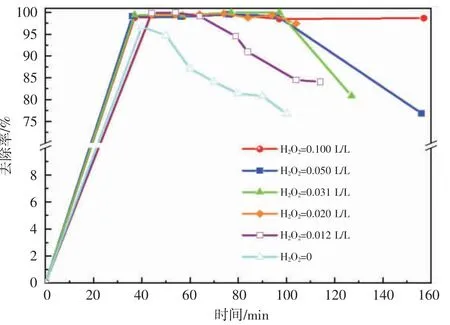
图8 H2O2 添加量对甲基橙染料废水去除率的影响
仅加入β-FeOOH/SiO2作用时,β-FeOOH/SiO2中带正电荷的FeOOH 吸附甲基橙分子中带负电的-SO3Na 酸性基团而起到脱色作用,空穴达到吸附饱和后失活。H2O2添加量为0.012 L/L 时,甲基橙染料废水去除率为99.80%,随反应进行,β-FeOOH/SiO2表面活性位减少,去除率逐渐下降。H2O2添加量为0.031 L/L,甲基橙染料废水去除率达到100%,直至β-FeOOH/SiO2失活。H2O2添加量继续增大到0.050、0.100 L/L时,甲基橙染料废水去除率均有减小趋势,有两种原因:(1)H2O2分解产生·OH 浓度高,发生积聚反应,即:·OH+·OH→H2O2;(2)过量的H2O2也是·OH 的捕获剂,即:·OH+H2O2→H2O+HO2·[33-34]。以上结果表明H2O2添加量为0.031 L/L 时,H2O2的利用率最佳。
2.4 非均相Fenton 流化床工艺的实用性探究
2.4.1 非均相Fenton 流化床适用性评价 图9 展示了在β-FeOOH/SiO2添加量为5.00 g/L,H2O2添加量为0.031 L/L 条件下,甲基橙染料废水处理前后对比图,由图9 可以看出,该流化床工艺可有效降低甲基橙染料废水的色度。采用台式分光光度计和总有机碳分析仪分别测得水体的COD 去除率为88.36%,TOC 去除率为67.5%。

图9 处理甲基橙染料废水前后对比图
在β-FeOOH/SiO2添加量为5.00 g/L,H2O2添加量为0.031 L/L 条件下,对甲基橙染料废水、罗丹明B、亚甲基蓝染料废水的降解效果见图10。在40 min 时,甲基橙染料废水去除率为96.86%,随着降解时间的增加,去除率增大至100%,直至β-FeOOH/SiO2失活。罗丹明B 和亚甲基蓝两种碱性染料废水在74 min、84 min后去除率分别下降至80.73%和72.07%,当有机物相对分子质量较大时,β-FeOOH/SiO2表面的活性位更快地被染料分子占据,不足以催化H2O2发生催化氧化反应,生成有效·OH 减少,在反应体系中还会有少量的铁离子溶出,导致β-FeOOH/SiO2的处理能力下降。
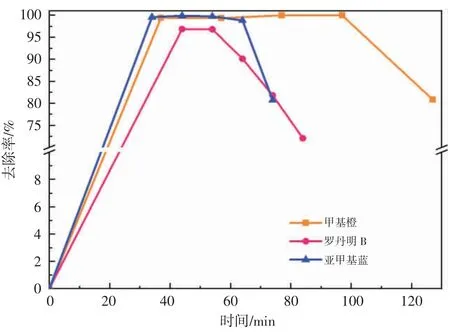
图10 非均相Fenton 流化床工艺对不同染料废水降解效果的对比
2.4.2 β-FeOOH/SiO2的循环利用性评价 使用过的β-FeOOH/SiO2进行回收,去离子水和无水乙醇交替冲洗,60 ℃烘干,重复实验,对反应前后的β-FeOOH/SiO2进行循环使用,β-FeOOH/SiO2在不同循环次数下对甲基橙染料废水的降解效果见图11。

图11 β-FeOOH/SiO2 的循环利用对甲基橙染料废水降解效果的影响
加入β-FeOOH/SiO2,100 min 内对流化床中甲基橙染料废水去除率接近100%。循环两次后,去除率在44 min 时降低至87.52%,对甲基橙染料废水去除率仍较高。循环三次后,去除率在40 min 时下降,可见β-FeOOH/SiO2固体颗粒中的活性组分逐渐流失。
2.4.3 β-FeOOH/SiO2的稳定性评价 对进行一次流化床实验后的β-FeOOH/SiO2进行XRD 分析,见图12。流化床实验后β-FeOOH/SiO2的成分无改变[35],表明β-FeOOH/SiO2的稳定性良好,实验过程中无相变及铁泥生成。

图12 a.流化前、b.流化后β-FeOOH/SiO2 的X 射线衍射图
对实验前后的β-FeOOH/SiO2进行FT-IR 分析(图13)。FT-IR 谱图中567 cm-1未出现Fe3O4的特征吸收峰[36],480 cm-1以及564 cm-1处未出现球形Fe2O3的特征吸收峰[37],440、525、650 cm-1处均未出现条形Fe2O3的特征吸收峰[38],696 cm-1处未出现FeO 的特征吸收峰[39],故无Fe3O4、球形或条形Fe2O3以及FeO 生成。在1 022 cm-1处无γ-FeOOH 的特征峰,891 cm-1处无α-FeOOH 的特征吸收峰[40],表明在流化床实验过程中没有发生相变,以上分析与XRD 表征结果相符合。经过流化床实验后β-FeOOH/SiO2的出峰位置有偏向β-FeOOH(690、862 cm-1)及SiO2峰位置(461、692 cm-1)的趋势,表明β-FeOOH/SiO2的稳定性经过流化床实验后受到了一定的影响,β-FeOOH/SiO2多次循环对甲基橙染料废水的降解效果有下降趋势。

图13 a.SiO2、b.β-FeOOH、c.β-FeOOH/SiO2、d.流化床实验后β-FeOOH/SiO2 的FT-IR 光谱
国家环境保护总局发布的GB 3838—2002《地表水环境质量标准》中铁的标准限值为0.3 mg/L,不同污染物出水中溶出铁含量见表2。在该工艺条件下,甲基橙和罗丹明B 的染料废水出水中溶出铁含量满足GB 3838—2002 要求,亚甲基蓝染料废水出水中溶出铁含量略大于标准限值。

表2 不同目标污染物出水水体中溶出铁含量
3 结论
(1)SiO2的加入改变了β-FeOOH 的结构,增加β-FeOOH 表面活性位,促进H2O2产生·OH,使得该体系中甲基橙染料废水发生降解;其中,·OH 的生成机制为β-FeOOH/SiO2表面上键合态的铁促进H2O2分解产生,遵循表面络合催化机理。
(2)选择β-FeOOH/SiO2平均粒径为0.064 5 mm,流化床床层高度为1.6 cm,添加量为5.00 g/L,H2O2添加量为0.031 L/L,对甲基橙染料废水的去除效果最佳,处理83 min,甲基橙染料废水去除率达100%,COD去除率为88.36%,TOC 去除率为67.5%。
(3)该工艺对甲基橙、亚甲基蓝和罗丹明B 三种染料废水均能得到较好的处理效果,β-FeOOH/SiO2的稳定性良好,无相变,未检测到铁泥的生成。
