髓源性生长因子对2型糖尿病小鼠胰岛素抵抗及肝脏炎性反应的影响
2024-03-25付之光方文灿贺明娟张永彬
苏 芳,付之光,方文灿,王 莹,贺明娟,张永彬
非酒精性脂肪肝病与炎症反应、胰岛素抵抗等密切相关[1,2],目前对于非酒精性脂肪肝病尚缺乏有效的治疗手段[3]。骨髓作为成人的造血器官对于维持人类生存健康发挥重要作用,近年发现骨髓组织也具有内分泌功能,例如骨髓单核巨噬细胞分泌的髓源性生长因子(myeloid-derived growth factor,MYDGF)具有改善糖脂代谢紊乱的作用[4,5]。因此,本研究进一步探索MYDGF对2型糖尿病小鼠胰岛素抵抗及肝脏炎性反应的影响及其信号机制。
1 材料与方法
1.1 主要材料、试剂与仪器 4周龄雄性SPF级C57小鼠30只(北京维通利华实验动物技术有限公司),高脂饲料(北京华阜康生物科技有限公司),普通维持饲料(苏州双狮实验动物饲料科技有限公司)。苏木素伊红(HE)染色试剂盒(索莱宝,北京);肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)与白细胞介素6(interleukin-6, IL-6)试剂盒(达科维生物,上海);超氧化物歧化酶(superoxide dismutase,SOD),谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)与过氧化氢酶(Catalase)试剂盒(建成生物,南京);磷酸化(p)-IKKβ(Ser176/180)一抗(稀释比例,1∶1000;#2697),IKKβ一抗(稀释比例,1∶1000;#2684),p-IkBα(Ser32)(稀释比例,1∶1000;#2859),IkBα一抗(稀释比例,1∶1000;#9242)与GAPDH 一抗(稀释比例,1∶3000;#5174)均购自美国Cell Signaling Technology公司。
7160 型全自动生化仪(日立,日本);340型酶联仪(BDSL,英国);r-911型全自动放免仪(中国科技大学实业总公司,中国);DYY-7C型电泳仪、DYCZ-40型转膜仪(六一仪器,北京);ZPJ-1A型展片机、KPJ-1A 型烤片机(天利航空机电,天津)。
1.2 方法
1.2.1 重组MYDGF蛋白腺相关病毒载体构建 以pHBAAV-CMV-MCS-3flag-T2A-ZsGreen质粒作为 MYDGF基因的载体(基因序列NM_080837.2),然后与pAAV-RC和pHelper共转染至AAV-293细胞。rAAV的大规模制备、纯化、鉴定、滴度测定等参照文献[5]。
1.2.2 糖尿病建模与标本取材 20只C57小鼠给予高脂饲料喂养4周,按照文献[6]方法进行糖尿病造模,其中10只接受AAV-GFP(1×1012VP)骨髓腔注射,为糖尿病组(DM);10只接受AAV-MYDGF(1×1012VP[6])骨髓腔注射,为MYDGF干预糖尿病组(MYDGF)。另取10只C57小鼠,普通维持饲料喂养,4周后骨髓腔注射等量生理盐水,定义为对照组。所有小鼠继续采用相应饲料喂养12周后,腹腔注射戊巴比妥钠溶液(60 mg/kg)麻醉取材。(1)血清标本:体式显微镜下使用BD针抽尽小鼠后腔静脉血液,注入一次性黄盖促凝采血管,取上层血清,-80 ℃冻存备用。(2)肝脏标本:肝组织分别装入4 ℃预冷的试管、-80 ℃冻存、4%多聚甲醛溶液常温固定。
1.2.3 血液学指标检测 -80 ℃冻存的血清,全自动生化仪检测血糖(fasting blood glucose, FBG)水平,放射免疫法检测胰岛素水平,胰岛素抵抗指数(homeostasis model assessment-insulin resistance,HOMA-IR)= FBG×胰岛素水平/22.5。酶联免疫吸附试验检测TNF-α和IL-6。
1.2.4 肝脏抗氧化酶检测 取新鲜肝脏组织低温磨碎,按试剂盒要求检测SOD,GSH-Px和Catalase的酶量。
1.2.5 HE染色 肝脏组织固定1 周,经过脱水、透明、浸蜡、包埋,制作成石蜡切片后进行HE染色。
1.2.6 IKKβ/IκBα信号途径的Western blot检测 取出冻存的肝脏组织(50 mg),加入500 μl RIPA裂解液(含PMSF),匀浆,充分裂解后离心(4 ℃,12000 g,15 min),取上清液,测定总蛋白浓度,Western blot常规方法[7-9],以GAPDH为内参,测定各组小鼠肝脏中的目的蛋白水平。所有实验步骤至少重复3次。
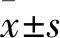
2 结 果
2.1 MYDGF对糖尿病小鼠胰岛素抵抗指数的影响 与对照组比较,DM组小鼠空腹血糖、胰岛素与胰岛素抵抗指数均显著升高,差异有统计学意义(P<0.05)。而MYDGF干预明显降低小鼠空腹血糖、胰岛素与胰岛素抵抗指数,与DM组相比差异有统计学意义(P<0.05,表1)。
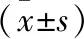
表1 MYDGF对糖尿病小鼠胰岛素抵抗指数的影响
2.2 MYDGF对糖尿病小鼠血清炎性因子浓度的影响 小鼠血清炎性因子浓度如表2所示:与对照组比较,DM组小鼠血清中TNF-α与IL-6浓度均显著升高,差异有统计学意义(P<0.05)。而MYDGF干预可以在某种程度上降低血清炎性因子的浓度,与DM组相比差异有统计学意义(P<0.05)。

表2 MYDGF对糖尿病小鼠血清炎性因子浓度的影响
2.3 MYDGF对糖尿病小鼠肝脏抗氧化酶含量的影响 小鼠肝脏抗氧化酶系如表3所示:与对照组比较,DM组小鼠肝脏SOD、GSH-Px与Catalase酶含量均显著降低,差异有统计学意义(P<0.05)。而MYDGF干预能不同程度地升高糖尿病小鼠肝脏抗氧化酶的含量,与DM组相比差异有统计学意义(P<0.05)。

表3 MYDGF对糖尿病小鼠肝脏抗氧化酶含量的影响
2.4 MYDGF对糖尿病小鼠肝脏病理解剖结构的影响 HE染色结果如图1所示:对照组小鼠肝脏细胞排列整齐、质核结构清晰,极少炎性细胞浸润;DM组肝脏大量炎性细胞浸润,肝细胞排列紊乱、脂肪变性;而MYDGF干预减轻肝细胞脂肪变性,减少肝脏炎性细胞浸润。
2.5 MYDGF对肝脏IKKβ/IκBα信号通路的影响 Western blot结果如图2所示,与对照组比较,DM组肝细胞IKKβ[ p-IKKβ: IKKβ, (1.39±0.11)vs.(1.00±0.09)]和IκBα[p-IκBα:IκBα, (1.44±0.06)vs.(1.00±0.08)]磷酸化水平明显升高,差异有统计学意义(P<0.05)。而MYDGF干预显著降低IKKβ[ p-IKKβ:IKKβ,(0.97±0.10)vs.(1.39±0.11)]和IκBα[p-IκBα:IκBα,(0.93±0.07)vs.(1.44±0.06)]的磷酸化水平。以上实验结果说明,IKKβ/IκBα信号通路至少部分介导了MYDGF缓解糖尿病小鼠肝脏炎性反应的作用。
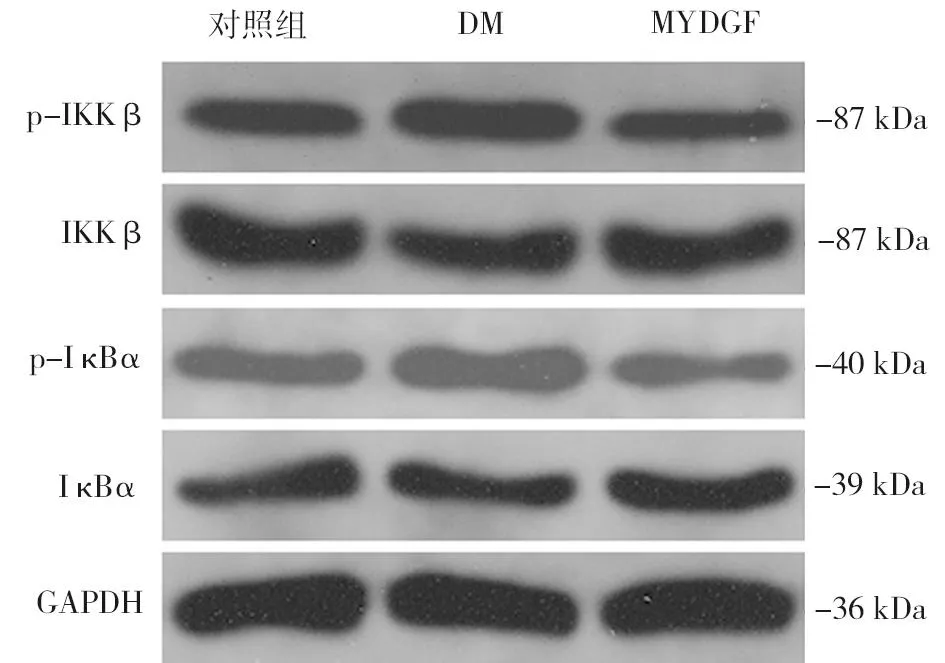
图2 MYDGF对糖尿病小鼠肝脏IKKβ/IκBα信号通路的影响
3 讨 论
炎症反应在非酒精性脂肪肝病的发生、发展过程中发挥着重要作用[10, 11],炎症反应促进肝脏脂质合成,加速非酒精性脂肪肝病的恶化[12],而抑制炎症反应可有效延缓非酒精性脂肪肝病的进展[13]。因此,抗炎治疗越来越受到重视。本研究发现,无论全身整体炎症标志物TNF-α与IL-6,还是肝脏局部炎性细胞浸润在糖尿病状态下都明显加重,而MYDGF干预缓解全身与局部的炎症反应。
对于炎症相关信号通路,本研究探究了经典的NF-κB信号途径。当炎症因子与细胞受体结合后可引起后者构型发生改变,进而磷酸化激活IκBα激酶IKK,可使IκBα磷酸化并进一步被蛋白酶体识别降解。于是NF-κB得以从胞质中的NF-κB/IκBα复合体中释放出来并活化[14]、暴露核定位域,迅速进行核转位,NF-κB入核后即启动炎症基因的转录表达。本研究探究了NF-κB信号的上游途径IKK/IκBα通路,结果发现高糖状态磷酸化激活IKK/IκBα信号通路,而MYDGF干预抑制IKK/IκBα信号通路,从而间接证明了MYDGF干预抑制糖尿病小鼠肝脏NF-κB炎症信号。肝脏NF-κB炎症信号途径介导合成NO,TNF-α和IL-6等炎症因子,级联放大的炎症信号可导致产生或者加重胰岛素抵抗[15]。本研究表明,MYDGF干预抑制糖尿病小鼠炎症反应并缓解胰岛素抵抗。最近有研究发现,蛋白激酶PKCθ与肝细胞IKKβ磷酸化密切相关[7],MYDGF对糖尿病小鼠肝脏PKCθ蛋白的调节作用值得深入研究。
与炎症反应一样,氧化应激是非酒精性脂肪肝病发生、发展的另一重要病理基础[16-18]。而炎症反应与氧化应激之间存在密切关系,炎症反应可导致肝脏抗氧化酶SOD、GSH-Px和Catalase酶含量降低,而氧化应激会进一步加重炎症反应[19]。本研究发现,MYDGF干预升高糖尿病小鼠肝脏抗氧化酶SOD、GSH-Px和Catalase酶含量,降低的肝脏氧化应激可能有助于间接缓解炎症反应。
MYDGF缓解肝脏炎症反应及胰岛素抵抗,此作用可能与抑制肝脏IKK/IκBα信号通路有关。骨髓作为造血器官亦能通过内分泌MYDGF调节肝脏糖脂代谢,MYDGF有望成为治疗非酒精性脂肪肝病、糖尿病等疾病的潜在靶点。
