龙胆苦苷对果糖诱导小鼠高尿酸血症的作用
2024-03-25尚平平乔博灵
李 静 尚平平 杨 洋 何 姣 乔博灵
(1 西北大学生命科学学院,陕西省生物医药重点实验室,西安,710016; 2 陕西师范大学生命科学学院药用植物资源与天然药物化学教育部重点实验室,西安,710119)
随着生活物质的极大丰富,人们的饮食结构发生了巨大的变化,高尿酸血症成为现代人的高发疾病之一[1]。高尿酸血症是患者体内嘌呤类物质代谢紊乱,尿酸生成过多或排泄减少,导致血清尿酸浓度升高的一种代谢性疾病。当血清尿酸浓度高于正常范围,处于超饱和状态时,尿酸可以尿酸盐的形式沉积在关节、软骨或脏器中,导致痛风,甚至发生尿酸性肾病。高尿酸血症与心血管疾病、高血压、肥胖、高血脂等也存在广泛的关联性[2-3]。因此,有效控制高尿酸血症具有重要临床意义。临床上常用别嘌呤醇、丙磺舒等药物,通过抑制尿酸生成或促进尿酸排泄,降低患者血清尿酸,进而减少相关疾病的发病。然而,这些药物对患者的胃肠道和肾脏均有一定的刺激性和不良反应[4]。非布索坦虽然降尿酸作用显著,但临床试验发现其有增加心源性死亡的风险[5],因此,研发新型高效抗高尿酸血症的一线治疗药物十分必要。龙胆苦苷是存在于龙胆GentianascabraBunge.、秦艽GentianamacrophyllaPall.等中药中的环烯醚萜苷类化合物,具有多种药理作用,比如对胃黏膜损伤有保护作用、对炎症性肠病、胆汁淤积型肝炎和肝功能失常有预防和治疗作用等[6]。秦艽提取物在腺嘌呤和乙胺丁醇诱导的高尿酸血症模型中,龙胆苦苷在氧嗪酸钾制备的高尿酸血症模型中均可通过调节尿酸转运蛋白发挥降尿酸的作用[7-8]。本研究以果糖诱导的高尿酸血症小鼠模型,进行龙胆苦苷降尿酸功效的评估,并考察其对肝脏尿酸生成关键酶-黄嘌呤氧化酶(Xanthine Oxidase,XOD)的作用。
1 材料与方法
1.1 材料
1.1.1 动物 健康清洁级昆明种小鼠60只,雄性,4周龄,体质量(20±3)g,西安交通大学实验动物中心,动物合格证号:SCXK(陕)2017-003。在研究过程中,所有动物均在12 h光照-黑暗周期、温度(22±2)℃和相对湿度(55±5)%的条件下饲养。动物饲养和实验操作均符合西北大学动物福利和伦理原则,审查批准编号:NWU-AWC-20181109M。小鼠适应性饲养1周,状态良好。
1.1.2 药物 龙胆苦苷为自行提取分离制备,经高效液相色谱测定,纯度≥98.0%。别嘌呤醇(重庆科瑞制药有限公司,国药准字H50020455)。果糖(德国MP公司,批号20180518)。
1.1.3 试剂与仪器 谷丙转氨酶(Glutamic Pyruvic Transaminase,GPT)和谷草转氨酶(Glutamic Oxaloacetic Transaminase,GOT)检测试剂盒(上海源叶生物科技有限公司,货号:R21819,R21814);尿酸(Uric Acid,UA)、肌酐(Creatinine,Cr)和尿素氮(Blood Urea Nitrogen,BUN)检测试剂盒(中生北控生物科技股份有限公司,批号:180161,180481,180321);超氧化物歧化酶(Superoxide Dismutase,SOD)和丙二醛(Malondialdehyde,MDA)试剂盒(武汉基因美生物科技有限公司,货号:JYM0390Mo,JYM0345Mo);肿瘤坏死因子(Tumor Necrosis Factor,TNF-α)和白细胞介素-6(Interleukin 6,IL-6)酶联免疫吸附试验(Elisa)试剂盒(武汉基因美生物科技有限公司,货号:JYM0218Mo,JYM0012Mo);XOD测定试剂盒(abcam公司,货号ab102522);XOD抗体(abcam公司,货号:ab133268);β-肌动蛋白(β-actin)(santa公司,货号:sc-1616r)。全自动生化分析仪(美国Beckman coulter公司,型号:AU5800);离心机(上海双旭电子有限公司,型号:TG16W);Western blot转膜仪(美国Bio-Rad公司,型号:1703930);电泳仪(北京六一仪器厂,型号:DYY-6C);一体式化学发光成像仪(上海勤翔科技有限公司,型号:ChemiScope 5300 Pro)。
1.2 方法
1.2.1 分组与模型制备 动物随机分为6组,正常对照组、模型组、别嘌呤醇组(5 mg/kg)、龙胆苦苷高、中、低剂量组(80 mg/kg、40 mg/kg、20 mg/kg),每组10只,正常对照组给予新鲜的饮用水,其余组给予10%果糖溶液(果糖溶于饮用水),每2天更换饮用水,持续8周诱发高尿酸血症模型。
1.2.2 给药方法 各给药组动物每天上午9:00至11:00之间测量体质量,按体质量灌胃给药,正常对照组和模型组灌服等体积生理盐水,持续果糖喂养。喂养期间每天观察小鼠的毛色,食量和死亡情况。
1.2.3 检测指标与方法
1.2.3.1 标本采集及处理 给药干预4周,小鼠禁食12 h,末次给药1 h后麻醉小鼠,眼球取血,静置,离心得血清待做生化分析,摘取新鲜肝、肾组织,冻存、固定、检测相关指标。
1.2.3.2 血清生化指标测定 取血清,于全自动生化分析仪检测血清GPT、GOT、UA、Cr和BUN水平。
1.2.3.3 肝、肾组织病理学观察 将肝、肾组织用4%的多聚甲醛固定24 h后,用石蜡包埋,切片(5 μm),置于干净的载玻片上,以二甲苯脱蜡,梯度乙醇处理,蒸馏水洗,用苏木精和伊红染色后置显微镜下进行观察。
1.2.3.4 肾脏氧化应激水平和炎症介质检测 准确称取一定质量肾组织,制成肾脏匀浆,严格按照Elisa试剂盒说明测定肾组织中SOD,MDA,TNF-α和IL-6水平。
1.2.3.5 肝脏XOD活性检测 取小鼠肝脏组织于玻璃匀浆器中,按重量(g)∶体积(ml)=1∶9的比例加入9倍体积的生理盐水,冰水浴条件下,制备成10%的组织匀浆,12 000 r/min,离心15 min,离心半径15 cm,取上清液,按照试剂盒说明书进行XOD活力测定。
1.2.3.6 XOD蛋白表达水平检测 取小鼠肾脏组织,加入裂解液后进行匀浆,按BCA蛋白定量试剂盒说明书测定浓度,蛋白样品经12%凝胶分离后,转至聚偏二氟乙烯(Polyvinylidenefluorie,PVDF)膜上。PVDF膜经5%脱脂奶粉室温封闭后,加入相应一抗,4 ℃孵育过夜,加入二抗孵育并显影检测。以β-Actin为内参,采用ImageJ图像分析系统分析蛋白相对表达量。
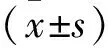
2 结果
2.1 龙胆苦苷对果糖诱导高尿酸血症小鼠体质量和肝、肾功能的影响 与正常对照组比较,模型组小鼠体质量,血清GPT、GOT、UA、Cr和BUN水平均显著升高(P<0.01)。与模型组比较,给药4周后,别嘌呤醇组和龙胆苦苷高、中剂量组小鼠体质量显著降低(P<0.05),别嘌呤醇组和龙胆苦苷高、中、低剂量组小鼠血清GPT、GOT、UA、Cr和BUN水平均明显降低(P<0.05或P<0.01)。见表1。

表1 龙胆苦苷对各组小鼠体质量,血清GPT、GOT、UA、Cr和BUN水平的影响
2.2 龙胆苦苷对果糖诱导高尿酸血症小鼠肝、肾组织病理形态的影响 正常对照组小鼠肝细胞大小均一,细胞核分布均匀,形态稳定。与正常对照组小鼠比较,模型组小鼠肝组织中发现较多肝细胞空泡,判断为脂肪空泡,同时有细胞核萎缩发生。与模型组比较,别嘌呤醇组和龙胆苦苷各剂量组以上病理特征改变得到明显缓解,肝细胞空泡样变性和细胞核萎缩的程度明显减轻,小鼠大部分肝细胞形态恢复正常。见图1。

图1 各组小鼠肝脏组织病理变化(HE,×200)
正常对照组小鼠肾小球大小、形态正常,边界清晰。肾小管内部刷状缘结构完整,无明显异常。与正常组比较,模型组小鼠肾组织结构紊乱,肾小球萎缩,肾小管管腔扩张。与模型组比较,别嘌呤醇组和龙胆苦苷各剂量组上述病理学改变明显减轻。见图2。
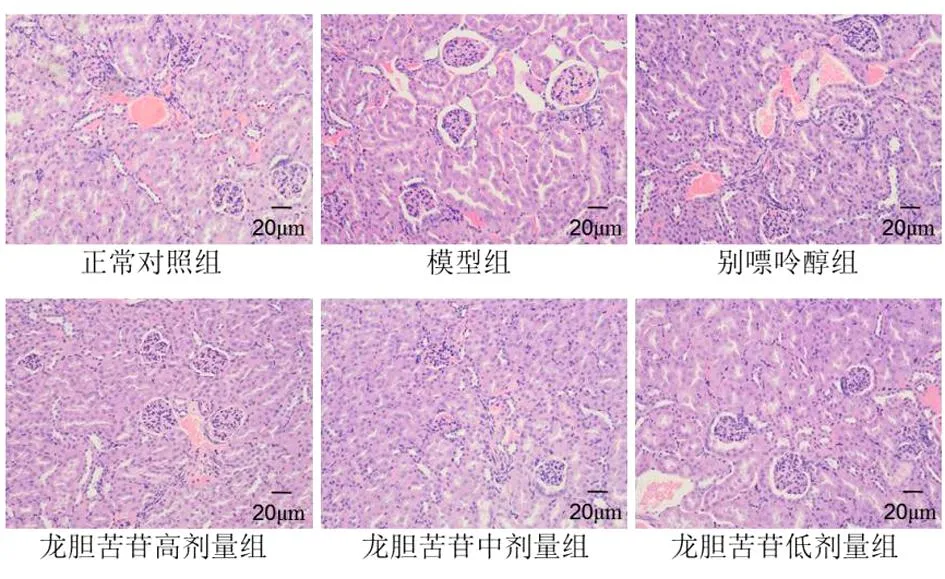
图2 各组小鼠肾脏组织病理变化(HE,×200)
2.3 龙胆苦苷对果糖诱导高尿酸血症小鼠肾脏SOD、MDA、TNF-α和IL-6水平的影响 与正常对照组比较,小鼠经12周果糖喂养,肾脏SOD水平显著降低,MDA,TNF-α和IL-6水平均显著升高(P<0.01)。与模型组比较,别嘌呤醇组和龙胆苦苷各剂量组SOD水平显著升高(P<0.05或P<0.01),龙胆苦苷各剂量组MDA水平显著降低(P<0.01),别嘌呤醇组和龙胆苦苷各剂量组TNF-α和IL-6水平均显著降低(P<0.01)。见表2。

表2 龙胆苦苷对各组小鼠肾脏SOD,MDA,TNF-α和IL-6水平的影响
2.4 龙胆苦苷对肝脏XOD活性的影响 与正常对照组比较,模型组小鼠肝脏XOD活性显著增加(P<0.01)。与模型组比较,给药4周后,别嘌呤醇组和龙胆苦苷高、中、低剂量组肝脏XOD活性显著降低(P<0.05或P<0.01)。见图3。

图3 龙胆苦苷对各组小鼠肝脏XOD活性的影响
2.5 龙胆苦苷对肝脏XOD蛋白表达水平的影响 与正常对照组比较,模型组小鼠肝脏XOD表达显著升高(P<0.01)。与模型组比较,别嘌呤醇组和龙胆苦苷高、中、低剂量组肝脏XOD的表达水平显著降低(P<0.01)。见图4。

图4 各组小鼠肝脏XOD蛋白表达水平
3 讨论
当今社会高尿酸血症和痛风发病率逐年上升且呈现年轻化趋势,其发病机制与不健康饮食密切相关[9-10]。含糖饮食,特别是高果糖玉米糖浆的生产及使用,使果糖摄入量大大增加,实验和流行病学研究表明,长期高果糖饮食有引发高尿酸,导致肾小球硬化、肾脏功能障碍,以及肝脏脂肪堆积的风险[11-12]。果糖喂养动物已成为被广泛应用的高尿酸血症建模方法[13-14]。本实验中,果糖连续喂养导致小鼠体质量显著增加,UA水平显著升高,血清肝功能损伤指标GPT和GOT及肾功能损伤指标Cr和BUN水平均显著升高,小鼠肝细胞脂肪蓄积,肾小球萎缩、肾小管管腔扩张,说明本研究中的高尿酸小鼠造模成功。龙胆苦苷连续给药4周后,血清中以上指标的水平均显著下降,肝、肾组织病理学改变明显减轻。结果表明,龙胆苦苷可以保护果糖导致的肝、肾受损。
众所周知,肝脏是果糖代谢的主要器官。高浓度果糖被实验动物吸收,到达动物肝脏后,代谢需要消耗大量的ATP,高果糖摄入可促进ATP向AMP的降解,因此也诱导嘌呤代谢相关酶的合成,包括XOD的大量合成,提升XOD活性,进而增强嘌呤降解和肌苷的产生,促使更多嘌呤代谢终产物尿酸的产生[15-16]。存在于肝脏的XOD是嘌呤代谢途径的限速酶,催化黄嘌呤生成尿酸,是调控尿酸生成的最终环节,在高尿酸血症的发病中占主导地位,抑制XOD的活性和表达可有效地减少尿酸的生成[17-18]。与已有的研究报道一致,小鼠经果糖喂养,肝脏XOD活性和表达水平明显上升[16],本研究发现,龙胆苦苷可显著抑制XOD的活性和表达,这些结果提示龙胆苦苷可通过抑制肝XOD的活性和表达减少尿酸的生成。
60%~75%的尿酸通过肾脏排泄,血尿酸升高,易使其停留于肾脏,诱导血管管壁发生氧化应激反应,SOD是机体对抗自由基的酶促体系,保护机体免受氧自由基的损伤,可直接反映机体抗氧化能力[19],而MDA是氧化应激的标志物,可以反映机体内脂质过氧化程度,MDA的增加会加剧机体的氧化损伤。另外尿酸的停留,还可刺激单核细胞生成IL-1β、IL-6以及TNF-α,诱导炎症反应,进一步加重肾功能损伤,表现出血清Cr和BUN的升高[20-21]。本研究中龙胆苦苷可有效升高高尿酸小鼠肾脏SOD水平,抑制了尿酸引起的肾脏MDA、TNF-α及IL-6水平的增加,并使异常的Cr和BUN恢复正常水平,且其对Cr和BUN的降低作用优于阳性对照物别嘌呤醇。据此推测,龙胆苦苷可通过早期干预,降低血尿酸水平,并降低肾脏氧化应激和炎症水平,保护肾功能。
综上所述,本研究证实了龙胆苦苷可有效降低血清GPT、GOT、UA、Cr和BUN水平,对肝肾具有保护作用,可减轻肾脏氧化应激和炎症反应,并表明其降尿酸作用与抑制肝脏XOD的活性和表达相关,作为潜在的天然降尿酸化合物应进一步研究。
利益冲突声明:无。
