mNGS在非HIV感染慢性肾脏病患者并发耶氏肺孢子菌肺炎中的诊断价值
2024-03-23任亚茹王维秀李玉叶王秋义于国玮胡鹏张磊刘美蓉杨定位
任亚茹,王维秀,李玉叶,王秋义,于国玮,胡鹏,张磊,刘美蓉,杨定位
(1.天津大学天津医院 a.肾内科;b.感染疾病科,天津 300000;2.天津市滨海新区中医医院 呼吸内科,天津 300000)
耶氏肺孢子菌肺炎(pneumocystis jirovecii pneumonia,PJP)是一种机会性的肺部真菌感染,通常见于免疫力低下人群,其中,相较于人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染者,终末期肾病患者、移植后患者、血液病患者及肿瘤患者等非HIV感染者的发病率正在升高,且据相关报道,此类患者PJP的病原体诊断敏感性较低,但临床症状严重,疾病发展更快,病死率更高[1]。
耶氏肺孢子菌是一种非典型真菌,无法在体外培养。目前,诊断PJP的金标准为呼吸道标本染色后显微镜下找特征性囊肿或滋养层细胞[2]。但由于标本真菌负荷量较低等原因,检测结果常表现为假阴性,而其他检测方法如PCR存在价格昂贵、需要特定引物等局限性,这使得PJP的早期诊断受到一定限制[3]。
随着分子生物学的发展,宏基因组二代测序技术(metagenomic next-generation sequencing,mNGS)作为一种高通量测序技术,在临床病原体诊断方面的价值已逐步被认可。mNGS可同时对多个单独的DNA/RNA分子进行并行测序,再借助较为准确、全面的数据库,对比检测出多种类型的微生物(包括细菌、真菌、病毒及寄生虫等)[4-11],检测时间也缩短至24~48 h[12-13]。据临床报道,在进行病原体检测时,mNGS的确有较高的阳性率,且对于传统微生物培养阴性的标本,mNGS仍可得出准确的阳性结果[9-10,14-15]。
本研究通过mNGS辅助诊断了9例并发PJP的非HIV感染的慢性肾脏病(chronic kidney diseases,CKD)患者,检测时间最终控制在24~36 h,且其中6例通过针对性抗感染治疗病情好转,这均证实了mNGS在PJP诊断中的重要作用。报告如下。
1 对象和方法
1.1 研究对象
本研究是一项回顾性研究,纳入2019年9月10日至2022年8月21日天津大学天津医院肾内科收治的疑诊发生了PJP的10例CKD患者。在收取标本前,这些患者均已使用过抗生素。
1.2 研究方法
1.2.1资料收集
采用回顾性分析的方法收集了患者的性别、年龄、基础疾病等一般资料及患者症状、体征、实验室检查、影像学检查、诊治过程、预后等临床数据。
1.2.2标本收集及检测
收取的标本包括痰液和肺泡灌洗液,所有标本均使用mNGS和传统微生物检测方法进行病原体检测。进行mNGS检测的标本量均不少于3 mL,由采集人员在严格遵守无菌观念的情况下根据标准程序采集到相应的无菌容器中。样本容器为无菌、干燥的冻存管,内含特殊脱氧核糖核酸保护剂。标本在-29 ℃条件下运输,留存时间均不得超过1周[16-17]。同时采集等量的标本进行传统微生物培养及涂片镜检,但放置容器为传统带盖无菌尿检杯,在常温条件下送至天津大学天津医院检验科细菌室[18-19],并由天津大学天津医院检验科细菌室专业人员对收取的标本进行传统微生物培养。
mNGS检测的以下流程均由华大基因和金域检验检测机构的专业人员进行:将行mNGS 的标本根据标本类型不同进行了相应的预处理后,使用TIANamp微型DNA试剂盒(天根生化有限公司)从样本中提取DNA,通过基因测序仪对DNA进行测序,最终所测得的序列数据是去除了低质量序列、污染核酸序列、重复读取序列等的高质量序列,再过滤掉人类基因组序列后得到病原体相关DNA序列,将其与病原体DNA数据库中的参考序列进行比对,得出最终的疑似病原体名单[9,13,20-21]。此外,所提取的DNA在进行酶切、末端修复、适配器连接等步骤后可用于建立基于北京基因组学研究所测序仪-100的DNA文库。
1.2.3诊断标准
在进行回顾性分析时,患者需同时满足CKD及PJP的诊断标准,其中CKD诊断主要是根据2012年改善全球肾脏病预后组织指南中CKD的诊断标准[22]。符合下列任意情况之一,持续时间≥3个月。(1)肾脏损害标志:①白蛋白尿(24 h尿微量白蛋白定量>30 mg,尿白蛋白肌酐比值>30 mg·g-1或>3 g·mol-1);②尿沉渣异常;③小管功能障碍导致的电解质或其他异常;④组织学检测到的异常;⑤影像学检查异常;⑥有肾移植史。(2)肾小球滤过率降低(<60 mL·min-1·1.73 m-2)。而PJP诊断则是基于临床医生对患者的检验检查结果、影像学表现、临床表现及最终治疗效果等的综合评判。
2 结果
2.1 一般资料
本研究纳入的患者均为疑似发生了PJP的CKD患者,共10例,其中男6名,女4名,年龄(48.80±13.27)岁;所有患者均有肾脏基础疾病,且均有不同程度的免疫抑制,其中9例有激素及免疫抑制剂使用史,使用时间2~24个月不等。收取的样本为痰液和肺泡灌洗液,其中痰液7例,肺泡灌洗液3例,见表1。

表1 患者一般资料
2.2 实验室检查结果
所有患者的实验室检查结果见表2,其中炎症指标表现异常的包括白细胞计数升高(70%)、中性粒细胞比值升高(100%)、C反应蛋白升高(100%);所有患者均有不同程度的免疫抑制,相关实验室指标表现为淋巴细胞计数及白蛋白计数的降低;肾功能异常的患者为100%;其余异常表现为G试验阳性(70%)、氧合指数≤300(70%)及乳酸脱氢酶升高(100%)。患者的实验室检查结果均不具有特异性。病原学检测方面,传统微生物检测的异常结果包括涂片结果阳性(50%)、培养结果阳性(40%),阳性率均低于mNGS(100%),见表3。

表2 患者实验室化验结果统计

表3 患者病原学检测结果统计
2.3 诊治过程及预后
在进行mNGS检测前,所有患者均拟诊PJP。根据患者症状、体征及相关化验检查,最终有9例患者确诊为PJP,这9例患者均通过mNGS检测到耶氏肺孢子菌,而传统微生物培养结果均未发现耶氏肺孢子菌,涂片也均未发现耶氏肺孢子菌特征性囊肿及滋养层细胞等征象。9例PJP患者中有7例在mNGS检测前即经验性使用了复方磺胺甲噁唑片(sulfamethoxazole-trimethoprim,SMZ-TMP)和(或)卡泊芬净,最终有4例患者取得临床症状及影像学检查征象的好转,其余3例治疗无效死亡,这3例患者均在肺感染早期即发生了呼吸衰竭,见表4。
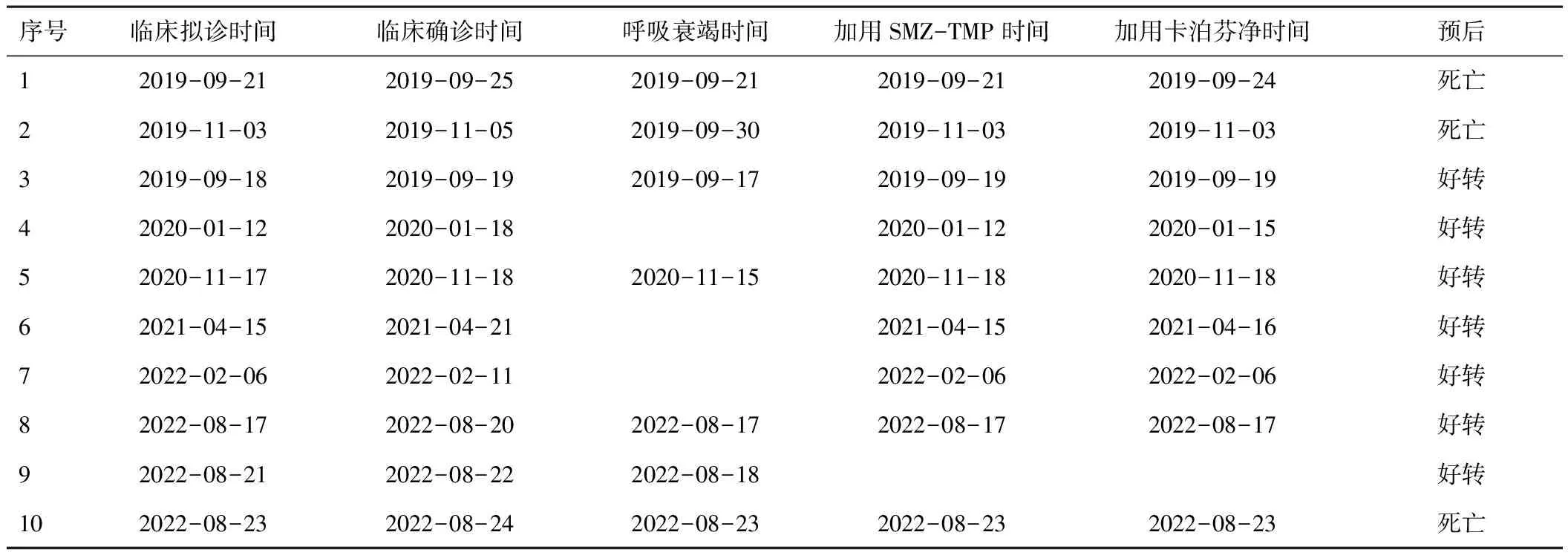
表4 患者的诊治过程
3 讨论
PJP是一种机会性的真菌感染,易感人群为具有任何可改变机体免疫力的潜在疾病或相关危险因素的患者,包括高龄、癌症、HIV、移植术后状态及有激素或(和)免疫抑制剂服用史等的患者。由于广泛使用预防及抗逆转录病毒疗法,HIV人群相关的PJP发病率已大幅下降[23];与此同时,非HIV患者的PJP发病率却在逐年升高[24-25]。而在非HIV 的患者中,发生PJP最重要的危险因素就是联合使用糖皮质激素及免疫抑制剂[23,26]。本研究10例病例中,最终9例确诊了PJP,而这些患者均有激素及免疫抑制剂使用史,是发生PJP的高危人群,这与上述的观点[23,26]也是一致的。同时,值得注意的是,本研究中的PJP患者均有慢性肾功能不全的基础病史,根据相关报道,慢性肾功能不全患者有独特的病理生理机制,本就为感染易发人群[27-29]。综合以上因素,本研究中的病例感染发生率较高,需对这一人群的相关感染性疾病给予关注。
而在临床表现方面,PJP的临床征象一方面是由于耶氏肺孢子菌可以直接附着于Ⅰ型肺泡上皮细胞,迅速地从小营养形式成长为较大的囊性形式,进而导致弥漫性的肺损伤;另一方面是由于机体对外来病原体的防御机制使其自身处于炎症状态,级联的炎症反应最终导致严重的肺损伤,肺功能严重受限,最终造成机体的缺氧甚至呼吸衰竭[23,30]。
基于上述的流行病学及病理生理机制,CKD并发PJP的临床进展是十分迅速的,许多相关的临床报道也证实了这一观点[2,31-32]。本研究中,病例1患者24 h内既从咳嗽、咳痰迅速进展为呼吸衰竭状态,胸部CT所体现的炎症征象也明显进展,后续加用卡泊芬净及SMZ-TMP后,仍抢救无效死亡;而病例4、6、7在肺感染早期未发展为呼吸衰竭状态即开始使用卡泊芬净及SMZ-TMP治疗,患者最终取得了良好的临床结局;同时,病例5、8在呼吸衰竭早期(3 d内)开始使用卡泊芬净及SMZ-TMP治疗,最终病情也实现了好转。所以,实现PJP的及时诊断以进行针对性的治疗十分重要。
在PJP诊断方面,依靠传统微生物检测方法进行早期诊断尚存在一定限制,耶氏肺孢子菌无法在体外培养基中培养,无法通过传统的微生物培养技术获得直观的病原体证据[23],而只能通过对标本的组织学检查实现PJP的病原学确诊。但真菌在涂片中的载量较低,即便对标本进行涂片染色后,通常也无法在显微镜下发现耶氏肺孢子菌特征性的囊肿或滋养层细胞[30]。在本报告的所有病例中,也均未通过传统的微生物检测方法取得耶氏肺孢子菌的阳性结果。在分子生物学水平,近年来PCR在耶氏肺孢子菌的检测中也得到部分肯定;但是,PCR检测需要特定的引物,耶氏肺孢子菌有许多种基因型,不同的基因型对应不同的引物,这使得检测的工作量及难度明显增大[33-34]。此外,PJP的实验室检查也仅有炎症指标升高、淋巴细胞计数降低及乳酸脱氢酶升高等非特异性结果,并不会对PJP的诊断起到决定性作用。此时,mNGS的出现有望克服以上的局限性,实现PJP的早期诊断。在一项临床研究中,Zhang等[35]应用mNGS对14名肾移植后患PJP的患者进行病原体检测,成功在13名患者中检测出耶氏肺孢子菌,阳性率高达92.9%,而与此同时,传统微生物培养对耶氏肺孢子菌的检出率为0,PCR的检出率为78.6%(11/14),这一结果肯定了mNGS在PJP诊断中的重要价值。此外,mNGS检测结果中病原体的序列数可能与患者的病情严重程度及预后相关,此次报告中2例死亡患者的耶氏肺孢子菌序列数均>10 000,这一数值远大于预后较好的患者。因此,mNGS不仅可以实现PJP的早期诊断,还在一定程度上预测到病情的后续发展与结局。
此外,由于本研究患者均有CKD基础,抗生素使用需求较为迫切,且依据医学伦理、遵照患者及家属意愿,有7例在收取标本进行mNGS检测之前即使用过针对耶氏肺孢子菌敏感的抗生素,但最终仍取得了mNGS的阳性结果。且根据Miao等[4]的研究,在已使用抗生素后才进行病原体检测的患者中,mNGS的阳性率高于传统微生物培养。这表明临床中可以在使用mNGS进行病原体感染检测的同时甚至之前即进行经验性治疗,而这并不会影响最终的病原体检测结果,依旧可以取得有力的病原学证据,而传统微生物检测方法较难实现以上目标。mNGS的这一项优势对于及时诊断并治疗临床进展快速、病情凶险的PJP具有重大意义。
尽管mNGS在CKD并发PJP中有如此大的利用价值,但仍然有其局限性。最突出的在于,作为一种基于分子层面的检测手段,mNGS不仅可以检测病原体的核酸,还包括宿主、微生物群以及环境中引入的污染核酸在内的所有核酸,虽然最终读取结果是去除了低质量序列、污染核酸序列、重复读取序列等的高质量序列,再过滤掉人类基因组序列后得到的病原体相关DNA序列,但仍然无法明确何为致病菌,何为定植菌。这导致了有很大数量的疑似背景微生物需要通过临床医生的解读与鉴别,以确定其致病性,这就使得最终结果具有不可避免的主观性[17,36]。因此,在临床工作中,应该通过关注mNGS检测到的微生物序列数、患者临床症状及体征、治疗效果及预后等情况进行综合判定,以减少诊断误差。
4 小结
PJP在非HIV患者中的发病率较高且仍在不断增长,在不到2 a的时间里,团队就借助mNGS诊断出9例CKD患者并发的PJP,且其中6例经过针对性抗感染治疗取得临床治愈。团队对mNGS在辅助诊断CKD并发PJP中的价值是给予肯定的,希望这一发现在未来通过不断地诊断试验进行有效验证。
