阿仑膦酸钠脂质体的制备及透皮给药性能评价
2024-03-22张广儒孙倩倩吕美王利涛
张广儒,孙倩倩,吕美,王利涛
(1.山东第二医科大学药学院,山东 潍坊 261053;2.济宁医学院药学院,山东 日照 276826)
阿仑膦酸钠(ALN)是一种双膦酸盐类药物常用于治疗老年和绝经后骨质疏松症,其机制基于抗骨吸收活性,减少破骨细胞数量,是一种有效的骨吸收抑制剂[1],在临床应用方面对髋骨骨折的治疗尤为显著,同时还具有抗高血脂和保肝作用[2]。当前抗骨质疏松药物主要通过口服和注射两种给药方式[3],但ALN口服利用度低,注射给药依从性差。因此,对于创造药物新剂型去增强药物利用效率的需求一直在增加[4],透皮给药是一种无创给药的新途径,能够减轻药物在体内引起的不良反应和副作用,提高药物的利用度[5],因此可采用透皮给药的方式来实现药物的高效利用。
透皮给药具有控释、延长治疗周期等诸多优点,是一种极具发展潜力的药物递送方法[6]。但如何克服皮肤角质层的屏障,进一步加强对皮肤的渗透是透皮给药面临的主要挑战,当前主要的促渗方法分为3类:第1类使用化学促渗剂类,如二醇、链烷醇、萜烯类等[7];第2类物理促渗技术类,如电穿孔、微针、离子电渗疗法[8];但化学促渗剂法对皮肤有一定的刺激性,物理促渗技术价格昂贵,患者的依从性差,第3类也是应用最为广泛的纳米载体类[9],如脂质体、微乳等通过溶解皮脂和角质层的水合作用来改变皮肤屏障,该法对皮肤表面刺激性小,且价格低廉。在纳米载体类促渗方法中最常使用的载体是脂质体,脂质体(liposomes)是应用最广泛的药物输送系统,也是最早的透皮载体[10],长期以来一直被用作亲水和水性药物的首选递送系统[11]。其主要作用机制可与皮肤角质层的磷脂相互作用,增加药物渗透效率[12],在真皮和透皮药物递送方面具有潜在价值[13]。因此,本试验利用透皮给药中脂质体剂型的特点,去实现ALN在皮肤中高效渗透,并成功制备了一种含ALN的脂质体,考察了其透皮性能,证明了该脂质体可以达到高效、延长药物作用时间的效果,这一研究为研发新的体外透皮制剂奠定了基础。
1 材料与方法
1.1 材料
1.1.1 仪器AR124CN型电子分析天平[奥豪斯仪器(常州)有限公司];XMTB型数显恒温水浴锅(北京市长风仪器仪表公司);DF-101S型集热式恒温加热磁力搅拌器(上海力辰邦西仪器科技有限公司);KQ-500型超声波清洗器(昆山市超声仪器有限公司);ZNCL-BS型智能磁力搅拌器(巩义市予华仪器有限责任公司);DHG-9140A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司);UV-2450型紫外分光光度仪(日本岛津公司);TG16-WS型高速离心机(长沙湘智离心机仪器有限公司);EMS-8B型智能磁力搅拌器(天津市欧诺仪器仪表有限公司);PHSJ-4A型pH计(上海仪电科学仪器股份有限公司);RE-52AA型旋转蒸发仪(上海亚荣生化仪器厂);移液枪(德国艾本德公司);ZS90型纳米粒径电位分析仪(英国马尔文公司)。
1.1.2 药品与试剂无水乙醇(天津市汇杭化工科技有限公司,批号:20230220);阿仑膦酸钠(上海源叶生物科技有限公司);碳酸氢钠(天津市瑞金特化学品有限公司);氯化钠(国药集团化学试剂有限公司,批号:20230105);磷脂酰胆碱(上海毕得医药科技股份有限公司);胆固醇(上海行知化工厂);苯骈戊三酮(国药集团化学试剂有限公司,批号:20210208);氯化钾(天津市北联精细化学品开发有限公司,批号:20181120);无水磷酸氢二钠(国药集团化学试剂有限公司,批号:20221220);磷酸二氢钾 (天津市鼎盛鑫化工有限公司,批号:20180307);盐酸(莱阳经济开发区精细化工厂,批号:20140607);氢氧化钠(烟台远东精细化工有限公司,批号:20181018)。
1.2 方法
1.2.1 阿仑膦酸钠的检测称取恒重的ALN 20 mg放入烧杯中并加入适量的纯化水,在50 ℃水浴锅中搅拌使其充分溶解,引流至100 mL的标准容量瓶中,并稀释至刻度,配制成200 μg·mL-1标准溶液。吸取200 μg·mL-1ALN溶液分别稀释成75、67、58、42、35、25、17 μg·mL-1至10 mL试管中,再加入0.75 mL的0.25 mol·L-1碳酸氢钠溶液和0.5 mL的1%水合茚三酮溶液,摇匀后,至92 ℃的集热式恒温加热磁力搅拌器内油浴加热30 min,在加热过程中打开试管盖子,加热完毕后取出自然冷却至室温,再滴加纯化水稀释至刻度。用蒸馏水同法制备的空白溶液为空白,在568 nm波长处测定吸光度(A),最后根据所得数据绘制吸光度-浓度曲线。
1.2.2 空白脂质体的制备空白脂质体的单因素试验:选择两个对空白脂质体粒径影响较大的因素进行单因素试验,即膜材比(磷脂酰胆碱∶胆固醇)、磁力搅拌转速。
精密称取定量的磷脂酰胆碱0.125 g、胆固醇0.05 g 混合放置于烧杯中,然后将混合物溶解在20 mL三氯甲烷中。将烧杯置于恒温磁力搅拌器上,(600 r·min-11.5 h)常温下搅拌至完全溶解,将溶液转移至圆底烧瓶中,减压蒸发40 ℃ 除去三氯甲烷,烧瓶内壁出现一层透明薄膜,烧瓶中加入PBS(pH=7,0.03 mol·L-1)50 mL使膜充分水化,水化温度45 ℃。水化至溶液呈现均匀状态即可。水化后烧瓶置于超声波清洗器内超声 6 min,生成乳白色半透明溶液。抽取5 mL的半透明溶液,所得半透明溶液分别过0.45 μm和0.22 μm的微孔滤过膜3次,即得空白脂质体。取5 mL纯水稀释2倍,平行3次测定其粒径及PDI分布,取平均值。
1.2.3 膜材比的确定固定胆固醇(0.05 g)的用量,依次改变磷脂酰胆碱的用量(0.1、0.125、0.15、0.175、0.2 g),(膜材比分别为2∶1,2.5∶1,3∶1,3.5∶1,4∶1)在其他条件均不变的情况下,同上述空白脂质体制备的步骤进行试验,在平均粒径允许的范围内,分别平行测定3次所得脂质体的粒径分布和PDI,取平均值,并判断最佳膜材比。根据PDI值的大小,PDI值越小,分布越均匀,选择PDI值最小的,确定最佳的膜材比。
标准的考核指标是对该类产品质量把控最为关键的地方。标准设置的指标越严格,产品质量越有保障。但是过高的指标对于产品生产来说会产生很多困难,甚至无法批量稳定生产达到指标的合格产品。根据实际生产水平,综合考虑安全性,标准设置了适宜的指标用来对产品进行考核和监督。关于FZ/T 73044-2012《针织配饰品》和FZ/T 82006-2018《机织配饰品》这两个标准的考核指标分别从外观质量和内在质量进行对比和分析。
1.2.4 磁力搅拌转速的选择选取膜材比的确定步骤中,筛选出的最佳膜材比(膜材比为2.5∶1)的磷脂酰胆碱和胆固醇放置于烧杯中,在其他条件均不变的情况下,同上述空白脂质体制备的步骤进行实验,依次改变磁力搅拌器的转速(500、600、700、800 r·min-1),进行其余4组试验,分别测定所得脂质体的粒径和PDI分布,以确定最佳的转速。
1.2.5 阿仑膦酸钠脂质体的制备取上述步骤筛选出的最佳膜材比和磁力搅拌转速的条件进行载药脂质体的制备。载药脂质体的单因素试验,通过测其包封率来判断最佳条件。选择对包封率影响较大的3个因素分别进行试验,即脂药比、超声时间、水化温度。
精密称取0.125 g磷脂酰胆碱、0.05 g胆固醇、0.0125 g ALN(C=125 μg·mL-1)混合放置于烧杯中,然后将混合物溶解在20 mL三氯甲烷中。将烧杯置于恒温磁力搅拌器上,(700 r·min-11.5 h)常温下搅拌至完全溶解,后续与空白脂质体制备一致。
1.2.6 脂药比保证超声时间、水化温度、转速、膜材比不变的情况下。分别制备脂药比为5∶1、10∶1、15∶1、20∶1的脂质体溶液,测定其包封率及载药效率。精密称取0.125 g磷脂酰胆碱、0.05 g胆固醇、ALN(0.025、0.012 5、0.008 3、0.006 25 g)运用紫外分光光度法测定不同条件下的包封率,从而通过比较得出最佳脂药比。
包封率及载药效率的测定 包封率是评价药物包载能力的重要指标,该试验采用离心法测定其包封率[14],分别取一组1 mL的脂质体将其置于离心管中,8 000 r·min-1离心30 min,取上清液,为游离药物浓度C1,另取一组1 mL的脂质体加入2 mL异丙醇破乳,为总的药物浓度C。包封率计算公式如下:
包封率(EE)=C-C1/C×100%
1.2.7 超声时间取上述最佳药脂比进行试验,在其他条件不变的情况下,改变每组的超声时间(3、6、9 min)。同样运用紫外分光光度法测定不同条件下的包封率,通过比较从而得出最佳超声时间。
1.2.8 水化温度取上述最佳药脂比、超声时间进行试验,在其他条件不变的情况下,改变每组的成膜温度(35、45、55 ℃)。同样运用紫外分光光度法测定不同条件下的包封率,通过比较从而得出最佳温度。
1.3 体外透皮试验
1.3.1 原料药液的猪皮体外经皮渗透试验猪皮的处理∶用解剖刀去毛,用刀和剪去掉皮下脂肪,用生理盐水洗净。取皮肤完整性良好的猪皮,切割成扩散室与接收室之间的圆形大小或六边形。将处理干净剩余的猪皮用保鲜膜包好,储存于-20 ℃的冰箱中,备用。使用时从冰箱中取出,置生理盐水中30 min自然解冻。
将预处理好的猪皮擦干,将其放于扩散室与接收室之间用夹子固定。将角质层面向供应池。取阿仑膦酸钠原料药液2 mL(C=125 μg·mL-1),至扩散室,在接收室加满纯水,记录接受室的体积。将双室立式透皮扩散池置于智能磁力搅拌器中。水浴温度控制在(32±1)℃,并以转速为400 r·min-1匀速搅拌,在0.5、1、2、3、4、6、8、10、12、24 h吸取接受液5 mL,注意每吸取一个样,应立即补足相同体积的纯水[16]。将所取样品液各加入0.75 mL的 0.25 mol·L-1碳酸氢钠溶液和0.5 mL 的1 %水合茚三酮乙醇溶液于10 mL试管中,摇晃均匀,置92 ℃的集热式恒温加热磁力搅拌器内油浴加热30 min,取出试管使其自然冷却到室温,最后使用纯水将其稀释至刻度。同时取用纯水,同上操作,作为空白溶液,在568 nm波长处测定所配溶液的吸光度(A)。同时取出在扩散室与接收室之间的猪皮,观察其表面形态,载药脂质体透皮过的猪皮表面(见图1),光滑有润泽,说明具有一定的润湿性,对皮肤表面的刺激较小。

图1 经ALN脂质体透过的猪皮(从左到右依次为平行试验的1~3组)
累计渗透量的计算:按标准曲线方程计算各时间点的药物浓度,按下式计算累积渗透量:
Q=(Cn×V+Ci×V0)/S (Q:μg·cm-2)
式中,Cn为第n点测得的药物浓度(μg·mL-1),Ci为第i个点测得的药物浓度(μg·mL-1),V接受室的总容积(mL),V0是每次取样体积(mL),S是渗透体积(cm2)。计算累积渗透量,重复3次,记录试验结果。
1.3.2 载药脂质体的体外透皮试验选择单因素试验中筛选出的最佳条件制备的载药脂质体,依据上述实验方法把原料药液换成载药脂质体,其他方法同上重复3次透皮试验,记录试验结果。
1.3.3 体外释放模型的拟合Origin 2018 64Bit软件产于美国Origin Lab公司,该软件可对药物释放度进行曲线拟合,来掌握药物释放的规律。为了考察脂质体的释药模型和缓释性能,将累积渗透量分别进行零级释放动力学,一级释放动力学,Higuchi释放模型,Rigter-Peppas释放模型的拟合。看其R2值的大小,R2值最接近1即最符合哪个模型。
2 结果
2.1 阿仑膦酸钠检测文献调查显示,ALN本身没有发色团[17],但在碱性条件下可与茚三酮反应生成紫色络合物(见图2)。可用于测定ALN含量的方法很少,紫外分光光度技术具有操作简单和灵敏度较高的显著优势[18]。通过配置不同浓度的阿仑膦酸钠标准溶液,选取稀释后的7个浓度(75、67、58、42、35、25、17 μg·mL-1)测定其吸光度,并进行线性拟合,最终得到拟合方程为Y=-0.314 18+0.021 57X,R2=0.999 0,表明溶液在17~75 μg之间呈现良好的线性关系。

图2 阿仑膦酸钠与水合茚三酮的反应方程式
2.2 空白脂质体
2.2.1 膜材比和转速制备出空白脂质体的照片,溶液呈乳白色,无杂质沉淀,均一稳定(见图3A)。不同膜材比的平均粒径和PDI值,PDI指多分散系数,代表均匀分散的程度。研究表明,如果分散系数越小,说明粒子分布越均匀,粒子大小分布越集中,可以看出在磷脂和胆固醇比例分别为2∶1、2.5∶1、3∶1、3.5∶1、4∶1时,其他条件不变的情况下,脂质体的平均粒径(见图3B)分别是231.7、255.8、238.1、228.1、222.3 nm。研究表明脂质体的粒径应在100~1 000 nm之间,当平均粒径均在允许的范围内,通过进一步比较不同条件下PDI的大小,发现磷脂酰胆碱与胆固醇的比例为2.5∶1时PDI最小,因此,本研究制备脂质体时选择的膜材比为2.5∶1。在不同搅拌转速下的粒径及PDI分布(见图3C)中,当搅拌转速分别为400、500、600、700、800 r·min-1时,在膜材比和超声时间、水化温度等不变的情况下,其平均粒径分别是222.8、215.4、292.9、252.0、256.2 nm。可知在平均粒径允许的范围内,再比较不同条件下的PDI的大小,转速为700 r·min-1时PDI最小,因此,制备脂质体应选择的搅拌转速为700 r·min-1。

图3 空白脂质体(A)、不同膜材比下的粒径和PDI(B)、不同转速下的粒径和PDI(C)
2.3 载药脂质体
2.3.1 脂药比分别在5∶1、10∶1、15∶1、20∶1的条件下,保持搅拌转速、超声时间、水化温度不变,经纳米粒径电位分析仪测3次得到其包封的平均粒径(见表1)。随着脂药比的增大,包封率呈现先增大后降低的趋势,这表明当ALN用量较低时,并不能被有效地包裹在脂质体内,部分ALN在脂质体空隙间游离。随着投药量的增加,脂质体的包封率也增加,但ALN的大量增加,使得脂质体囊泡难以包埋所有的ALN,导致过量药物游离,包封率下降。因此会出现包封率先上升在下降的趋势。脂药比在10∶1的时候包封率最高,故选择脂药比为10∶1为最佳脂药比。
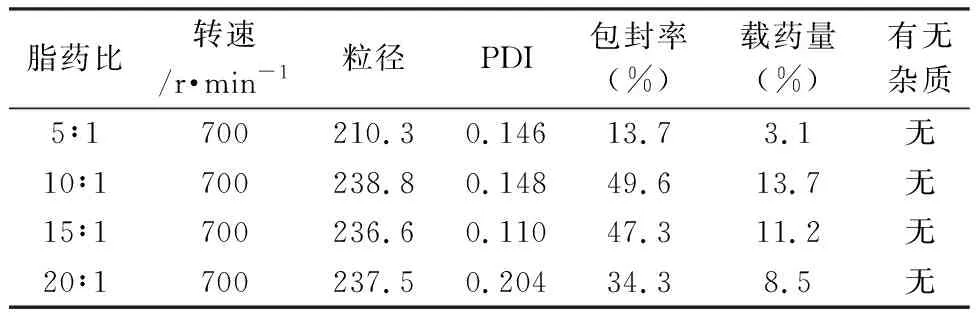
表1 不同脂药比的包封率
2.3.2 超声时间随着超声时间的延长,脂质体的粒径越来越小,脂质体的粒径减小,包封率也随之下降,这是由于适当的超声时间可使得体系中较大脂质体囊泡分裂成较小的、均一的囊泡,从而起到乳化稳定的作用。当超声时间过长时,脂质体系统的温度会升高,脂质体的囊泡结构会有一定程度的损坏。可知超声3 min与超声6 min包封率相差很小,超声时间在小于6 min之内对包封率的影响较小,但3 min超声时间过短,溶液的PDI较大(见表2),溶液不稳定,综合考虑[19]超声时间6 min为最佳超声时间。超声方式的选择∶经超声后再分散的脂质体,更加均一稳定[20]。本研究采用水浴超声,水浴超声为制备多囊泡脂质体的主要方式,对脂质体的结构破坏性较小,经水浴超声后可获得均一稳定的脂质体;而探针超声对脂质体的结构破坏性较大,为小单室脂质体的主要超声方式。

表2 不同超声时间下的粒径、PDI和包封率
2.3.3 水化温度随着水化温度的升高,包封率先升高后降低(表3),水化温度过低不利于脂质膜吸水溶胀,影响药物的包裹效率;水化温度过高时脂质体内的囊泡结构可能会遭到破坏,磷脂材料也会发生氧化变质,进而导致包封率下降。说明热稳定性变化对于脂质体的稳定性[21]有着显著影响。水化温度在45 ℃时包封率达到最大,因此选择45 ℃为最佳水化温度。
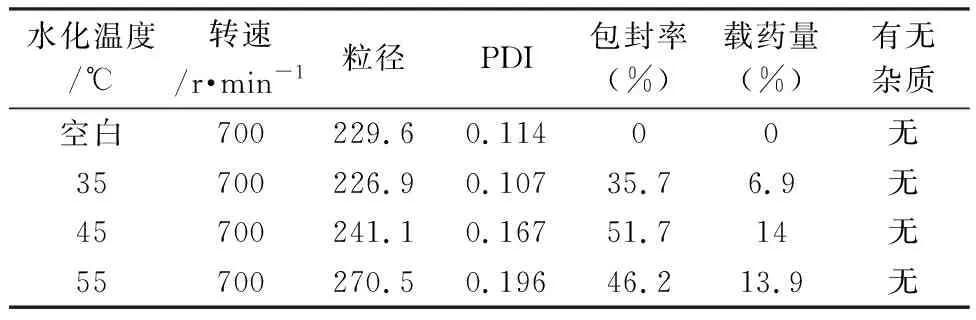
表3 不同水化温度下的粒径、PDI和包封率
2.4 体外透皮试验脂质体是改善亲水性,难溶性和大分子药物透皮递送的有利载体[22];是协同促渗的关键因素,其常与物理促渗、药剂学促渗方法相结合来递送大分子药物。脂质体不但可以包裹亲脂、亲水、两亲性药物,还凭借着与皮肤细胞膜相似的双分子层结构,可增加在角质层(SC)内的蓄积量,从而达到缓慢释药的效果[23]。从体内外释放角度来看,是各个囊泡逐渐破裂,药物逐步释放,因此具有长效缓释的作用[24]。被脂质体包封的药物可以免受其他药物进入人体内发生的生理反应,避免药物被酶降解,从而改善和延长药物在体内循环的时间[25]。
经过24 h的体外经皮渗透试验(见图4a),随着时间的延长,原液和脂质体的累积渗透量均不断增加,且平行几组渗透量之间的误差较小。在透皮给药的前8 h内,原液和ALN脂质体的累积透过量大小基本一致,与原液相比ALN脂质体的释药没有明显的突释,说明脂质体对于药物存在滞留作用,药物被包封在磷脂膜中从而达到缓慢释药的效果。在8 h之后,脂质体中包裹药物的囊泡开始逐个破裂,ALN脂质体的累积渗透量逐渐超过原液的累积渗透量,并且累积渗透量最大可达814.78 μg·mL-1,相当于原液透过量的两倍,也诠释了ALN脂质体具有长效、缓释的作用。
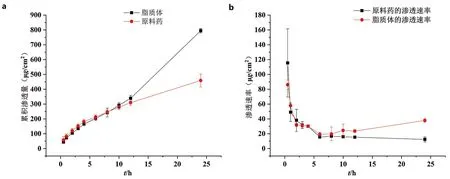
图4 原料药和脂质体的累积渗透量(a)与渗透速率(b)
在渗透速率中(见图4b),在0~0.5 h之间原料药的渗透速率较大,由于药物被脂质体包封,使得脂质体渗透速率较小。在1~4 h之间两者渗透速率相差不大,在6 h之后大量脂质体囊泡破裂,在角质层内形成聚集,进而透过猪皮快速释放药物,使得渗透速率开始超过原料药液,渗透速率逐步增大。又因为脂质体属于胶体系统,具有水合作用和融合释药两个特点,脂质体提供的外源性双层膜,使得角质层细胞间的结构改变,进而使得药物通过扩散和毛细管作用进入细胞间隙。脂质体中的磷脂与角质层脂质融合以后,被细胞内溶酶体所破坏,从而实现药物的缓慢持久释放[26],最后趋于稳定。且原料药与脂质体的几组平行试验的误差较小,重复性较好。
2.5 释放模型Higuchi方程(释放机制为Fick扩散)和零级动力学方程(释放机制为恒速释放)是评估脂质体释放行为的主要方程。Ritger-Peppas模型中的释放参数n<0.45时,服从Fick扩散机制;n>0.89时,为骨架溶蚀机制;0.45 两者透皮基本符合零级、一级动力学方程(R2>0.90)(见表4),说明皮肤对药物的透皮存在限制,且有一定的缓释作用[27]。其中原料药透透皮中Ritger-Peppas方程的拟合最佳(R2>0.997),参数n=0.52为扩散和溶蚀型释放。脂质体透皮中的零级动力学方程拟合最佳,(R2>0.98),说明释放机制为恒速释放[28],符合脂质体作为缓控释药物的释药原理,具有缓慢持久释放药物的作用。 表4 原料药和脂质体平均拟合方程的R2值 本试验制备了含ALN的脂质体并探究了其透皮性能,用紫外分光光度法测得的ALN溶液的标准曲线,方程线性系数在0.999以上,ALN溶液在17~75 μg·mL-1范围内线性良好。筛选出制备脂质体的最佳条件为膜材比2.5∶1、转速700 r·min-1、脂药比10∶1、超声时间6 min、水化温度45 ℃、包封率和载药效率最大分别为49.6%和14%。透皮实验中,脂质体的累积渗透量最大为814.78 μg·cm-2相当于原料药液的两倍。在渗透速率比较中,脂质体的释药速度表现为缓慢且持久的释放,表现出脂质体缓释的特性。动力学释放模型也证实了脂质体在释药过程可形成多储库型系统,从而增强了缓释和控释效果。 本试验制备了含ALN的脂质体,也对未来脂质体的综合性能提高提出挑战,具有进一步临床应用的潜力。与原液相比,采用脂质体作为药物传递载体后,药物的累积渗透量升高,也表明含ALN脂质体比ALN原液更容易穿透皮肤。综上所述,采用脂质体作为载体增加了皮肤中ALN的含量,从而延迟了ALN的释放。研究证明了脂质体包封的ALN的可行性,从而为研究透皮效果好、透过效率强的外用新剂型提供了参考,同时也证实了ALN脂质体可以显著提高透皮吸收速率,增加皮肤蓄积量。但脂质体仍存在物理稳定性差,包封率低等缺点,因此如何进一步增强物理稳定性,提高药物在皮肤内的滞留时间以达到最佳的缓释效果,是一直需要探讨的问题。 为方便用药,可在脂质体的形态上做进一步改进,增加ALN脂质体溶液的黏度做成便于涂布的胶状,增加药物在皮肤表面的停留时间,如将脂质体包封于水凝胶中或做成伤口辅料贴剂等多种制剂来逐步增加药物在皮肤内的滞留量,延长药物作用时间,提高药物利用率。从脂质体类型出发进一步改进,在脂质体的组成部分中可加入表面活性剂等溶剂,使脂质体的柔性增加,增强脂质体的渗透能力。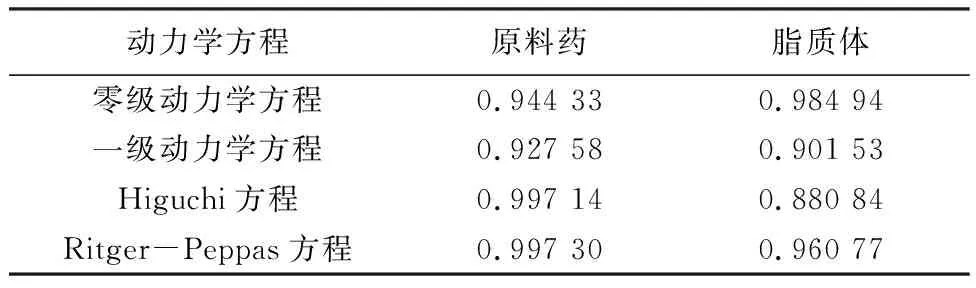
3 讨论
