复合乳酸菌肠溶胶囊增强肾衰宁胶囊对肾纤维化保护作用研究
2024-03-22杨昊宋显瑞张蕾
杨昊,宋显瑞,张蕾
(1江苏省食品药品监督检验研究院,江苏 南京 210019;2.南京中医药大学,江苏 南京 210000)
慢性肾脏疾病(chronic kidney disease,CKD)是发病率颇高且对人体造成严重危害的疾病之一,如今患有慢性肾病的人越来越多,并逐渐年轻化。每年有超过10%的成年人患慢性肾病[1]。其中,肾纤维化是一个缓慢进展的病理过程,是慢性肾病中晚期的主要病理表现,在多种临床疾病的发生发展中扮演重要角色[2]。由结石、感染和肿瘤等引起的慢性梗阻性疾病导致的肾损伤演变成肾纤维化最为常见,可导致有效肾单位的丧失和肾功能不可逆的进行性下降,最终导致肾衰竭[3]。然而目前对于肾纤维化的发生发展,临床上尚无有效的防治手段。
肾衰宁胶囊(Shenshuaining Capsules,SSN)是收载于《中国药典》2020年版的中药复方制剂,由大黄、太子参、黄连、法半夏、陈皮、茯苓、红花、丹参、牛膝、甘草十味药物组成,具有益气健脾、活血化瘀、通腑泄浊的功效,常用于治疗慢性肾功能不全者[4]。对于肾衰竭末期需要进行透析的患者,通过口服肾衰宁胶囊可以提高患者生活质量。但肾衰宁胶囊中含有大量的大黄,若大量服用常引起腹泻。同时,研究发现补充益生菌可减少肾病患者条件致病菌、增加肠道有益菌,减少肠源性内毒素的释放,进而有效改善肾功能水平,抑制患者全身的微炎症状态,延缓肾功能恶化进程[5]。复合乳酸菌肠溶胶囊(Lactic Acid Bacteria Complex Enteric Capsules,LCC)由鼠李糖乳杆菌(Ⅰ株)、屎肠球菌和鼠李糖乳杆菌(Ⅱ株)3种益生菌复合而成,为了缓解肾衰宁胶囊的不良反应,并基于肠-肾轴理论[6],将复合乳酸菌肠溶胶囊(LCC)与小剂量的肾衰宁胶囊联用,进一步寻找肾纤维化治疗的新方法。
1 仪器与材料
1.1 实验动物SPF级雄性Wistar大鼠,4~8周龄,体重160~180 g,购于上海西普尔-必凯实验动物有限公司[实验动物生产许可证号SCXK(沪)2018-0006]。所有动物饲养条件和动物实验都严格地遵循南京中医药大学伦理委员会的规章和制度[伦理审查证书编号:202104A005]。动物适应性喂养7 d后,进行UUO手术模型的建立,给予自由饮水和摄食并保持昼夜规律,动物房温度维持在(22±2)℃[实验动物使用许可证号:SYXK(苏)2018-0049]。
1.2 药品与试剂肾衰宁胶囊(批号:20200515,云南雷允上理想药业有限公司);复合乳酸菌肠溶胶囊(批号:230105,江苏美通制药有限公司)。
溴甲酚紫平皿计数琼脂培养基(BCP,青岛海博生物科技有限公司);4%(V/V)头孢菌素(CEX)BCP培养基,称取头孢氨苄250 mg溶于50 mL注射用水中,每100 mL BCP培养基中加入经0.22 μm滤膜过滤的头孢氨苄混悬液4 mL;2.5%(V/V)四环素BCP培养基,称取四环素(TC)40 mg溶于100 mL注射用水中,每100 mL BCP培养基中加入经0.22 μm滤膜过滤的四环素混悬液2.5 mL;API50CH生化鉴定试剂盒(生物梅里埃公司);苏木素伊红(HE)染色液、Masson染色剂[爱必信(上海)生物科技有限公司];尿素氮检测试剂盒、肌酐检测试剂盒、大鼠D-乳酸试剂盒、大鼠内毒素试剂盒、大鼠DAO试剂盒(南京建成生物科技有限公司);大鼠尿微量白蛋白(MAU)ELISA试剂盒、大鼠IL-6 ELISA试剂盒、大鼠TNF-α ELISA试剂盒、大鼠TGF-β ELISA试剂盒、大鼠C-反应蛋白(CRP) ELISA试剂盒(上海酶联生物科技有限公司);α-SMA一抗、Col1A一抗,HRP-conjugated Affinipure Goat Anti-Rabbit IgG(H+L)、Fluorescein(FITC)-conjugated Affinipure Goat Anti-Rabbit IgG(H+L)(武汉三鹰生物科技有限公司);PrimeScriptTMRT reagent Kit,SYBR©Green PCR Core Reagents Kit(南京诺唯赞生物科技有限公司)。
1.3 主要仪器设备XS105分析天平(瑞士Mettler Toledo公司);SLT-700恒温箱(日本EYELA公司); L535R 低温离心机(长沙湘仪离心机仪器有限公司);BX51显微成像系统、倒置显微镜(日本Olympus公司);AII级生物安全柜(美国Thermo公司);RT-PCR仪(大连大龙生物科技有限公司);q-PCR仪、酶标仪(美国Bio-Rad公司)。
2 方法
2.1 复合乳酸菌肠溶胶囊(LCC)含量测定及生化鉴定取LCC 10 g,加无菌生理盐水至100 mL,摇匀制成混悬液,作为1∶10供试液。取1∶10供试液1 mL,10倍系列稀释成1∶102、1∶103等梯度。取相应稀释级1 mL至平皿,加入培养基,每个梯度平行制备两块平皿,36 ℃培养72 h,琼脂变为黄色的菌落即为乳酸菌,取菌落数在30~300 cfu之间的稀释级计数。
乳酸菌总数(cfu·g-1)=BCP培养基中活菌数;鼠李糖乳杆菌(Ⅰ株)活菌数(cfu·g-1)=含CEX的BCP培养基中活菌数;屎肠球菌活菌数(cfu·g-1)=含TC的BCP培养基中活菌数;鼠李糖乳杆菌(Ⅱ株)活菌数(cfu·g-1)=活乳酸菌总数-[含CEX的BCP培养基中活菌数+含TC的BCP培养基中活菌数]。
自含量测定项下BCP培养基、含CEX的BCP培养基和含TC的BCP培养基中,分别挑取数个单菌落,划线接种于MRS琼脂培养基平皿,36 ℃培养48 h,用API50CH生化鉴定试剂盒进行生化鉴定。
2.2 单侧输尿管梗阻(UUO)大鼠模型的建立大鼠适应性饲养7 d后分组,进行麻醉,打开左侧腹腔,使用6-0手术线对左肾的输尿管进行2次结扎,建立UUO模型。
从造模后第1天开始,每天1次灌胃给药,分别给予1.5、3、6 g·kg-1肾衰宁胶囊(SSN,使用蒸馏水溶解不同浓度的肾衰宁胶囊)以及3 g·kg-1肾衰宁胶囊(SSN)和165 mg·kg-1复方乳酸菌肠溶胶囊(LCC)联合使用,假手术组给予同等体积的蒸馏水,给药第21天处理动物。
2.3 血液、肾组织和肠组织收集处理方法末次给药后,腹主动脉取血。解剖取肾组织及肠组织,称重,并计算肾系数。肾系数(kidney coefficient)=肾重(mg)/体重(g)。剩余肾组织保存于-80 ℃超低温冰箱,用于其他指标的检测。
2.4 H&E染色和Masson染色肾组织经4%甲醛溶液固定后,脱水,石蜡包埋,切成2 μm薄片,采用HE和Masson三色方法进行染色。HE染色检查炎性评分情况。Masson染色检测根据其胶原沉积程度给出蓝色胶原占切片组织面积的百分比,用于统计分析。
2.5 尿素氮(BUN)和血肌酐(Scr)含量测定方法大鼠血液于4 ℃、3 000 r·min-1,离心30 min,取上层血清,使用南京建成生物公司的尿素氮和血肌酐试剂盒,按照尿素氮检测试剂盒(脲酶法)说明书及肌酐检测试剂盒(肌氨酸氧化酶法)说明书进行检测和计算血清中尿素氮和肌酐的含量。
2.6 免疫组织化学染色根据文献中IHC染色方法[7]检测肾脏组织中的Col1A和α-SMA分布和表达,并使用显微镜观察,拍照,并用Image J软件半定量测定阳性染色面积,计算阳性染色百分比进行统计学分析。
2.7 MAU、IL-6、TNF-α、TGF-β和CRP的含量检测收集大鼠第20天24 h的尿液(收集前禁食禁水8 h),用于尿微量白蛋白(MAU)检测。
将肾组织4 ℃、12 000 r·min-1离心10 min,取上清液,按照白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、转化生长因子-β(TGF-β)和C反应蛋白(CRP)的ELISA试剂盒说明书进行检测。
2.8 D-乳酸、内毒素和二胺氧化酶(DAO)的含量检测大鼠血液于4 ℃、3 000 r·min-1离心30 min,取上层血清,使用南京建成生物公司的D-乳酸、内毒素和二胺氧化酶(DAO)试剂盒,按照D-乳酸检测试剂盒(比色法)说明书、内毒素检测试剂盒(鲎试剂法)说明书和DAO检测试剂盒(紫外比色法)进行检测和计算血清中D-乳酸、内毒素和二胺氧化酶(DAO)的含量。
2.9 mRNA含量检测按照文献中mRNA检测方法对肠组织ZO-1、Occludin、Claudin-1、Claudin-2 mRNA进行检测[7]。
2.10 统计分析多个独立的实验结果均采用mean±SD表示,两组间以Student′s t-test进行显著性差异检验,P<0.05表示差异具有统计学意义。
3 结果
3.1 乳酸菌含量、生化鉴定结果及复合乳酸菌肠溶胶囊(LCC)给药剂量中活菌数根据乳酸菌计数实验结果,每1 g内容物含活乳酸菌总数为2×107cfu·g-1,鼠李糖乳杆菌(Ⅰ株)数为1×107cfu·g-1,屎肠球菌数为6×105cfu·g-1,鼠李糖乳杆菌(Ⅱ株)数为9×106cfu·g-1。
从3种培养基中挑取的菌落,通过API50CH生化鉴定试剂盒,分别鉴定出对应的鼠李糖乳杆菌(Ⅰ株),屎肠球菌和鼠李糖乳杆菌(Ⅱ株)。
将大鼠给药剂量165 mg·kg-1复方乳酸菌肠溶胶囊(LCC)换算成活菌计数,鼠李糖乳杆菌(Ⅰ株)为1.3×106cfu·kg-1,屎肠球菌为7.9×104cfu·kg-1,鼠李糖乳杆菌(Ⅱ株)为1.2×106cfu·kg-1。
3.2 复合乳酸菌肠溶胶囊(LCC)与肾衰宁胶囊(SSN)联合治疗对UUO大鼠肾功能的影响如图1A和B所示,UUO模型组大鼠体重与假手术组比较,终末体重有明显的下降,肾系数明显升高,但给予不同剂量的肾衰宁胶囊其体重回调不明显,只有高剂量(6 g·kg-1)肾衰宁胶囊(SSN)可以改善肾系数,而中剂量(3 g·kg-1)肾衰宁胶囊(SSN)与复合乳酸菌肠溶胶囊(LCC)联合治疗后,能明显增加大鼠的体重(P<0.01)和肾系数(P<0.01),说明LCC能够增加SSN对肾纤维的治疗效果。

A.大鼠终末体重;B.肾系数;C.血清尿素氮(BUN);D.血肌酐(Scr);E.尿微量白蛋白(MAU)含量;SSN为肾衰宁胶囊;LCC为复合乳酸菌肠溶胶囊图1 LCC联合SSN治疗对UUO大鼠肾功能的影响注:与模型(UUO)组相比,*P<0.05,**P<0.01,***P<0.001。
如图1C和D所示,模型组的尿素氮(BUN)、血肌酐(Scr)含量明显高于假手术组;与模型组相比,SSN高剂量组可显著降低BUN和Scr的含量(P<0.05),而低、中剂量却无明显作用,但LCC与中剂量(3 g·kg-1)SSN联用后BUN和Scr明显降低(P<0.05和P<0.01),表明LCC能够增强SSN对肾功能的改善作用。
如图1E所示,模型组大鼠尿液中的尿微量白蛋白(MAU)含量明显高于假手术组;与模型组相比,LCC与中剂量(3 g·kg-1)SSN联用和高剂量SSN单用一样,都可显著降低大鼠尿液中的MAU含量(P<0.01)。基于以上结果,说明LCC能够增强SSN对肾纤维化的改善作用。
3.3 复合乳酸菌肠溶胶囊(LCC)与肾衰宁胶囊(SSN)联合治疗能够改善UUO大鼠肾纤维化大鼠肾组织HE染色结果如图2A&E所示,UUO模型组肾小管萎缩,表现为上皮细胞变小,排列紧密,或管腔明显扩张,上皮细胞低立方或扁平状,肾小管腔内有透明管型。相比模型组,LCC与3 g·kg-1SSN联用治疗后大鼠肾组织的肾小管、肾小球、间质病变程度均显著减轻(P<0.01)。
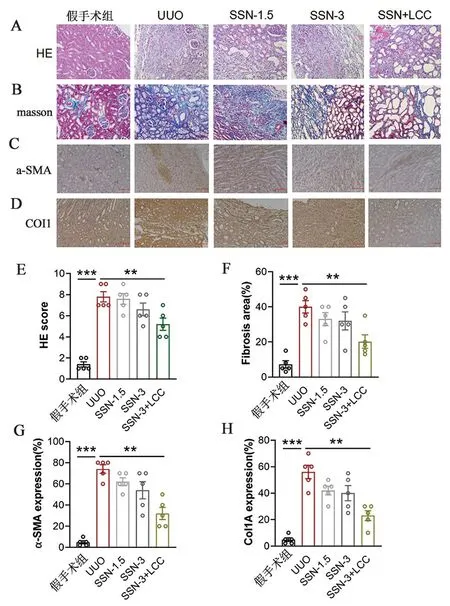
A.肾组织H&E染色切片(×200);B.肾组织Masson染色切片(×200);C.免疫荧光染色切片(α-SMA 100 μm);D.免疫荧光染色切片(Col1 100 μm);E.炎性评分;F.胶原沉积百分比;G.α-SMA蛋白半定量分析;H.Col1A蛋白半定量分析;SSN为肾衰宁胶囊;LCC为复合乳酸菌肠溶胶囊图2 LCC联合SSN治疗对UUO大鼠肾纤维化的影响注:与模型(UUO)组相比,**P<0.01,***P<0.001。
大鼠肾组织Masson染色结果如图2B&F所示。模型组大鼠肾盂黏膜下、髓质可见少量纤维组织增生,Masson染色呈蓝绿色的纤维条索。相比模型组,LCC联合3 g·kg-1SSN给药组大鼠肾组织胶原沉积程度均显著减轻(P<0.01)。
如图2C~D、G~H所示,使用免疫组化的方法检测了Col1A和α-SMA的蛋白表达,发现与假手术组相比,UUO模型组大鼠肾组织的Col1A和α-SMA蛋白含量明显增加(P<0.001),3 g·kg-1SSN也能轻微减少α-SMA和Col1A蛋白表达,而LCC联合3 g·kg-1SSN治疗可显著降低Col1A和α-SMA蛋白表达(P<0.01),说明LCC联合SSN治疗能够改善肾输尿管梗阻引起的肾纤维化相关蛋白的表达,减轻肾纤维化的程度。
3.4 复合乳酸菌肠溶胶囊(LCC)联合肾衰宁胶囊(SSN)治疗对UUO大鼠的抗炎作用如图3所示,与假手术组相比,模型组肾组织中的IL-6(见图3A)、TNF-α(见图3B)、TGF-β(见图3D)和血浆中的CRP(见图3C)都明显升高,表明UUO模型中发生明显炎症反应;与模型组相比,LCC与SSN联合治疗,可显著降低IL-6(P<0.01)、TNF-α(P<0.001)、CRP(P<0.01)和TGF-β(P<0.05)的含量,表明LCC与SSN联用能明显减轻炎症相关因子的表达,起到良好的抗炎效果,其中TGF-β也是目前已知最强的促纤维化因子。因此上述结果说明,UUO模型大鼠肾组织的炎症和纤维化程度明显增加,而LCC能明显增强SSN对UUO大鼠的抗炎和抗纤维化作用。

A.肾组织IL-6含量;B.TNF-α含量;C.血浆中CRP含量;D.肾组织TGF-β含量;SSN为肾衰宁胶囊,LCC为复合乳酸菌肠溶胶囊图3 LCC联合SSN治疗对UUO大鼠炎性因子的影响注:与模型(UUO)组相比,*P<0.05,**P<0.01,***P<0.001。
3.5 复合乳酸菌肠溶胶囊(LCC)联合肾衰宁胶囊(SSN)治疗明显改善UUO大鼠的肠黏膜屏障功能表1数据显示,UUO大鼠血清中的D-乳酸(D-LA)、内毒素和DAO的水平显著升高,提示存在肠黏膜损伤。而在药物干预组中,LCC与SSN联用可显著降低这3项指标(P<0.05),但SSN中剂量(3 g·kg-1)对指标的降低程度不及药物联用显著,说明LCC能够增强SSN对UUO大鼠肠黏膜屏障功能的保护作用。

表1 各组肠黏膜屏障功能比较
3.6 复合乳酸菌肠溶胶囊(LCC)联合肾衰宁胶囊(SSN)治疗对UUO大鼠肠道紧密连接蛋白的影响采用Q-PCR对肠道mRNA进行检测发现,与假手术组相比,UUO模型组ZO-1、Occludin及Claudin-1 mRNA表达量显著降低,Claudin-2基因表达显著升高,而经SSN低中剂量治疗之后,其改善作用并不明显,而与LCC联用干预后,ZO-1、Occludin及Claudin-1 mRNA基因表达量均呈现出显著上升趋势,Claudin-2基因表达显著降低(图4A~D),说明LCC与SSN联用能够增强SSN对大鼠肠黏膜功能的改善作用。

A.ZO-1表达;B.Occludin表达;C.Claudin-1表达;D.Claudin-2mRNA表达;SSN为肾衰宁胶囊,LCC为复合乳酸菌肠溶胶囊图4 LCC联合SSN治疗对UUO大鼠肠组织紧密连接蛋白的影响注:与模型(UUO)组相比,*P<0.05,**P<0.01,***P<0.001。
4 讨论
肾脏疾病是一种从肾炎循序渐进发展至肾脏纤维化最终发展成肾衰竭的疾病,到目前为止,对于肾衰竭、肾脏纤维化类肾脏疾病治疗手段较为有限,当肾脏病发展到肾脏纤维化时,其对于机体是一个不可逆的过程,现代医学主要治疗手段仅有血液透析和器官移植,副作用较大且具有一定的局限性[7]。中药复方肾衰宁胶囊是现阶段较为成熟的治疗肾功能不全类疾病的有效药物之一,但基于大剂量可能引起腹泻等不良反应,许多临床研究使用西药辅佐以肾衰宁胶囊联用,以保证治疗效果的稳定[8]。
有学者认为,肾病患者的肾小球滤过率下降会导致结肠聚集大量的尿酸和草酸盐,导致肠道环境的改变,进一步加重肠道菌群紊乱。肠通透性增加可导致脂多糖持续渗透到门静脉,导致代谢性内毒素血症,并升高炎性细胞因子的水平,加速肾病的病程进展[9-11]。因此,肾病和肠道菌群失调可能互为因果,这种关系使机体处于恶性循环中。现就肠道菌群对肾病的影响将益生菌与肾衰宁胶囊联用,以期为寻找治疗肾病潜在方法提供依据。
复合乳酸菌肠溶胶囊由鼠李糖乳杆菌(Ⅰ株)、屎肠球菌和鼠李糖乳杆菌(Ⅱ株)3种益生菌复合而成,鼠李糖乳杆菌依附于宿主的肠上皮细胞,能够成为肠道黏膜的一层生物屏障,从而达到提升宿主肠道黏膜屏障能力,减少过敏原对肠黏膜的刺激、减轻炎症反应,从而提升机体免疫力;还可以预防和治疗腹泻。屎肠球菌也可在肠道上皮细胞上形成生物膜,保护肠上皮细胞免受有害物质侵袭,对假单孢菌、沙门菌及志贺氏菌有较好的抑制作用。所以,实验中将复合乳酸菌与肾衰宁胶囊联用,发现肾小球滤过功能相关指标尿素氮(BUN)、血肌酐(Scr)[12],及肾功能相关指标尿微量白蛋白(MAU)[13]都比肾衰宁胶囊单用的药效明显,并对肾纤维化大鼠的肠道黏膜损伤的血清标志物DAO、D-LA及内毒素[14]进行了检测,发现药物联用也能显著改善肠黏膜屏障功能。同时,Occludin及Claudin-1作为跨膜蛋白,ZO-1为外周膜支架蛋白,皆为肠道紧密连接不可或缺的重要组成部分[15],将肾纤维化大鼠给予药物联合作用后,发现肠道紧密连接蛋白都趋于正常。对肾组织进一步检测发现,LCC和SSN联合治疗也降低了肾组织中IL-6、TNF-α等炎症因子[16]的表达及胶原等纤维化基质的蓄积。本文从平衡肠道微环境,保护肠黏膜屏障功能,维持肠道菌群稳态出发,进而减轻炎症反应,抑制肾纤维化的进一步恶化,同时减轻了大量使用药物对机体带来的副作用,为今后中药联合益生菌预防和治疗肾病提供更多方向。
