高嘌呤饮食对果蝇生长发育的影响①
2024-03-22关宝生张睿迪闫茹雪秦振波于瀚普赵梓源尹相林
关宝生,张睿迪,王 贺,闫茹雪,秦振波,于瀚普,赵梓源,尹相林
(1. 佳木斯大学公共卫生学院,黑龙江 佳木斯 154007;2. 黑龙江省痛风研究重点实验室,黑龙江 佳木斯 154007)
嘌呤本身并不是营养素,它是DNA或者RNA的组成部分,是以嘌呤核苷酸的形式存在于真核生物的细胞核、细胞质和线粒体中的一种物质。因此,任何真核细胞的天然食物中都含有大量的嘌呤。摄入体内的嘌呤首先会转化为次黄嘌呤,次黄嘌呤在黄嘌呤氧化还原酶(xanthine oxidoreductase, XOR)的作用下转化为黄嘌呤,最后黄嘌呤在XOR的作用下转变成尿酸(uric acid, UA),由于人体内缺乏尿酸氧化酶,不能将UA代谢成尿囊素排出体外,因此UA是人体内嘌呤代谢的终产物,最终经由肾脏以尿液的形式排出体外[1]。一旦肾脏排泄UA的能力下降或者是UA生成过多,就会发展成为高尿酸血症,甚至发展为痛风。绝大多数痛风患者都表现为肾脏对尿酸盐的清除率下降。近年来的研究发现,UA可能通过其抗氧化活性来调节生殖信号传导和胰岛素/IGF-1信号传导(IIS)通路[2,3]。在中国成人Ⅱ型糖尿病患者中,UA与IGF-1存在非线性关系,当UA水平达到拐点时,IGF-1水平与UA的增加呈负相关[4]。但UA在生长发育中的具体机制尚不明确,因此本研究旨在探讨高嘌呤饮食对果蝇生长发育的影响,为今后UA在生长发育中具体机制的研究提供理论基础。
1 材料与方法
1.1 果蝇品系及饲养条件
本研究选用W1118野生型黑腹果蝇,由佳木斯大学尿酸生理功能研究团队自有,均使用标准玉米粉培养基饲养。在温度(25±0.5)℃、湿度(40±0.5)%、光照周期为12h的培养箱中培养。
1.2 实验试剂
腺嘌呤购于北京索莱宝生物科技有限公司,酵母购于英联马利(英国联合食品集团),丙酸购于美国Sigma公司。
1.3 实验方法
1.3.1 培养基的配制
分别称取表1中的试剂(除丙酸以外)于烧杯中搅拌均匀,置于高压锅中蒸煮25min,待冷却至60~70℃时加入丙酸以及相对应的腺嘌呤粉末(对照组为0%;低浓度干预组为0.05%;高浓度干预组为0.1%),搅拌均匀后倒至准备好的各实验组果蝇管中备用,见表1。

表1 培养基配方
1.3.2 果蝇成虫寿命的检测
取新产出的果蝇卵若干,分别置于对照组、低浓度干预组、高浓度干预组3组培养基中培养,取羽化后8h以内的果蝇,每组200只(雌雄各100只),按性别随机分到8个管中,雌雄各4管、每管25只,分别在各实验组对应培养基中培养。每天同一时间观察果蝇的死亡情况,实验重复3次取平均值。
1.3.3 果蝇成虫攀爬能力的检测
各实验组取羽化后8h以内的果蝇,每组150只(雌雄各75只),按性别随机分到6个管,雌雄各3管、每管25只,分别在各实验组对应培养基中培养。根据课题组前期预实验,设定本次实验周期为15d,在培养至第15d后进行攀爬能力的检测,爬行能力测试标准线为8cm、时间5s。
1.3.4 果蝇成虫产卵量的检测
取各实验组羽化后8h以内的果蝇,在各实验组对应培养基中培养,15d后进行产卵量的检测。将各组果蝇以雌:雄=1:3的比例放入洒满酵母的琼脂培养基中培养24h,然后收集并记录琼脂培养基中果蝇卵的数量,每组设10个平行对照。
1.3.5 统计学方法
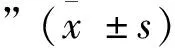
2 结果
2.1 各实验组果蝇成虫的生存情况
与对照组相比,在雌果蝇中,各干预组果蝇的生存率无明显变化,差异无统计学意义(P>0.05);在雄果蝇中,低浓度干预组果蝇的生存率明显降低,而高浓度干预组果蝇的生存率明显上升,差异有统计学意义(P<0.05),见表2、3,图1。

图1 各实验组果蝇生存率的变化情况

表2 各实验组雌果蝇成虫的生存率(n, %)

表3 各实验组雄果蝇成虫的生存率(n, %)
2.2 各实验组果蝇成虫的平均寿命
与对照组比较,随着培养基中腺嘌呤浓度的升高,各干预组果蝇平均寿命明显降低,差异均有统计学意义(P<0.01);雌果蝇的平均寿命明显高于雄果蝇,差异均有统计学意义(P<0.01),见表4,图2~4。
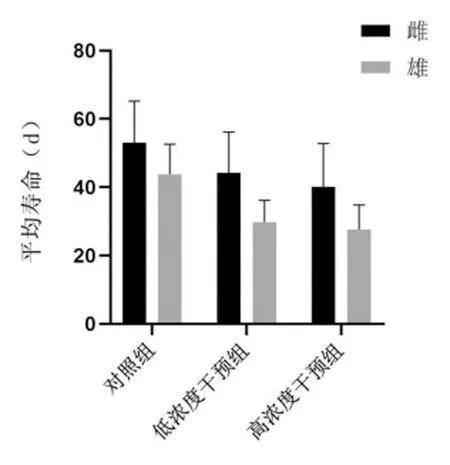
图2 各实验组果蝇的平均寿命

图3 各实验组雌果蝇的生存分析

图4 各实验组雄果蝇的生存分析

表4 各实验组果蝇的平均寿命
2.3 各实验组果蝇成虫攀爬能力的变化情况
与对照组相比,低浓度干预组果蝇的攀爬能力有所降低,但其差异无统计学意义(P>0.05),高浓度干预组果蝇的攀爬能力明显降低,差异有统计学意义(P<0.01),见表5、6,图5。

图5 各实验组果蝇攀爬能力的变化情况

表5 各实验组雌果蝇成虫的攀爬情况

表6 各实验组雄果蝇成虫的攀爬情况
2.4 各实验组果蝇成虫产卵量的变化情况
与对照组比较,随着培养基中腺嘌呤浓度的升高,各干预组果蝇的产卵量明显降低,差异均有统计学意义(P<0.05),见表7,图6。

图6 各实验组果蝇产卵量的变化情况

表7 各实验组果蝇产卵量的变化情况
3 讨论
越来越多的研究发现,UA与生长发育有一定的相关性[5]。UA作为人体内嘌呤核苷酸代谢的终产物,当体内血清UA水平维持在正常偏低的水平时,UA可能会发挥其抗氧化的作用,延缓认知衰退,改善神经退行性疾病[6,7],而过高浓度的血清UA水平可能会发挥其促氧化的作用,进而诱发糖尿病、高血压等疾病的发生发展[8-10]。目前研究发现,活性氧(ROS)可能通过直接破坏线粒体DNA(mtDNA)或者导致线粒体功能障碍,进而诱发细胞衰老[11,12]。但UA是否能通过刺激ROS的产生从而影响生长发育及其具体机制尚未明确。
本研究结果显示,在高嘌呤饮食的干预下,各干预组果蝇羽化后的平均寿命明显缩短,提示高嘌呤饮食干预可能诱导果蝇体内UA生成过多以至于超过自身的代偿能力,从而影响机体内的正常代谢,缩短果蝇的寿命。在同一浓度腺嘌呤干预下,雌果蝇的平均寿命明显高于雄果蝇,提示在果蝇体内雌激素可能抵消掉了一部分UA产生的不利影响。此前的流行病学数据也验证了这一现象,绝经前期的女性与男性比较,更不容易罹患高尿酸血症以及肾脏疾病,这可能与17β-雌二醇(E2)密切相关[13]。研究发现ROS可能通过直接调节促性腺激素释放激素(GnRH)神经元的兴奋性来影响生育能力[14]。而本研究结果显示,高嘌呤饮食对果蝇的产卵量有明显的抑制作用。提示可能是果蝇体内生成过多的UA诱导ROS调节GnRH来影响生育能力。根据以往研究显示,高水平的血清UA可能会诱发炎症反应,导致炎症因子生成过多,刺激中性粒细胞诱导氧化应激损伤,影响肌腱等组织,从而导致果蝇的运动能力的下降[15]。本研究结果显示,随着培养基中腺嘌呤浓度的升高,各实验组果蝇攀爬能力逐渐下降。也有研究显示,长期雌激素剥夺会导致大鼠的运动障碍[16],而本次研究中高嘌呤饮食诱导的果蝇运动能力减弱是否与雌激素有关还需进一步研究。
综上所述,本次研究结果显示,高嘌呤饮食能明显抑制果蝇的生长发育,为研究UA与衰老之间的相关关系提供了理论依据。接下来我们将进一步探讨UA影响果蝇生长发育的具体机制,以及雌激素在其中发挥了何种作用,为揭示尿酸的生理功能提供新的方向。
