抑制抗增殖蛋白2增强非小细胞肺癌细胞系A549对厄洛替尼敏感性
2024-03-22杨自更蔡文琴曹维维韦红梅薛茜茜
张 婧,杨自更,蔡文琴,曹维维,韦红梅,薛茜茜,吴 宾*
新疆军区总医院 1.营养科;2.核医学科;3.体检中心,新疆 乌鲁木齐 830000;4.大连康复疗养中心 疗养四科,辽宁 大连 116000
肺癌(lung cancer)是危害人类健康的重大疾病,具有高发病率和高病死率的特点[1-2]。非小细胞肺癌(non-small-cell lung cancer,NSCLC)占所有肺癌病例的85%以上,75%以上的患者首次就诊时已经是肺癌晚期[3-4]。以吉非替尼(gefitinib,Gef)、厄洛替尼(erlotinib,Erl)等为代表的表皮生长因子酪氨酸酶抑制剂(epithelial growth factor receptor tyrosine kinase inhibitor,EGFR-TKI)延长了携带EGFR突变的肺癌患者的总生存期,而EGFR-TKI耐药严重限制了其治疗成效[5-7]。因此,寻找有效的EGFR-TKI耐药新靶点具有重要的意义。
抗增殖蛋白2(prohibitin 2,PHB2)属于prohibitin家族成员,参与信号转导、凋亡、炎性反应等多种细胞生物学过程[8]。研究显示,与正常组织相比,PHB2高表达于多种类型的恶性肿瘤,被认为可能是预测肿瘤预后的独立指标[9]。课题组前期研究发现,敲低PHB2可抑制NSCLC细胞的增殖、迁移和侵袭[10]。PHB2是线粒体自噬的重要线粒体膜受体之一[11],而靶向药物耐药与线粒体自噬密切相关[12],PHB2在靶向药物耐药中是否也发挥重要的作用尚不清楚。本研究主要探讨PHB2在厄洛替尼继发性耐药中的作用及机制。
1 材料与方法
1.1 材料
NSCLC细胞系A549、NCI-H1299细胞和PC-9细胞(中国科学院上海细胞库);0.1%结晶紫溶液(西安赫特生物公司);CCK-8法细胞活性检测试剂盒、5-乙炔基-2’-脱氧尿苷(5-ethynyl-2’-deoxyurid-ine,EdU)细胞增殖检测试剂盒、蛋白裂解液和JC-1线粒体膜电位检测试剂盒(上海碧云天生物有限公司);线粒体呼吸链复合物Ⅰ/Ⅱ/Ⅴ活性检测试剂盒(美国索莱宝生物有限公司);Lipofectamine 2000(Invitrogen公司);RPMI 1640培养基、双抗(青/链霉素混合液)和胎牛血清(BI公司);蛋白Marker(北京Applygen公司);TUNEL试剂盒、厄洛替尼(Roche公司);抗PHB2抗体(武汉三鹰生物技术有限公司);内参β-actin抗体和HRP标记的荧光二抗(CST公司);小干扰RNA(small interfering RNA,siRNA)(上海吉玛生物技术有限公司);腺病毒绿色荧光蛋白-微管相关蛋白(green fluorescent protein-microtuble-associated protein light chain 3 alpha,GFP-LC3)(上海汉恒生物技术有限公司)。
1.2 方法
1.2.1 细胞培养:将冻存NSCLC细胞系(A549、H1299和PC-9)迅速取出,在水浴锅中震荡冻存管,转移到离心管中,离心,重悬,接种在新的培养瓶中,于5% CO2、37 ℃条件下常规培养,第2日换液。
1.2.2 实验分组:观察NSCLC细胞系对厄洛替尼(Erl)的敏感性,实验分为6组,Erl浓度分别为0、1、2、3 、4和5 μmol/L;观察厄洛替尼对线粒体自噬的影响实验分为对照组(NC)和厄洛替尼(Erl)处理组(2 μmol/L);在A549细胞中转染PHB2小干扰RNA(siPHB2),观察PHB2在A549细胞对厄洛替尼敏感性中的作用,实验分为对照组(siCtrl)、PHB2敲减组(siPHB2)、对照组+厄洛替尼处理组(siCtrl+Erl)和PHB2敲减+厄洛替尼处理组(siPHB2+Erl)。其中,siCtrl+Erl组和siPHB2+Erl组用浓度为2 μmol/L的厄洛替尼处理。
1.2.3 siPHB2转染实验:siPHB2由上海吉玛公司合成。培养的细胞经常规消化,离心,重悬。将细胞浓度调整为1×104~1×105/mL,接种于24孔板。取一离心管,加入50 μL的无血清培养基和20 pmol/L的siRNA,混匀后放置5 min,标记为A液;在另一离心管中,同样加入50 μL的无血清培养基和5 μL的Lipofectamine 2000,放置5 min,标记为B液。混合A液和B液,静置20 min。将混合液共计105 μL加入到24孔板的每孔中,常规培养。
1.2.4 CCK-8法测定细胞活性:各组细胞常规消化离心,加入新鲜培养基重悬细胞。将各组细胞的浓度调整为1×105/mL,每孔加入100 μL的细胞悬液,接种于96孔培养板。用含10%的CCK-8试剂的新鲜基础培养基替换原培养基,37 ℃下培养1 h,用酶标仪测各组在450 nm处的吸光度值(A450 nm)。
1.2.5 平板集落实验测定集落形成能力:各组取对数生长期的细胞,胰蛋白酶常规消化,离心,重悬。将各组细胞的将浓度调整为1×103/mL。再往6孔板每个孔中加入200 μL的细胞悬液,摇晃铺匀,常规培养。当孔中出现明显的集落时,可以终止培养。每孔加入甲醇溶液1 mL固定,加入结晶紫染色液处理10 min。晾干,拍照,保存图片用于进一步分析。
1.2.6 EdU染色测定细胞增殖:取对数生长期细胞,以每孔4×103/mL接种于共聚焦皿,常规培养。4%甲醛固定,配置和加入EdU工作液,孵育2 h。DAPI染液染核,共聚焦显微镜下观察,拍照用于进一步分析。
1.2.7 TUNEL测定细胞凋亡:将各组细胞接种于共聚焦皿中,4%甲醛固定。加入通透液,作用10 min。配制和加入TUNEL工作液,避光,37 ℃的条件下孵育1 h。DAPI染核,常温孵育5 min。用甘油封片,共聚焦显微镜观察,拍照用于进一步分析。
1.2.8 Western blot测定蛋白质表达:收集各组细胞,加细胞裂解液提蛋白,BCA法蛋白定量。SDS-PAGE分离蛋白;转膜,牛奶封闭,加一抗,孵育过夜,第2天加二抗孵育1 h,ECL发光,保存图片用于后续分析。
1.2.9 比色法测定线粒体呼吸链复合物Ⅰ/Ⅱ/Ⅴ活性:将各组细胞消化离心,下层细胞(细胞量约1×106个)匀浆破碎,涡旋混匀1 min。常规提取线粒体呼吸链复合体;配制工作液,按说明书步骤操作,比色法测定,绘制标准曲线,计算线粒体呼吸链复合物Ⅰ/Ⅱ/Ⅴ活性。
1.2.10 细胞色素c含量检测:按文献[13]所述,消化离心收集各组细胞,常规分离胞质蛋白和线粒体蛋白,配制工作液,按照说明书测定细胞内胞质蛋白和线粒体蛋白细胞色素c含量。
1.2.11 MitoTracker染色和腺病毒绿色荧光蛋白-微管相关蛋白(green fluorescent protein-microtuble-associated protein light chain 3 alpha,GFP-LC3)转染观察线粒体和微管相关蛋白(microtuble-associated protein light chain 3 alpha,LC3)共定位:常规消化细胞,制备成单细胞悬液。细胞接种于共聚焦皿上,常规感染腺病毒GFP-LC3,配置MitoTracker染色液,避光,37 ℃的条件下孵育30 min。共聚焦显微镜观察LC3表达、LC3线粒体共定位情况。
1.2.12 JC-1染色:使用JC-1染色检测线粒体膜电位的变化。吸除共聚焦皿中培养液,用PBS缓冲液洗涤细胞。加入1 mL细胞培养液,然后加入1 mL JC-1染色工作液,充分混匀,细胞培养箱中孵育20 min。吸除细胞培养液,按照说明书配制适量的JC-1染色缓冲液,用JC-1染色缓冲液洗涤两次。加入2 mL细胞培养液,激光共聚焦显微镜下观察,拍照留存图片并分析结果。
1.3 统计学分析
2 结果
2.1 NSCLC细胞系对厄洛替尼的敏感性
随着厄洛替尼浓度梯度的增加,H1299细胞和PC-9细胞的活性呈浓度依赖性降低(P<0.05),在厄洛替尼5 μmol/L浓度范围内,A549细胞的活性无明显的改变(图1)。
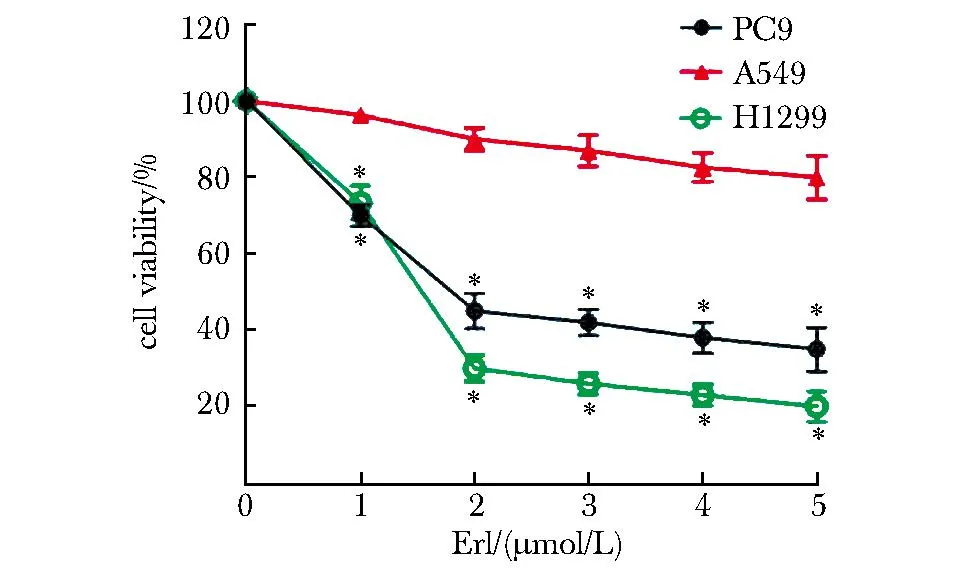
*P<0.05 compared with 0 μmol/L group.
2.2 厄洛替尼可增加A549细胞PHB2表达和线粒体自噬水平
与NC组相比,Erl组PHB2和LC3Ⅱ蛋白表达显著增加(P<0.05),胞内LC3Ⅱ免疫荧光增加(P<0.05),LC3Ⅱ染色与线粒体染色共定位比率增加(P<0.05)(图2)。
2.3 瞬转siRNA敲低A549细胞内PHB2表达
与siCtrl组相比,siPHB2组PHB2表达显著降低(P<0.05)(图3)。
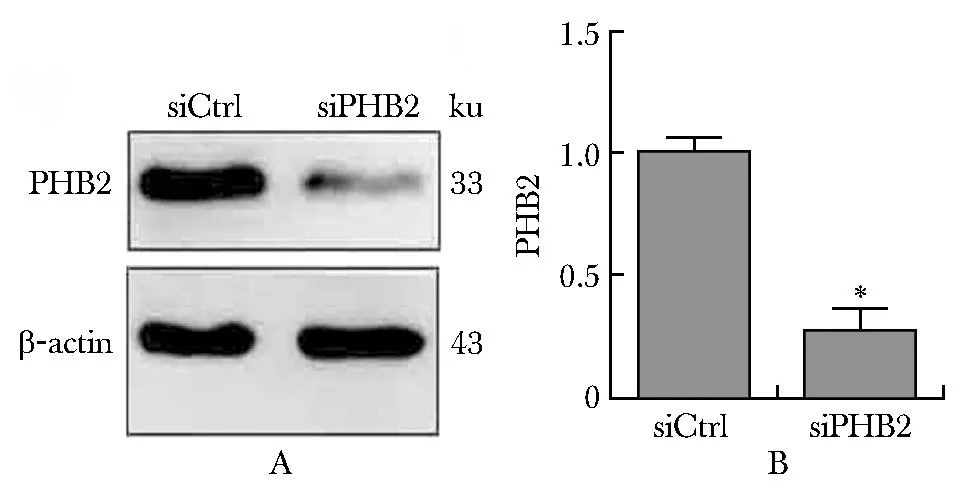
A, B.representative immunoblots and densitometric quantification for PHB2 and β-actin in A549 cells with PHB2 knockdown; *P<0.05 compared with siCtrl group.
2.4 敲低PHB2可增强厄洛替尼抑制A549细胞增殖的作用
与siCtrl组相比,siPHB2组EdU阳性的细胞数显著减少(P<0.05);与siPHB2组和siCtrl+Erl组相比,siPHB2+Erl组EdU阳性的细胞数显著减少(P<0.05);siCtrl组和siCtrl+Erl组之间EdU阳性的细胞数差异无统计学意义(图4)。
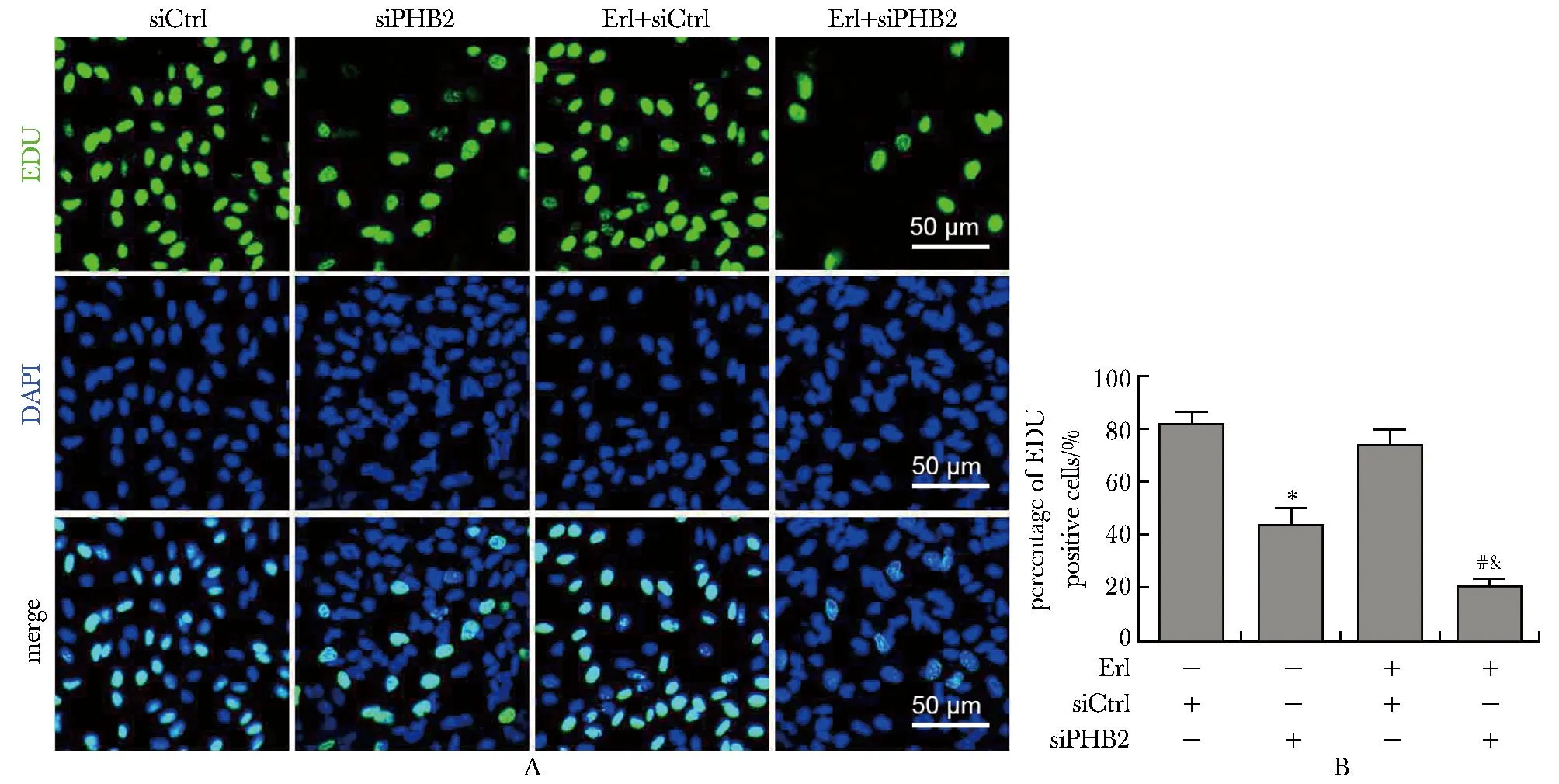
A, B.representative images of the EdU assay and quantitative analysis of the EdU-positive cell ratio from the respective groups; *P<0.05 compared with siCtrl group; #P<0.05 compared with siPHB2 group; &P<0.05 compared with siCtrl+Erl group.
2.5 敲低PHB2可增强厄洛替尼抑制A549细胞集落形成能力的作用
与siCtrl组相比,siPHB2组集落形成数目显著减少(P<0.05);与siPHB2组和siCtrl+Erl组相比,siPHB2+Erl组集落形成数目显著减少(P<0.05);siCtrl组和siCtrl+Erl组之间集落形成数目差异无统计学意义(图5)。

A, B.representative images and quantitation of colony formation of A549 cells from the respective groups; *P<0.05 compared with siCtrl group; #P<0.05 compared with siPHB2 group; &P<0.05 compared with siCtrl+Erl group.
2.6 敲低PHB2可增强厄洛替尼诱发的A549细胞凋亡
与siCtrl组相比,siPHB2组TUNEL阳性的细胞数显著增加(P<0.05);与siPHB2组和siCtrl+Erl组相比,siPHB2+Erl组TUNEL阳性的细胞数显著增加(P<0.05); 而siCtrl组和siCtrl+Erl组之间TUNEL阳性的细胞数差异无统计学意义(图6)。

A, B.representative images of the TUNEL assay and quantitative analysis of the apoptotic index for A549 cells from the respective groups; *P<0.05 compared with siCtrl group; #P<0.05 compared with siPHB2 group; &P<0.05 compared with siCtrl+Erl group.
2.7 敲低PHB2可增强厄洛替尼诱发的线粒体功能受损
与siCtrl组相比,siPHB2组线粒体膜电位显著降低(P<0.05),线粒体内细胞色素c减少(P<0.05),而细胞质内细胞色素c增加(P<0.05),线粒体呼吸链复合物Ⅰ/Ⅱ/Ⅴ活性均显著降低(均P<0.05);与siPHB2组和siCtrl+Erl组相比,siPHB2+Erl组线粒体膜电位显著降低(P<0.05),线粒体内细胞色素c减少(P<0.05),而细胞质内细胞色素c增加(P<0.05),线粒体呼吸链复合物Ⅰ/Ⅱ/Ⅴ活性均显著降低(均P<0.05);siCtrl组和siCtrl+Erl组之间线粒体膜电位、线粒体和细胞质内细胞色素c变化、线粒体呼吸链复合物Ⅰ/Ⅱ/Ⅴ活性的差异均无的统计学意义(图7)。
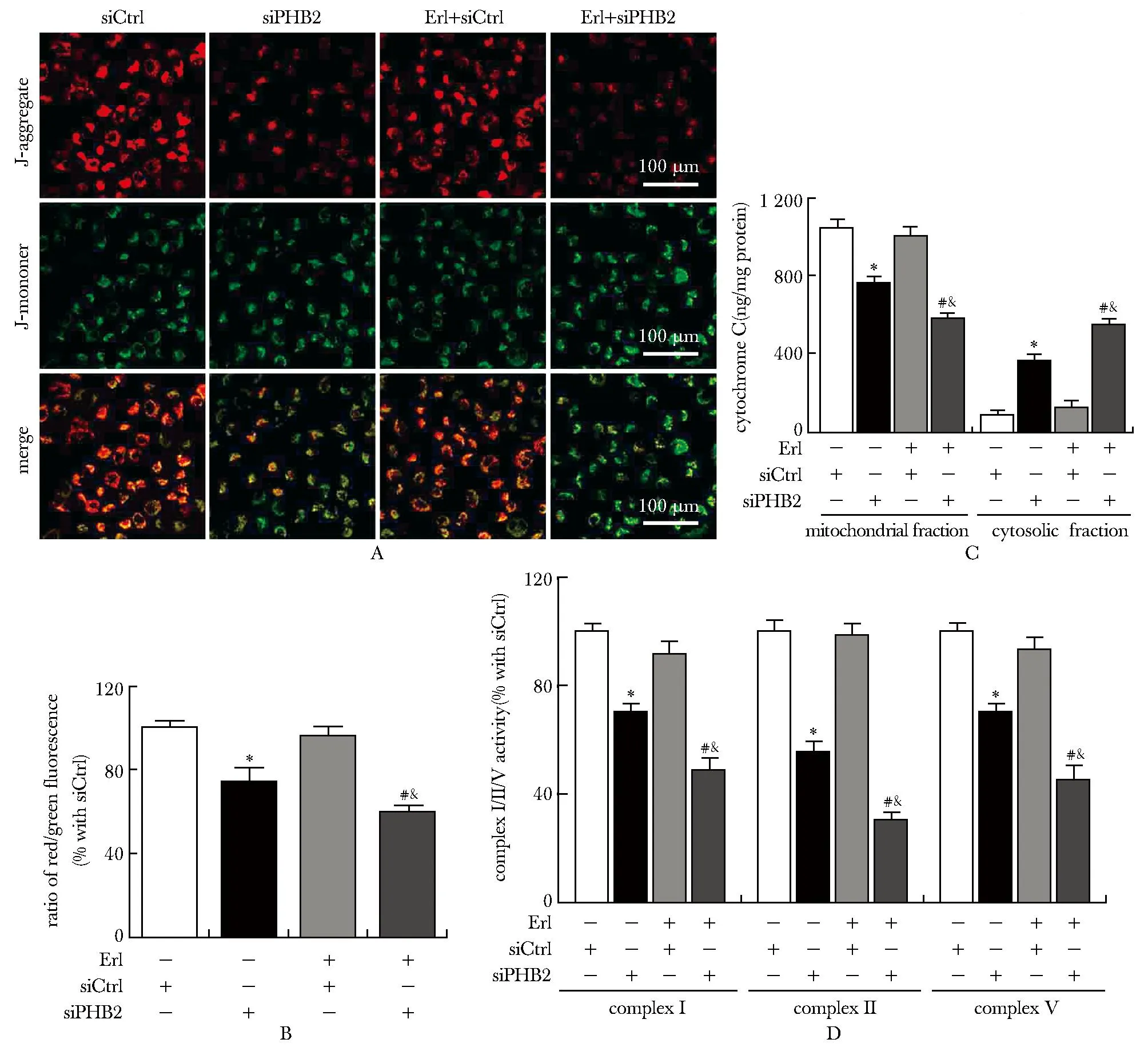
A, B.representative images of JC-1 staining in A549 cells and the ratio of aggregated and monomeric JC-1 from the respective groups.C.levels of cytochrome c in cytosolic and mitochondrial fractions from the respective groups.D.complexⅠ/Ⅱ/Ⅴ activities in isolated mitochondria; *P<0.05 compared with siCtrl group; #P<0.05 compared with siPHB2 group; &P<0.05 compared with siCtrl+Erl group.
3 讨论
越来越多的证据显示,PHB2作为一种重要的骨架蛋白,与肿瘤的增殖、凋亡、迁移和侵袭密切相关[9]。课题组前期研究[10]发现,PHB2表达与NSCLC肿瘤分化、淋巴结转移和临床分期具有相关性; PHB2可与RACK1结合并调控RACK1稳定性及表达,进而促进肿瘤进展。同时,敲低PHB2促进A549细胞凋亡[14]。本研究发现,敲低PHB2使得EdU染色阳性的增殖细胞数目显著减少,平板集落数目减少;敲低PHB2可诱导A549细胞凋亡和线粒体功能受损,线粒体途径的细胞凋亡也可能是抑制PHB2引发细胞活性下降的重要机制。
有研究显示,使用一代EGFR-TKI的同时,联用自噬抑制剂,对EGFR-TKI耐药的NSCLC细胞系具有很好协同杀伤作用[15]。研究显示,PHB2可以作为一种重要的线粒体膜受体参与LC3识别受损的线粒体的过程[11],而抑制PHB2介导的线粒体自噬能否改善对EGFR-TKI耐药尚不清楚。本研究发现,与NC组相比,Erl组PHB2和LC3Ⅱ蛋白表达显著增加,且LC3Ⅱ染色与线粒体染色共定位比率增加,表明厄洛替尼处理可能增加了PHB2介导的线粒体自噬水平。此外,采用siRNA敲低PHB2后发现,与siPHB2组和siCtrl+Erl组相比,siPHB2+Erl组细胞增殖能力显著降低,细胞凋亡显著增加,线粒体细胞线粒体活性显著降低,表明敲低PHB2可显著增强厄洛替尼抑制A549细胞增殖和促进线粒体途径细胞凋亡的能力。
综上所述,本研究发现敲低PHB2可改善A549细胞对厄洛替尼的敏感性,其机制可能与其抑制PHB2介导的线粒体自噬有关,为PHB2用于改善一代EGFR-TKI耐药提供了一定的实验依据。
