尿素包合法提纯亚麻籽油中α-亚麻酸工艺的优化研究*
2024-03-21郝文来
郝文来,郝 健
(深圳市诚致生物开发有限公司,广东 深圳 518000)
亚麻籽(linseed)是草本植物亚麻的种子,红棕色的果实外观并且具有独特的坚果风味[1,2]。亚麻籽的种植已有5000 多年的历史,广泛分布在世界各地,品质上等的亚麻籽一般生在寒带地区,例如加拿大的西北部等,在我国种植区域主要分布在甘肃、陕西、内蒙古、山西、黑龙江以及新疆等省份。亚麻籽的应用非常广泛,可以用于加工面包、酸奶或者谷物食品中,深受消费者喜爱。亚麻籽以其自身丰富的营养成分逐渐引起了世界众多学者的关注,关于它的研究也越来越深入。亚麻籽中含有约40%各类油脂、28%多种膳食纤维、20%蛋白质和氨基酸,剩余12%的水分和灰分[3,4]。大量的实验研究和临床表现证实了亚麻籽对于人体健康和各项机能提升大有裨益,尤其是对于孕妇、婴幼儿、“三高”人士。其主要的功效有降低血脂、减轻心脏负荷、促进大脑发育、改善便秘、改善肾功能等,亚麻籽油的功效更是被人称为“深海鱼油”[4-6]。
亚麻籽油中含有丰富的多不饱和脂肪酸、单不饱和脂肪酸以及包合脂肪酸,其中α-亚麻酸(ALA)的含量可以占到亚麻籽油的53%[7]。Ω-3 多不饱和脂肪酸以α-亚麻酸为母体,是组成人体细胞结构的重要成分,也是细胞进行正常新陈代谢必不可少的营养成分,是人体所必须的脂肪酸。亚麻籽油中的α-亚麻酸含量远高于其他的核桃油、花生油、大豆油等植物油,对于很多素食者而言,亚麻籽油成为了身体获取Ω-3 多不饱和脂肪酸的一个非常重要的途径[4,8]。
现阶段,对α-亚麻酸的分离方法有很多种,常见的主要有色谱柱法、分子蒸馏法以及尿素包合法等[3,9-11]。色谱柱法主要用于少量的样品分离和测试,对于大规模的放大生产实验非常局限。分子蒸馏法容易造成产品纯度不够,产品中杂质混合较多,大大影响产品品质。尿素包合法具有投资小、工艺简单的优势,非常适用于α-亚麻酸提纯[4,5,12,13]。本文就以尿素包合法对提纯亚麻籽油中的α-亚麻酸开展工艺研究。α-亚麻酸提取率最高可达81%。
1 实验部分
1.1 原料、试剂和仪器
亚麻籽油(一级 锡林郭勒盟红井源油脂有限责任公司),产品符合GB/T 8235-2019 涉及的特征指标、质量等级指标及污染物限量等。
α-亚麻酸标准品(99.50% 北京谱析标准技术有限公司);甲醇、乙酸,色谱纯,上海国药供应有限公司;石油醚(沸程60~90℃AR 东莞市大伟化工有限公司);无水乙醇、KOH、HCl 溶液、甲醇、无水Na2SO4、尿素,均为分析纯,郑州博邦化工产品有限公司。
1200 型高效液相色谱仪(匹配兼容安捷伦的索福达M100 蒸发光散射检测器 安捷伦);R-1005 型旋转蒸发仪(济南禾普仪器设备有限公司);MS204S型电子天平(梅特勒托利多);SHJ-A6 型恒温水浴锅(常州市亿能实验仪器厂);DHG-9070A 型电热鼓风干燥箱(上海一恒科学仪器有限公司);SHZ-95B 型循环水式真空泵配套抽滤漏斗等抽滤系统(上海予华仪器设备有限公司);锥形瓶、烧杯等玻璃陶瓷仪器(泰州市辰阳教学仪器有限公司)等。
1.2 实验方法
1.2.1 亚麻籽游离脂肪酸的制备 首先,制备浓度为1mol·L-1的KOH-乙醇溶液,然后将亚麻籽油与其按照1∶5 的体积比进行混合,在80℃的恒温水浴锅中回流45min,在冷却至室温的混合液中加入一定量的去离子水进行溶解,之后加入石油醚对其中不能皂化的部分萃取除去。取分层后的下层溶液,使用浓度为20%的HCl 溶液对其进行酸化处理,并将溶液pH 值调节至2~3,然后将石油醚缓慢加入溶液中,同时开始搅拌混匀,再将溶液移至分液漏斗,待其充分静置分层。分层后,将上层的有机相溶液从分液漏斗中倒出,对下层的溶剂继续使用石油醚连续萃取至少3 次,将多次萃取的有机相合并待用。用5%的NaCl 水溶液对有机相洗至中性,再加入无水Na2SO4脱除有机相中所含有的水分,在温度为55℃的条件下通过对滤液进行旋蒸,对其中的石油醚进行充分回收,最终从亚麻籽油中得到混合脂肪酸。
1.2.2 亚麻籽α-亚麻酸尿素包合方法 称量一定质量尿素和一定体积的乙醇,充分混合溶解,将一定浓度的尿素-乙醇溶液按照特定比例与已制备的亚麻籽油脂肪酸混合,置于60℃水浴锅中充分搅拌混合直至呈现透明状态。随后,在不同包合温度下设定不同时间进行包合反应。连接真空泵及抽滤设备,对混合液进行抽滤处理以分离出其中的尿素结晶包合物,并得到剩余滤液。将一定量的石油醚加入到剩余滤液中,并用10%的HCl 调节滤液的pH 值至2~3,加入一定量的去离子水,保证萃取充分,分层取出有机相,多次重复萃取过程,将得到的有机相合并。将合并的有机相用5% NaCl 多次清洗,直至pH 值呈中性,用一定量的无水Na2SO4脱除去有机相残留的水分,在温度为50℃的条件下,对有机相进行旋蒸,以获取高浓度的α-亚麻酸。。
1.2.3 单因素实验 依据1.2.2 中的提取方法,分别对尿素溶液与脂肪酸体积比、包合温度、包合时间、尿素溶液浓度等多组变量因素进行实验研究,分析每个变量因素对α-亚麻酸提纯率的影响。
1.3 α-亚麻酸含量测定
1.3.1 色谱条件
色谱柱及其参数 C18色谱柱填料,250mm×2.6mm,填充颗粒直径5μm。
流动相参数 甲醇∶1%乙酸溶液体积比为90∶10,流动速率为1mL·min-1;色谱柱温度为30℃;检测波长为205nm;进样量为20μL。
蒸发光散射检测仪参数 索福达M100,载气流速为2L·min-1,漂移管温为75℃。
1.3.2 α-亚麻酸标准曲线 精确称取10mg α-亚麻酸于10mL 容量瓶中,并用甲醇溶液定容到容量瓶刻度线,此时标准α-亚麻酸溶液浓度为1mg·mL-1。然后分别用移液枪移取0.1、0.2、0.4、0.6、0.8、1.0、2.0、3.0 mL 标准α-亚麻酸溶液于10mL 的容量瓶中,再用甲醇溶液定容至容量瓶刻度线,得到α-亚麻酸溶液浓度分别为0.01、0.002、0.04、0.06、0.08、0.1、0.2、0.3 mg·mL-1的标准溶液。将标准溶液进行液相色谱测定,用浓度和α-亚麻酸色谱图峰强度进行作图,通过Origin 9.1 进行拟合,拟合数据见表1和图1,拟合方程:Y=1.563X+330.658,相关系数R2=1,X 为标准α-亚麻酸溶液浓度,Y 为峰面积。
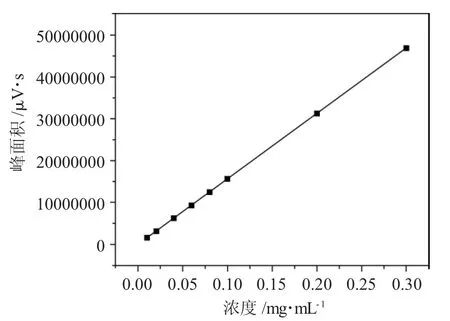
图1 标准α-亚麻酸溶液浓度和峰面积线性拟合Fig.1 Standards α-Linear fitting of concentration and peak area of α-linolenic acid solution

表1 标准α-亚麻酸溶液浓度和峰面积关系Tab.1 Relationship between concentration and peak area of standard α-linolenic acid solution
1.4 α-亚麻酸含量测定
使用梅特勒托利多分析天平准确称取待测样品0.1000g 加入到100mL 锥形瓶中,加入0.5mol·L-1的碱性甲醇溶液30mL,震荡均匀,将锥形瓶封存严密,在60℃水浴锅条件下对混合液充分震荡40min,保证其充分混合。将锥形瓶取出,静置冷却至室温,滴加一定量的HCl 溶液将pH 值调节至中性,将溶液整体转移至250mL 容量瓶中,用色谱纯度甲醇定容备用。移液管精确移取1.00mL 上述溶液至10mL 容量瓶并用色谱纯甲醇定容,用10mL 注射器吸取一定量的溶液,通过过滤膜后将液体打入进样瓶。在上述制定的色谱设备和参数条件下,对样品进行液相色谱测定和分析。
2 结果与讨论
2.1 单因素实验
2.2.1 混合脂肪酸与尿素溶液体积比对α-亚麻酸提取率的影响 采用尿素-乙醇浓度为0.9mol·L-1,包合温度为-20℃,包合时间20h,考察脂肪酸和尿素的体积比分别为1∶5、1∶25、1∶45、1∶65、1∶85 对提纯α-亚麻酸的影响,结果见图2。
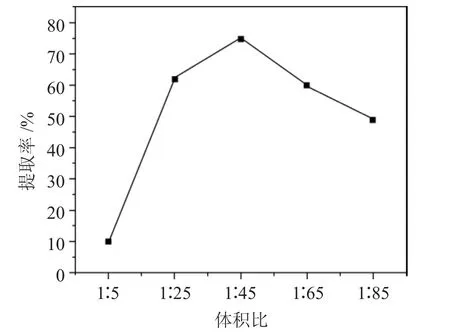
图2 脂肪酸与尿素溶液体积比对α-亚麻酸提取率的影响Fig.2 Effect of the volume of fatty acid to urea solution on the extraction rate of α-linolenic acid
由图2 可见,随着脂肪酸与尿素溶液的体积比增大,α-亚麻酸的提取率先增大后减小,脂肪酸和尿素的体积比1∶5、1∶25、1∶45、1∶65、1∶85 分别对应10%、62%、75%、60%、49%的提取率。当脂肪酸与尿素的体积比为1∶45 时,α-亚麻酸的的提取率最大,为75%。当脂肪酸与尿素体积比过小时,脂肪酸反应不完全,脂肪酸过量,α-亚麻酸提取率过低。当脂肪酸和尿素的体积比过大,尿素过量影响与脂肪酸的包埋效果,从而也会影响α-亚麻酸的提取率。因此,综合考虑,确定最佳的脂肪酸和尿素溶液体积比为1∶45。
2.2.2 尿素-乙醇溶液浓度对α-亚麻酸提取率的影响 采用脂肪酸和尿素溶液体积比为1∶45,包合温度为-20℃,包合时间20h,考察尿素-乙醇溶液浓度分别为0.2、0.4、0.6、0.8、1.0、1.2、1.4mol·L-1对α-亚麻酸提取率的影响,结果见图3。
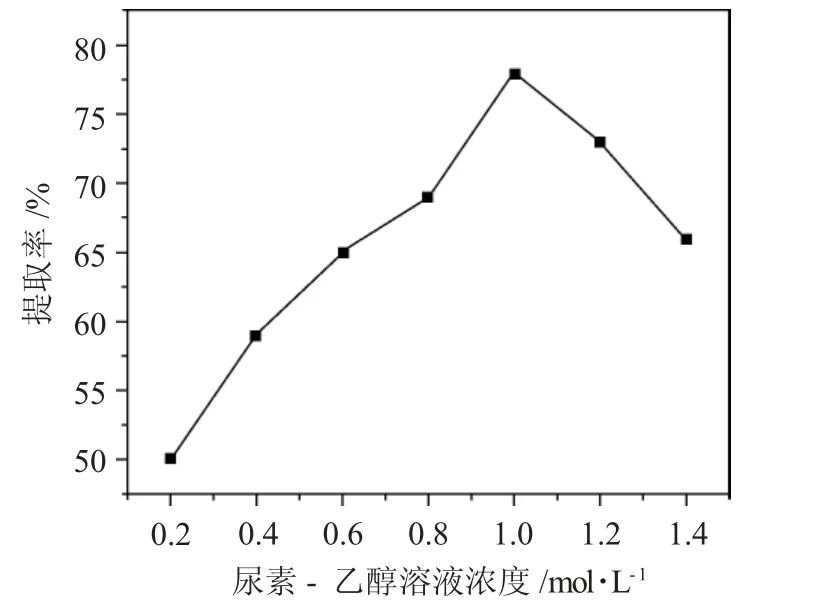
图3 不同尿素-乙醇溶液浓度对α-亚麻酸提取率的影响Fig.3 Effect of different urea ethanol solution concentrations on the extraction rate of α-linolenic acid
由图3 可见,随着尿素-乙醇溶液浓度增大,α-亚麻酸提取率先增大后减小,尿素-乙醇溶液浓度为0.2、0.4、0.6、0.8、1.0、1.2、1.4mol·L-1,α-亚麻酸的提取率分别为50%、59%、65%、69%、78%、73%、66%,当尿素-乙醇溶液浓度为1.0mol·L-1时,α-亚麻酸提取率最大,为78%。当尿素-乙醇溶液浓度较低时,尿素含量较少,尿素的溶解性好,因此,随着尿素-乙醇溶液浓度增大,α-亚麻酸提取率增大,当尿素-乙醇溶液超过1mol·L-1后,溶液几乎呈现饱和状态,当尿素-乙醇浓度继续增加,尿素溶解率下降,从而影响包合效果,造成α-亚麻酸提取率下降。因此,综合考虑,确定最佳尿素-乙醇溶液浓度为1.0mol·L-1。
2.2.3 包合温度对α-亚麻酸提取率的影响 采用脂肪酸和尿素溶液体积比为1∶45,包合时间20h,尿素-乙醇溶液浓度为1mol·L-1,考察包合温度-25、-15、-5、10、15、20、35℃对提纯α-亚麻酸的影响,结果见图4。
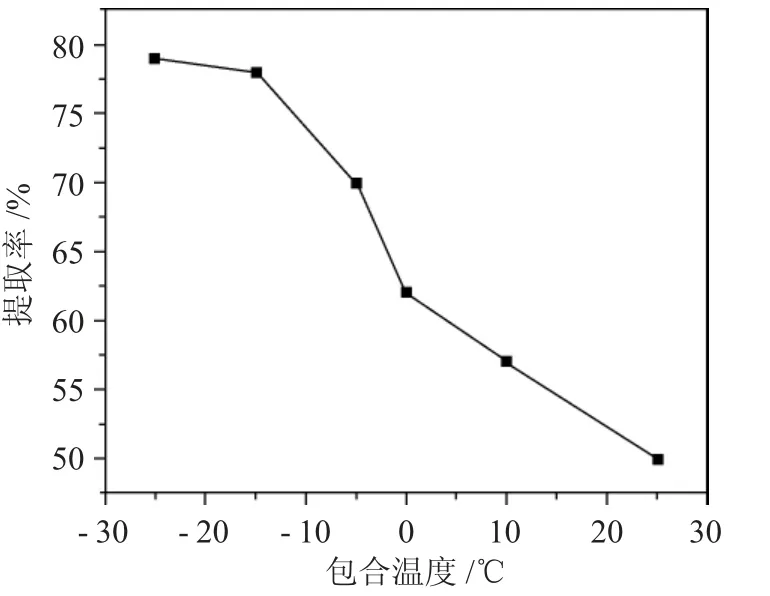
图4 不同包合温度对α-亚麻酸提取率的影响Fig.4 Effect of different inclusion temperatures on the extraction rate of α-linolenic acid
由图4 可见,随着包合温度的增加,α-亚麻酸提取率下降,包合温度-25、-15、-5、10、15、20、35℃分别对应α-亚麻酸提取率为79%、78%、70%、62%、57%、50%。当温度超过-15℃后,α-亚麻酸提取率迅速下降,温度为25℃时,α-亚麻酸提取率仅为50%。可以看出温度越低越有利于尿素的包合,但温度过低,一方面能耗增加,另一方面实验室常用的冰箱冷藏温度仅为-20℃,因此,综合考虑,确定最佳包合温度为-15℃。
2.2.4 包合时间对α-亚麻酸提取率的影响 采用脂肪酸和尿素体积比为1∶45,包合温度-15℃,尿素-乙醇溶液浓度为1mol·L-1。考察包合时间12、18、24、30、36、42、48、54、60、66、72h 对提纯α-亚麻酸的影响,结果见图5。
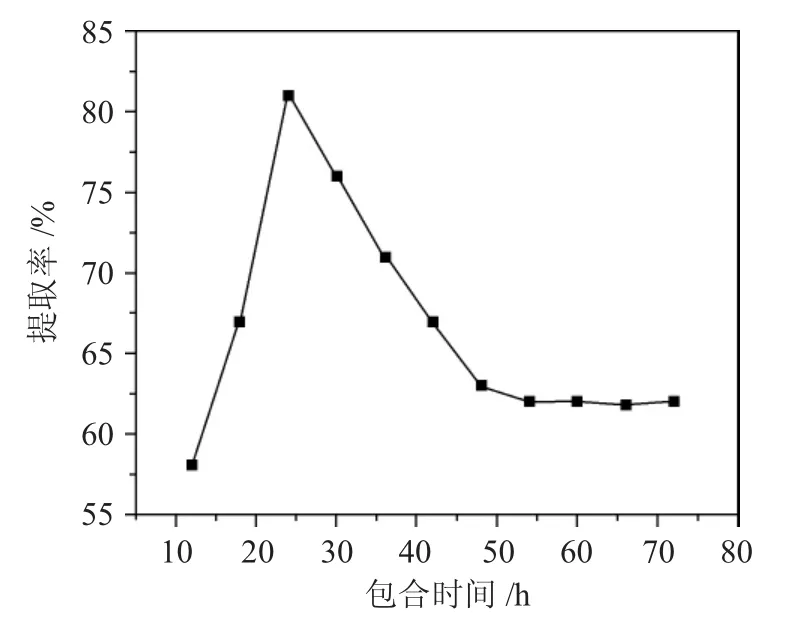
图5 不同包合时间对α-亚麻酸提取率的影响Fig.5 Effect of different inclusion time on the extraction rate of α-linolenic acid
由图5 可见,随着包合时间的增加,α-亚麻酸提取率先增大后减小,包合时间12、18、24、30、36、42、48、54、60、66、72 h 对应的α-亚麻酸提取率为58%、67%、81%、76%、71%、67%、63%、62%、62%、61.8%、62%。当包合时间为24 h 时,α-亚麻酸提取率最大,为81%。当包合时间超过24h 后,α-亚麻酸提取率下降,但当时间超过48h 后,α-亚麻酸提取率维持不变。因此,综合考虑,确定最佳包合时间为24h。
2.3 α-亚麻酸液相色谱图分析
以脂肪酸和尿素溶液体积比为1∶45、包合温度为-15℃、包和时间24h、尿素-乙醇溶液浓度为1mol·L-1对亚麻酸进行提纯。α-亚麻酸的液相色谱图见图6。
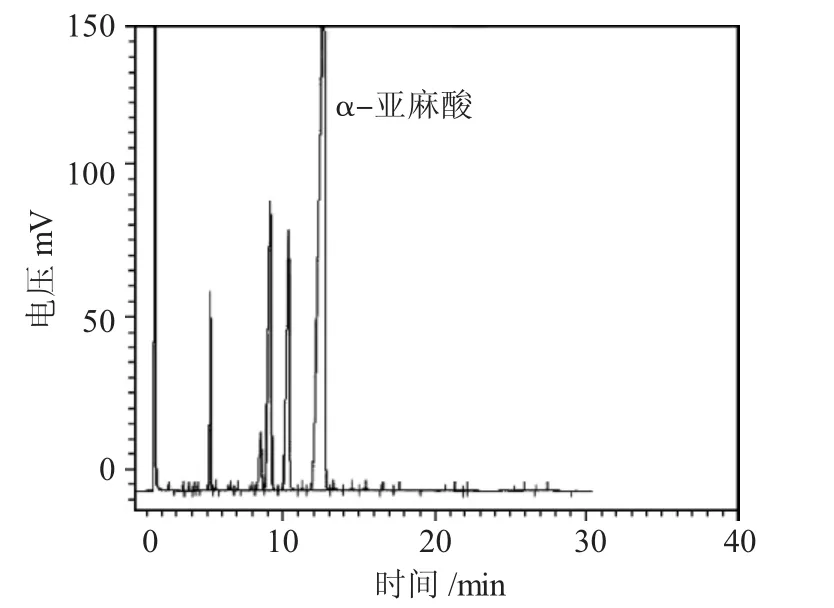
图6 α-亚麻酸的液相色谱图Fig.6 Liquid chromatography of α-linolenic acid
α-亚麻酸在12.5min 出峰,符合α-亚麻酸的出峰位置。
3 结论
(1)以亚麻籽油为原料,α-亚麻酸为提取目标产物,采用单因素法研究了不同脂肪酸与尿素溶液体积比、尿素-乙醇溶液浓度、包合温度、包合时间对α-亚麻酸提取率的影响,优化了α-亚麻酸提取工艺,并采用液相色谱对提纯的α-亚麻酸进行了表征。
(2)实验结果表明,最佳实验条件下,浓度为1mol·L-1的尿素-乙醇溶液、脂肪酸与尿素溶液的体积比为1∶45、包合温度为-15℃、包合时间为24h 时,α-亚麻酸提取率最高可达81%。
(3)通过液相色谱对提纯的α-亚麻酸进行表征,α-亚麻酸在12.5min 出峰,符合α-亚麻酸的出峰位置。
