香叶木素调控Hedgehog信号通路对骨质疏松性骨缺损的影响
2024-03-19蔡丹宇王攀峰周文彬
蔡丹宇 王攀峰 周文彬
1.苏州市中西医结合医院骨科,江苏 苏州 215000
2.上海长海医院创伤骨科,上海 200433
3.苏州市中西医结合医院骨二科,江苏 苏州 215000
骨质疏松(osteoporosis,OP)是一种伴随骨量减少、骨密度(bone mineral density,BMD)和骨微结构破坏的代谢性骨病,多发于绝经后妇女及中老年人群[1]。OP具有较高的发病率及死亡率,患者易出现骨缺损,但目前能够有效治疗骨质疏松性骨缺损的药物较少,因此寻找有效治疗骨质疏松性骨缺损的药物十分必要[2-3]。来自于柑橘类水果的香叶木素是一种天然黄酮类化合物,具有抗炎、抗菌等多种药理活性,近年来有研究发现,香叶木素能有效促进人成骨细胞分化及成熟,而且能够抑制OP大鼠破骨细胞生成及骨丢失[4]。骨愈合过程受多种信号通路调控,Hedgehog信号通路在骨形成中具有关键作用,其激活有助于骨骼发育及骨稳态[5-6]。Hedgehog信号通路在OP小鼠成骨细胞中被显著抑制,其激活能有效抑制成骨细胞凋亡,促进细胞活力及钙结节增加[7]。但目前关于香叶木素是否可通过调节Hedgehog通路来影响骨质疏松性骨缺损还鲜有报道,因此,本研究旨在探究香叶木素调控Hedgehog信号通路对骨质疏松性骨缺损愈合的影响。
1 材料与方法
1.1 实验动物
将从三峡大学购买的SPF级SD大鼠(222~255 g,50 只)于相对湿度55%,12 h明暗交替的动物房饲养一周,许可证:SCXK(鄂)2017-0012,实验前禁食12 h。本研究已经通过苏州市中西医结合医院动物伦理委员会审核批准(批号:2021-005192)。
1.2 主要试剂
香叶木素【货号:HP00034A,海蔻希(杭州)生命科学研究有限公司】;环杷明(货号:dasf-5153,南京道斯夫生物科技有限公司);苏木精-伊红(hematoxylin-eosin,HE)染色试剂盒(货号:YX-DK00686,浙江羽翔生物科技有限公司);蛋白提取试剂盒、反转录试剂盒(货号:EX6120-50 T、RE0510-100 T,定州百克赛斯生物科技有限公司);二喹啉甲酸蛋白检测(Bicinchoninic Acid Assay,BCA)蛋白检测试剂盒(货号:CS-R99145,上海莼试生物技术有限公司);实时定量PCR(quantitative Real-Time PCR,qRT-PCR)试剂盒(货号:CD-13506-ML,武汉纯度生物科技有限公司)。兔抗音猬因子(Sonic hedgehog,Shh)、β-actin、跨膜蛋白受体1(Ptched 1,Ptch 1)、Gli家族锌指蛋白-1(Gli family zinc finger-1,GLI1)、标记的山羊抗兔IgG二抗抗体(货号:2207、4970、2468、2534、5348,Cell Signaling Technology);兔抗成骨细胞特异性转录因子(Osterix)、Runt相关转录因子2(Runt Related Transcription Factor 2,Runx2)抗体(货号:ab22552、ab23981,Abcam);Azure Biosystems C150凝胶成像系统、普迈小动物双能X射线骨密度仪、普迈ASA-4800实时荧光定量PCR仪购自普迈精医科技(北京)有限公司。
1.3 分组与模型构建
将50只SD大鼠(按10 只/组)分为假手术组、模型组、低剂量组(50 mg/kg香叶木素)、高剂量组(100 mg/kg香叶木素)[4]及高剂量+环杷明组(100 mg/kg香叶木素+10 mg/kg Hedgehog信号通路特异性抑制剂环杷明)[8]。骨质疏松性骨缺损模型构建:使用10%水合氯醛腹腔注射麻醉大鼠,于无菌环境中切开皮肤,分离并结扎输卵管及其周围血管,摘除卵巢,构建OP大鼠模型,缝合后肌肉注射青霉素2.5×104U/d用于预防感染;术后8周进行X射线观察造模情况,见图1。以此模型为基础进行骨缺损模型构建,水合氯醛(10%)腹腔注射麻醉大鼠,暴露其近膝关节处肌肉组织,钝性分离后暴露股骨干骺端,使用慢速直流电钻由外向内钻一贯通性骨缺损区域(直径约为2 mm),缝合后再次注射青霉素2.5×104U/d用于预防感染,假手术组仅切除卵巢旁部分脂肪[3];造模结束后,低剂量组、高剂量组及高剂量+环杷明组灌胃对应剂量香叶木素及环杷明,而模型组、假手术组以等体积生理盐水灌胃,灌胃时间为期6周,1次/d。

图1 去卵巢骨质疏松模型造模前后X线对比Fig.1 Comparison of X-rays before and after the establishment of ovariectomized osteoporosis model
1.4 大鼠骨痂部位BMD检测
给药结束后,使用水合氯醛腹腔注射麻醉大鼠,双能X线吸收扫描仪以骨骼结痂为中心区域进行扫测,分析大鼠骨痂BMD值(n=10)。
1.5 HE染色观察大鼠骨缺损区域病理学情况
取5只大鼠骨缺损处上下0.5 cm区域骨组织,浸泡于多聚甲醛(10%)固定,EDTA-Na缓冲液脱钙处理,制作石蜡切片(4 μm),一部分经脱蜡、水化、苏木精-伊红染色、乙醇脱水、中性树脂封片、观察(n=5),并进行Lane-Sandhu组织学评分[9];另一部分用于抗酒石酸酸性磷酸酶(TRAP)染色。
1.6 TRAP染色观察大鼠骨缺损区域破骨细胞情况
取石蜡切片进行TRAP染色(37 ℃、1 h),经苏木素复染后使用自来水反蓝,于光镜下观察染色情况(400×),紫红色区域即为破骨细胞阳性染色(n=5)。
1.7 qRT-PCR检测大鼠骨缺损区域组织Osterix和Runx2表达
取其余5只大鼠骨缺损区域组织,于液氮中研磨至粉末状,一部分使用Trizol提取组织总RNA,将其反转录成cDNA,以其为模板进行qRT-PCR,GAPDH为内参(n=5),通过2-ΔΔCt计算Osterix和Runx2表达,引物见表1;另一部分用于蛋白免疫印迹实验(Western blot)。

表1 qRT-PCR引物Table 1 qRT PCR primers
1.8 Western blot检测骨缺损区域组织SHH、GLI1、Ptch1、Osterix和Runx2表达水平
使用裂解液裂解组织提取总蛋白,经电泳、低温转膜、牛血清白蛋白封闭后,添加兔抗SHH、GLI1、Ptch1、Osterix、Runx2、β-actin一抗,孵育过夜并进行PBS清洗,加入二抗(HRP标记的山羊抗兔IgG)孵育,滴加1 mL发光试剂显色,通过蛋白凝胶成像仪观察并拍照,测定灰度值并分析各蛋白相对表达水平(n=5)。
1.9 统计学分析

2 结果
2.1 香叶木素对大鼠骨痂部位BMD的影响
模型组BMD较假手术组显著降低(P<0.05);与模型组比较,低剂量组、高剂量组骨痂部位BMD依次显著增加(P<0.05);与高剂量组比较,高剂量+环杷明组骨痂部位BMD显著降低(P<0.05),见表2、图2。

表2 香叶木素对大鼠骨痂部位BMD的影响
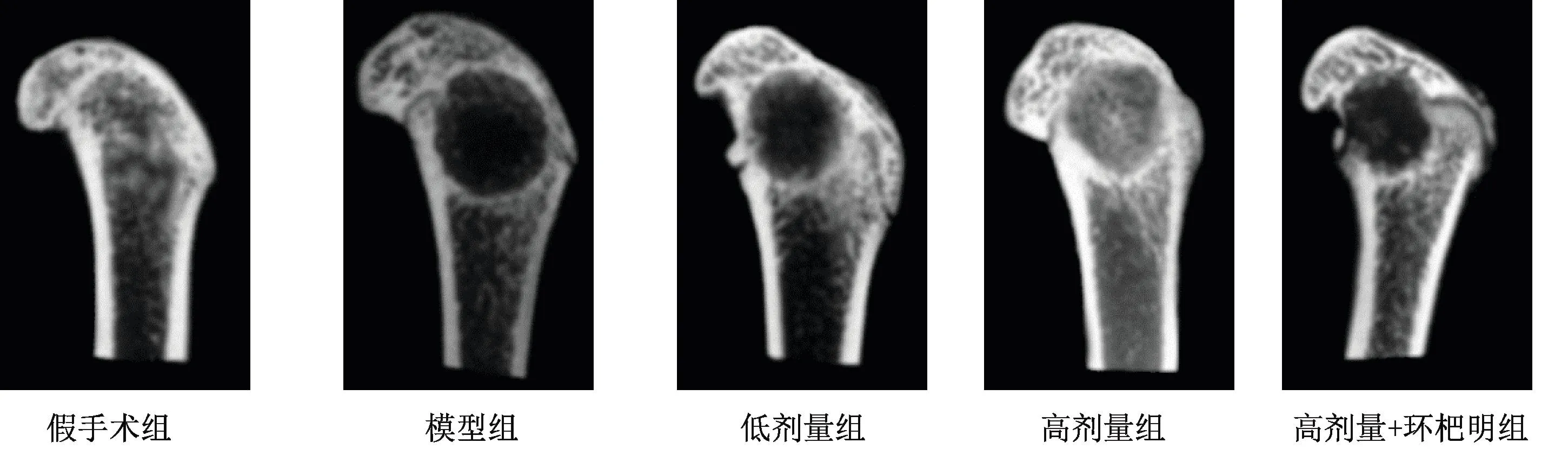
图2 各组大鼠X射线比较Fig.2 Comparison of X-ray images among rat groups
2.2 香叶木素对大鼠骨缺损区域病理学的影响
假手术组大鼠股骨存在大量骨小梁紧密、规则排列,相互交织成网状结构;模型组骨缺损区域骨小梁大量断裂、数量减少、稀疏排列、骨髓腔明显增大,且Lane-Sandhu组织学评分较假手术组显著降低(P<0.05);与模型组比,低剂量组、高剂量组骨缺损区域骨小梁数量明显增加,排列较为紧密、骨髓腔明显减小,Lane-Sandhu组织学评分依次显著增加(P<0.05);与高剂量组比,高剂量+环杷明组骨小梁数量减少,出现断裂,骨髓腔增大,且Lane-Sandhu组织学评分显著降低(P<0.05),见图3、表3。

表3 各组大鼠Lane-Sandhu组织学评分
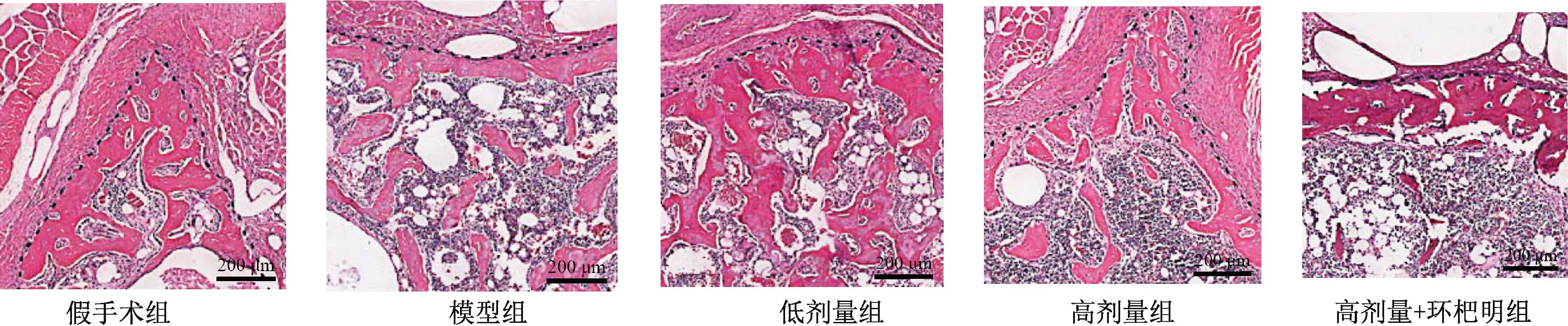
图3 香叶木素对大鼠骨缺损区域病理学的影响(HE,比例尺:200 μm)Fig.3 Effect of diosmetin on the pathology of bone defect areas in rats (HE, Scale: 200 μm)
2.3 香叶木素对大鼠骨缺损区域破骨细胞的影响
模型组TRAP阳性细胞数较假手术组显著增加(P<0.05);与模型组比较,低剂量组、高剂量组TRAP阳性细胞数依次显著降低(P<0.05);与高剂量组比较,高剂量+环杷明组TRAP阳性细胞数显著增加(P<0.05),见图4、表4。
表4 各组大鼠TRAP阳性细胞数个/mm2)

图4 香叶木素对大鼠骨缺损区域破骨细胞的影响(TRAP染色,比例尺:50 μm)Fig.4 Effect of diosmetin on osteoclasts in bone defect areas of rats (TRAP staining, Scale: 50 μm)
2.4 香叶木素对大鼠骨缺损区域组织Runx2、Osterix表达的影响
模型组骨缺损区域组织Osterix和Runx2 mRNA表达较假手术组显著降低(P<0.05);与模型组比较,低剂量组、高剂量组Osterix和Runx2 mRNA表达依次显著增加(P<0.05);与高剂量组比较,高剂量+环杷明组Osterix和Runx2 mRNA表达显著降低(P<0.05),见表5。

表5 香叶木素对大鼠骨缺损区域组织Osterix和Runx2表达的影响
2.5 香叶木素对大鼠骨缺损区域组织SHH、GLI1、Ptch1表达的影响
模型组骨缺损区域组织SHH、GLI1、Ptch1、Osterix和Runx2表达较假手术组显著降低(P<0.05);与模型组比较,低剂量组、高剂量组SHH、GLI1、Ptch1、Osterix和Runx2表达依次显著增加(P<0.05);与高剂量组比较,高剂量+环杷明组SHH、GLI1、Ptch1、Osterix和Runx2表达显著降低(P<0.05),见表6、图5。

表6 香叶木素对大鼠骨缺损区域组织SHH、GLI1、Ptch1表达的影响Table 6 Effect of diosmetin on the expressions of SHH, GLI1, and Ptch1 in the tissue of rat bone

图5 香叶木素对大鼠骨缺损区域组织SHH、GLI1、Ptch1表达的影响Fig.5 Effect of diosmetin on the expressions of SHH, GLI1, and Ptch1 in the tissue of rat bone defects
3 讨论
OP主要由破骨细胞分化增加及成骨细胞分化减弱造成,OP患者常伴随有病理性骨缺损发生,但由于OP患者破骨细胞活性高于成骨细胞,因此其自身修复能力不佳,常需要临床药物干预,但目前用于治疗骨质疏松性骨缺损的药物十分有限,因此,寻找新的治疗药物对OP患者骨缺损愈合极其重要[10-13]。
黄酮类化合物已被证明具有诱导成骨细胞分化等多种生物学功能,香叶木素作为一种天然黄酮类化合物能够有效抑制破骨细胞活性,促进成骨细胞分化,其可能是治疗OP的潜在药物[4]。香叶木素能够刺激股骨截骨术大鼠骨痂再生,增加股骨强度,促进骨形成,抑制去卵巢骨质疏松大鼠骨吸收[14]。香叶木素可通过抑制瞬时受体电位通道香草醛亚型-1表达缓解骨质疏松大鼠骨组织病理学损伤及骨质流失[4]。Runx2表达于成骨细胞中,是成骨细胞分化及骨形成所必需的关键转录因子,Osterix是成骨细胞特异性转录因子[9,15]。TRAP则是破骨细胞分化和形成的标志基因,其增加可增强破骨细胞活性[16]。本研究发现,香叶木素能够显著增加OP大鼠骨痂部位BMD、骨小梁数、Osterix、Runx2表达,降低TRAP阳性细胞数,该结果表明香叶木素能够通过促进Osterix、Runx2表达,抑制TRAP表达来促进骨缺损区域成骨细胞分化及骨形成,抑制破骨细胞活性,其有成为骨质疏松性骨缺损治疗药物的可能。
Hedgehog蛋白作为一个高度保守的分泌糖蛋白家族,在成骨细胞分化及胚胎发育进程软骨内骨形成中具有重要作用,参与维持骨稳态,在骨折愈合过程中被显著激活[6,17]。SHH是Hedgehog通路同源蛋白之一,GLI1作为SHH的下游因子,与其共同参与骨折愈合区的成骨细胞分化,而Ptch作为该通路的跨膜激活蛋白,是激活该通路所必须的膜上受体[6,18]。Hedgehog信号通路可通过抑制c-Jun氨基末端激酶/c-Fos-活化T-细胞核因子1级联反应来抑制破骨细胞分化及活性[19]。miR-152可通过激活OP大鼠骨组织Hedgehog信号通路来增加骨生物力学强度及促进骨重建[20]。金乌健骨胶囊可通过激活Shh信号通路促进成骨相关因子Osterix、Runx2表达,从而促进成骨[21]。本研究发现,OP大鼠骨缺损区域组织SHH、GLI1、Ptch1表达显著减少,而香叶木素则可促进OP大鼠骨缺损区域组织SHH、GLI1、Ptch1表达,该结果表明,OP大鼠Hedgehog信号通路受到抑制,而香叶木素能够有效激活OP大鼠Hedgehog信号通路。环杷明可抑制骨髓间充质干细胞成骨分化标志物的表达,辛伐他汀可通过激活Hedgehog信号通路刺激骨髓间充质干细胞成骨分化,而环杷明作为Hedgehog通路抑制剂则能够逆转该过程[22]。而本研究发现,环杷明可逆转香叶木素对OP大鼠骨缺损区域成骨细胞分化及骨形成的促进以及破骨细胞活性的抑制,从而抑制骨缺损愈合,该结果表明,香叶木素对OP大鼠骨缺损愈合的促进作用可能与其激活Hedgehog通路有关。
综上所述,香叶木素对骨质疏松性骨缺损愈合的促进作用可能与激活Hedgehog通路有关,本研究不仅为骨质疏松性骨缺损治疗药物的寻找提供线索,还为其治疗机制的研究提供帮助。但由于实验模型样本量的限制,未对其下游机制进行探究,因此,在以后的研究中会继续加大样本量以完善研究。
