骨质疏松分子生物学研究专家共识
2024-03-19中国骨质疏松杂志中国骨质疏松杂志骨代谢专家组
《中国骨质疏松杂志》社 《中国骨质疏松杂志》骨代谢专家组
骨质疏松是多因素、多基因疾病,是遗传和环境因素交互作用的结果,利用全基因组关联分析(genome-wide association study,GWAS)已鉴定出了近600个基因座位与骨密度、骨质疏松症和骨折相关[1],大约可以解释人类20%的骨密度差异[2]。通过GWAS发现的具有已知功能的易感基因,主要分布在4条骨代谢生物学通路上[3],分别是WNT 信号通路(LRP5、SOST、WNT10B、WNT16、SFRP1、FOXC2、LRP4、GPR177和CTNNB1)、RANK信号通路(RANKL、RANK和OPG)、维生素D信号通路(VDR和DBP)和雌激素信号通路(ESR1、ESR2和CYP19A1)。
已知的骨质疏松相关蛋白通过直接或间接的方式参与调控骨代谢全过程,其作用重叠相互联系,互为结果。
目前,骨质疏松分子生物学信号通路、骨质疏松易感基因、骨质疏松相关蛋白、骨质疏松分子治疗靶点等相关研究得到本领域认同。详见表1~3。

表1 骨质疏松分子生物学信号通路Table 1 Molecular biological signal pathways of osteoporosis
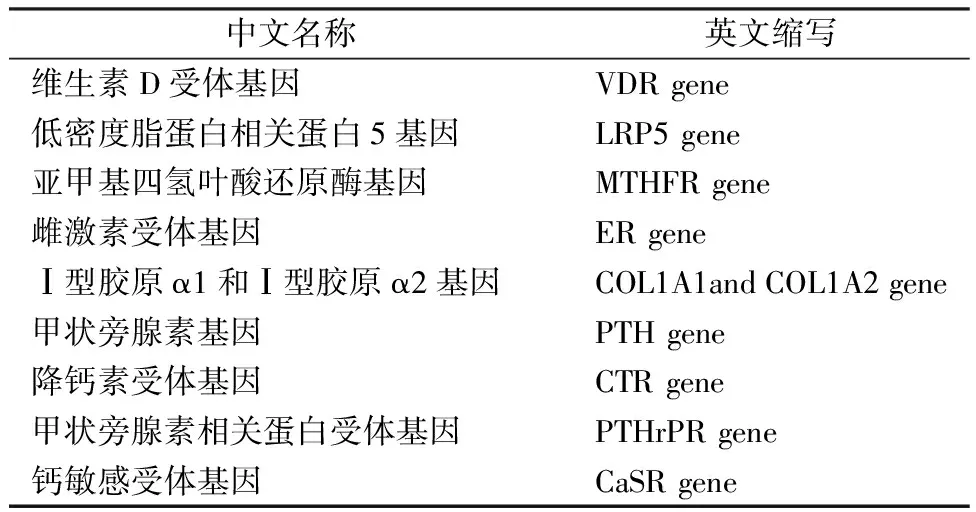
表2 骨质疏松易感基因Table 2 Osteoporosis susceptibility genes

表3 骨质疏松相关蛋白Table 3 Osteoporosis related proteins
1 骨质疏松分子生物学通路
骨质疏松分子生物学通路归纳为调节破骨细胞的信号通路和调控成骨细胞的信号通路。
1.1 调节破骨细胞的信号通路
1.1.1RANK/RANKL/OPG信号通路:RANK/RANKL/OPG信号通路是调控破骨细胞的主要信号通路,RANK是RANKL的信号受体,属于肿瘤坏死因子受体(TNFR)超家族分子的一种I型跨膜蛋白,可促进一些特异基因的表达,有利于促进破骨细胞分化、成熟,增加破骨细胞存活时间,激活破骨细胞骨吸收能力[4]。
1.1.2NF-κB信号通路:在破骨细胞分化过程中RANK-RANKL信号传递到下游通路,主要通过IKKβ及经典的NF-κB信号通路。NF-κB p50和p52蛋白共同表达,促进破骨细胞生成,增强破骨细胞活性。NF-κB上调RANKL和其他破骨细胞因子诱导的RANK表达,促进破骨细胞前体分化为TRAP+破骨细胞[5]。
1.1.3MAPK/ERK信号通路:MAPK属于苏氨酸/丝氨酸蛋白激酶家族,由胞外信号调节激酶(Erk1/2)、p38-MAPKs (α/β/γ/δ)、c-Jun N 末端激酶(JNK1、2、3)等组成。p38-MAPKs的激活在RANKL诱导破骨细胞前体细胞向破骨细胞分化的过程中起到了重要作用[6]。ERK激活是成熟破骨细胞存活的核心,在骨稳态中起重要作用。
1.1.4M-CSF信号通路:M-CSF通过与巨噬细胞集落刺激因子受体(c-fms)结合,诱导受体胞质端的7个酪氨酸残基进行磷酸化,在M-CSF诱导吞噬细胞和破骨细胞运动中,PI3K发挥非常重要作用[4]。M-CSF能激活PI3K影响破骨细胞存活,也能调节破骨细胞肌动蛋白重塑,导致抑制膜皱褶、肌动蛋白环以及骨陷窝的形成。
1.1.5Ca2+信号通路:破骨细胞中的Ca2+信号是细胞分化、骨吸收和基因转录等多种细胞功能所必需的[4]。长时间低水平的Ca2+信号能激活活化T细胞核因子(NFAT),促进破骨细胞形成。骨保护素可通过Ca2+信号抑制破骨细胞分化。
1.1.6Src、Akt信号通路:编码非受体酪氨酸激酶(Src)基因的缺失使成熟破骨细胞活动性降低,皱褶边缘及骨吸收的相关细胞骨架异常,不能有效发挥骨吸收功能。蛋白激酶B(Akt)信号调节破骨细胞的融合。Akt通过降低ras同系物家族成员A(RhoA)活性,增强Akt/GSK3β/NFATc1信号传导,促进破骨细胞生成,增强骨吸收[7]。
1.1.7PKC信号通路:蛋白激酶C(PKC)通路是破骨细胞重要的抑制性第二信使。PKC通过M-CSF和RANKL信号通路,影响破骨细胞的形成和功能。PKC促进破骨细胞消融,导致破骨细胞数量和表面积的减少。
1.1.8Ig-like受体信号通路:Ig-like受体在破骨细胞分化中起重要作用。细胞表面免疫受体酪氨酸抑制基序列(ITIM)含有Ig样受体调控破骨细胞形成,抑制性Ig样受体招募Src同源2结构域的酪氨酸磷酸酶1(SHP-1)在破骨细胞前体细胞上表达。
1.2 调控成骨细胞的信号通路
1.2.1Wnt/β-catenin信号通路:Wnt/β-catenin蛋白由19个分泌糖蛋白组成,具有调控细胞生长、分化和凋亡的功能。激活的Wnt/β-catenin通过干细胞更新、诱导成骨细胞生成、抑制成骨细胞凋亡,促进骨形成,在骨稳态和骨修复中起重要作用[8-9]。
1.2.2Hedgehog信号通路:Hedgehog是一种高度保守的分泌性糖蛋白,与BMP协同作用影响间充质干细胞分化成骨细胞,调节Ⅰ型胶原和碱性磷酸酶含量,促进成骨细胞外基质形成与骨基质矿化。负责调节胚胎发育、细胞增殖分化以及维持组织稳态[10]。
1.2.3BMP-2/Smad信号通路:骨形态发生蛋白(BMP)是成骨细胞分化的关键蛋白,其中BMP-2又是最有效的细胞因子之一,并能诱导骨形成。BMP-2/Smad信号通路可促进骨髓间充质干细胞(BMSC)分化成骨细胞,增加骨桥蛋白(OPN)表达,促进细胞外基质成熟与矿化,促进骨形成[10]。
1.2.4PI3K/Akt信号通路:PI3K/Akt信号通路由一系列膜受体和生长因子激活,可促进成骨细胞分化,是许多系统中调节骨再生过程的关键信号通路。PI3K/Akt信号通路可促进成骨前体细胞向成骨细胞分化,通过转录因子Runx2促进成骨细胞分化、增殖与矿化,协同BMP维持BMP-2/Smad信号通路活性,促进骨形成。
2 骨质疏松易感基因
2.1 VDR受体基因
维生素D受体(vitamin D receptor,VDR)主要在成骨细胞(osteoblast,OB)、破骨细胞(osteoclast,OC)、肠道、甲状旁腺以及肾脏的细胞表面上表达,在细胞分化和调控不同细胞类别的增殖中起关键作用[11]。位于OB上的VDR能够增加骨钙素、骨桥蛋白的生成,使OB分泌细胞因子,参与骨组织形成和骨组织矿化[12];位于OC上的VDR能够抑制OC增殖且促进OB分化,加速钙、磷的释放。
VDR基因多态性可干扰mRNA表达和剪接,影响mRNA的数量及稳定性,从而引起VDR蛋白水平和功能的微小差异,进一步通过VDR蛋白与其靶基因间的作用调节骨代谢[13]。
2.2 LRP5基因
低密度脂蛋白受体相关蛋白5(LRP5)基因作为共受体参与WNT经典信号通路调节骨代谢[14]。LRP5基因单核苷酸的突变与骨质疏松及2型糖尿病的发生和发展有关,其机制可能是突变影响其与配体结合,改变受体信号传导系统,从而影响疾病发生发展[15]。
2.3 MTHFR基因
亚甲基四氢叶酸还原酶(MTHFR)基因是影响骨质疏松及骨质疏松性骨折发病的重要候选基因之一,是叶酸代谢通路上参与DNA正常合成和甲基化的一种黄素依赖蛋白。MTHFR基因的2个多态性位点与绝经后妇女骨质疏松发病风险相关[16]。
2.4 ER基因
雌激素(E)主要通过与成骨细胞和破骨细胞的雌激素核内特异性受体结合,发挥生物学作用。
雌激素受体(ER)基因突变对雌激素生理作用有巨大影响,当编码ER的基因变异时,其蛋白分子构象改变,影响雌激素对骨代谢的调节[13]。
成骨细胞和破骨细胞均存在ER。雌激素与成骨细胞内的受体结合,促进胶原酶与细胞因子、生长因子分泌,调节骨代谢。雌激素作用于破骨细胞的ER,抑制破骨细胞溶酶体酶活性,抑制骨吸收。
2.5 COL1A1和COL1A2基因
Ⅰ型胶原α1(COL1A1)基因突变可致低骨量、骨脆性增加,COL1A1基因多态性与BMD降低、骨质疏松有关,同时COL1A1 SP1是骨折独立的危险因子[13]。
COL1A1多态性可作为骨质疏松与骨折风险的预测指标。Ⅰ型胶原α2(COL1A2)基因与全身性硬皮病、成骨不全等疾病有关。
2.6 PTH基因
持续大剂量甲状旁腺素(PTH)通过RANKL-OPG-RANK受体信号通路,上调破骨细胞RANKL的表达,诱导成熟的破骨细胞形成,加快骨吸收;间歇性小剂量,PTH的氨基末端区域与PTH R1结合,通过与G蛋白和腺苷酸环化酶相互作用,产生cAMP,进一步激活成骨细胞,促进骨形成[17]。
2.7 PTHrP受体基因
甲状旁腺素相关蛋白(PTHrP)受体基因刺激腺苷酸环化酶,抑制碱性磷酸酶及胞内钙第二信息系统的生成和活性。可引起PTH样磷酸盐尿和低钙尿症,促进1,25-(OH)2D3合成[18]。
2.8 CTR基因
降钙素受体(CTR)基因型和绝经后的妇女股骨颈骨密度有关,与绝经后妇女的骨密度存在一定的关联。降钙素受体间不同的基因型可能会影响绝经后妇女的骨丢失速率和骨密度,而且存在性别的差异[19]。
2.9 CaSR基因
钙敏感受体(CaSR)是一种分子量为120~160 kDa的C族G蛋白偶联受体(GPCR),在甲状旁腺和肾脏中表达最高,通过调节甲状旁腺激素分泌和尿钙排泄,在全身钙代谢中起关键作用。CaSR功能异常不仅会影响钙代谢性疾病(如甲状旁腺功能亢进症)和非钙代谢性疾病(如心血管疾病和癌症)的发展,还会引发如肿瘤、糖尿病、心肌缺血再灌注损伤等许多全身疾病或脏器损害。
3 骨质疏松相关蛋白
3.1 ApoE
载脂蛋白E(ApoE)作为一种血浆主要载脂蛋白,对维持骨量有重要作用。ApoE通过抑制NF-κB信号通路,抑制OC与树突状细胞功能的协同刺激调节因子(OSCAR)的表达,抑制OC的形成与分化[20]。
3.2 Klotho蛋白
Klotho蛋白可通过调节磷酸盐、骨矿化、维生素D及成骨细胞和破骨细胞的分化成熟、生物活性与细胞凋亡影响骨代谢。Klotho蛋白可通过与Wnt配体结合,或介导FGF23,调控Wnt信号通路,参与骨代谢过程[21]。
3.3 BMPs
骨形态蛋白(BMPs)是多功能生长因子,它属于转化生长因子-β(TGF-β)超家族,有近20种BMPs成员,具有不同程度促进干细胞向成骨细胞分化的能力,是骨组织损伤修复与再生过程的生理基础[22]。
3.4 BSP
骨涎蛋白(BSP)由成骨细胞、破骨细胞等骨相关细胞分泌[23]。BSP可以增加RANKL诱导破骨细胞前体的骨吸收能力,并可以提高细胞内钙离子水平,而破骨细胞的活化亦可提高细胞内钙离子水平,而钙调磷酸酶/NFAT通路可以维持破骨细胞和成骨细胞活性的平衡[24]。
BSP是具有多功能的主要骨细胞外基质非胶原蛋白,它可与αVβ3、αVβ5和RANKL发生相互作用,促进破骨细胞附着和分化以及骨吸收,从而诱发一系列骨吸收性疾病如牙周炎、骨质疏松,以及多种恶性肿瘤的骨转移[25]。
3.5 LRP5
低密度脂蛋白受体相关蛋白5(LRP5)是一种细胞表面信号转导受体。LRP5纯合功能缺失型突变、复合杂合功能缺失型突变及杂合功能缺失型突变患者易发生骨质疏松症。
LRP5单核苷酸多态性与年轻人群峰值骨量的获得和老年人群骨质疏松性骨折风险密切相关[26]。
3.6 AP-1
激活蛋白-1(AP-1)作为RANKL/RANK信号通路的重要转录因子,主要通过NF-κB和JNK、ERK和p38信号通路调节破骨细胞形成,参与骨代谢过程,与骨质疏松、骨肿瘤等代谢性骨疾病的发生发展相关[27]。
3.7 Scl
硬化蛋白(Scl)是SOST基因表达的一种含190个氨基酸的分泌型糖蛋白,骨细胞是其主要来源。
硬化蛋白是在对硬化症(Sclerosteosis)和范布赫姆病(Van Buchem disease)的研究中发现的,在这两种疾病中均发现表达硬化蛋白的SOST编码基因突变,且都表现为高骨量疾病[28]。硬化蛋白是骨形成、骨量和骨强度的负向调节剂[29]。
4 骨质疏松分子治疗靶点
4.1 与Notch信号通路相关的中药有效成分
中药通过Notch信号通路调节成骨。补骨脂具有补肾壮阳、固精缩尿、温脾止泻等功效,现代药理学研究表明,补骨脂具有多种药理活性,包括类雌激素作用,可促进骨再生和重建[30]。
淫羊藿具有补肾阳、强筋骨、祛风湿等功效。
中药有效成分刺五加苷、杜仲总苷和齐墩果酸等均能通过Notch信号通路介导干预BMSCs的成骨分化,在不同程度上改善骨密度,同时影响相关骨细胞的凋亡以防治骨质疏松[31-33]。
葛根素是葛根中含有的一种黄酮类衍生物,葛根素显著抑制破骨细胞形成和分化相关基因表达,通过抑制Notch信号通路使得Notch1、Notch2、Hes1、Jaggde1、Jaggde2蛋白表达量降低。
4.2 Wnt/β-catenin蛋白靶向治疗骨质疏松
中医药可通过作用于Wnt/β-catenin 蛋白介导的信号通路防治骨质疏松。Wnt/β-catenin信号通路是促进骨髓间充质干细胞向成骨细胞分化途径中的重要信号通路之一,信号通路中的各种蛋白均在成骨中起调控作用,同时信号通路在骨质疏松内环境下对促进成骨起重要作用[34]。
Wnt/β-catenin途径失活会抑制成骨细胞的活性,骨吸收增强导致骨量减少。随着年龄的增长,骨质疏松患者骨形成逐渐减少、骨髓脂肪逐渐增加[35]。
Wnt/β-catenin信号通路为骨质疏松症的发病机制及精准靶向治疗提供一定参考,为中药多靶点治疗骨质疏松症提供新思路。
4.3 RANKL单克隆抗体
地舒单抗(denosumab)是一种RANKL抑制剂,为特异性RANKL 的完全人源化单克隆抗体,能够抑制RANKL与其受体RANK结合,减少破骨细胞形成、功能和存活,从而降低骨吸收、增加骨密度、改善皮质骨和松质骨的强度,降低骨折发生风险[36]。
4.4 罗莫佐单抗
罗莫佐单抗(romosozumab)是硬骨抑素单克隆抗体,通过抑制硬骨抑素(sclerostin)的活性,拮抗其对骨代谢的负向调节作用,在促进骨形成的同时抑制骨吸收[37]。
5 结语
成骨细胞、骨细胞和破骨细胞维持骨重建的分子机制永远是骨质疏松科学研究的主要方向,骨代谢生物学信号通路、骨质疏松易感基因、骨质疏松相关蛋白的研究,不仅提升骨质疏松诊断的科技含量和创新,也必将推动骨质疏松分子生物靶向治疗的进程。
执笔:张萌萌 毛未贤 马倩倩
编审:张秀珍(同济大学附属同济医院)、邓伟民(中国人民解放军南部战区总医院)、葛继荣(福建省中医药科学院)、黄宏兴(广州中医药大学第三附属医院)、张岩(上海中医药大学附属龙华医院)、徐辉(吉林大学)、张东伟(北京中医药大学糖尿病研究中心)、史晓林(浙江中医药大学附属第二医院)、李毅中(福建医科大学附属第二医院)、吴岩(内蒙古医科大学)、孔西建(河南省骨科医院)、吴涤(内蒙古科技大学包头医学院)、杨书满(吉林大学)、张晓梅(北京大学国际医院)、张智海(中国中医科学院广安门医院)、马勇(南京中医药大学)、陈允震(山东大学齐鲁医院)、邹军(上海体育大学)、赵东峰 (上海中医药大学附属龙华医院)、周惠琼(中国人民解放军总医院第四医学中心)、赵国阳(江苏大学附属医院)、王永福(内蒙古科技大学包头医学院第一附属医院)、李英华(上海市第五人民医院)、方秀统(首都医科大学北京世纪坛医院)、胡玲(南昌大学第三附属医院)
